Содержание
- 2. §§ Циклы 02 Круговым процессом (циклом) называется процесс, при котором система, пройдя ряд состояний, возвращается в
- 3. 03 A цикл Работа совершается над системой (холодильная машина) Происходит превращение работы в теплоту , т.к.
- 4. §§ КПД цикла 04 Тепловая машина термодинамически действующее устройство, совершающее работу за счет подводимого из вне
- 5. 05 Для кругового процесса т.е. работа совершается за счет поступающей энергии На участке цикла рабочее тело
- 6. 06 Пусть Q1 – количество энергии, полученное системой от нагревателя Q2 – количество энергии, отданное холодильнику
- 7. 07 Существует бесконечное множество циклов и у каждого свой КПД. В механике циклы используют для преобразования
- 8. §§ Цикл Карно 08 Рассмотрим наиболее эффективный цикл, состоящий из двух изотерм T1 и T2 и
- 9. 09 1→2 – изотермическое расширение – за счет нагревателя 2→3 – адиабатическое расширение
- 10. 10 Аналогично следовательно
- 11. 11 Работа за цикл Вычислим КПД:
- 12. КПД всякой ТМ не может превосходить КПД идеальной ТМ, 12 Теорема Карно–Клаузиуса КПД тепловой машины, работающей
- 13. §§ Обратимые процессы 13 Обратимым называется процесс, для которого возможен обратный переход из конечного состояния в
- 14. если система проходит ряд непрерывно следующих друг за другом равновесных состояний 14 Процесс – равновесный, Условия
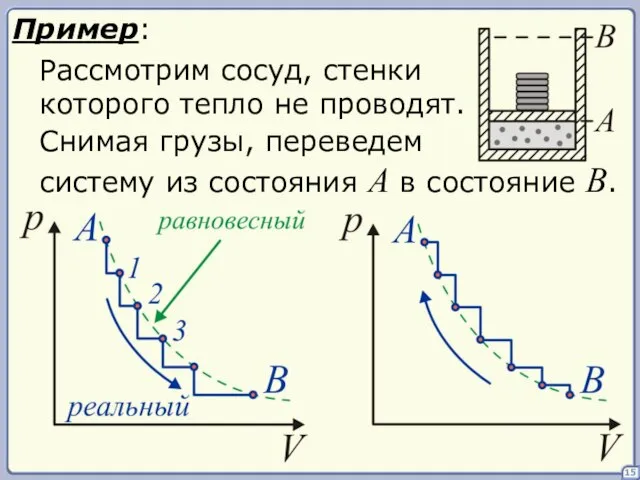
- 15. 15 Пример: Рассмотрим сосуд, стенки которого тепло не проводят. Снимая грузы, переведем систему из состояния A
- 16. 16 Все реальные процессы протекают с конечной скоростью и являются необратимыми и неравновесными. Это приводит к
- 17. 17 Сравним КПД неравновесной и равновесной машины, работающей по циклу Карно: – неравенство Клаузиуса приведенная теплота
- 18. §§ Энтропия идеального газа I-е начало в дифференциальной форме 18 функция состояния полный дифференциал (Q –
- 19. 19 Из уравнения М–К: Получаем
- 20. 20 тогда правая часть – дифференциал новой функции состояния S – энтропия Это выражение справедливо только
- 21. 21 §§ Основное уравнение ТД Согласно первому началу и для равновесного процесса получаем основное уравнение термодинамики
- 22. §§ Физический смысл S 22 Рассмотрим идеальный газ, ν = 1 моль, в объеме V. N
- 23. 23 Вычислим Г – число микросостояний, которое может реализоваться в системе Оно равно числу способов размещения
- 24. 24 ≈ Для идеального газа
- 25. и считают, что энтропия пропорциональна 25 и const часто полагают равной нулю логарифму числа пространственных микросостояний
- 26. §§ II-е начало термодинамики 26 Система, предоставленная самой себе, приходит к равновесному состоянию, т.е. энтропия не
- 27. 27 Пусть замкнутая система переходит из состояния 1 в состояние 2. Возвратим систему в состояние 1
- 28. 28 Следовательно, При переходе замкнутой системы энтропия либо увеличивается, либо не изменяется из состояния 1 (с
- 29. §§ Тепловая теорема Нернста 29 Первое утверждение При приближении к абсолютному нулю энтропия стремится к определенному
- 31. Скачать презентацию
















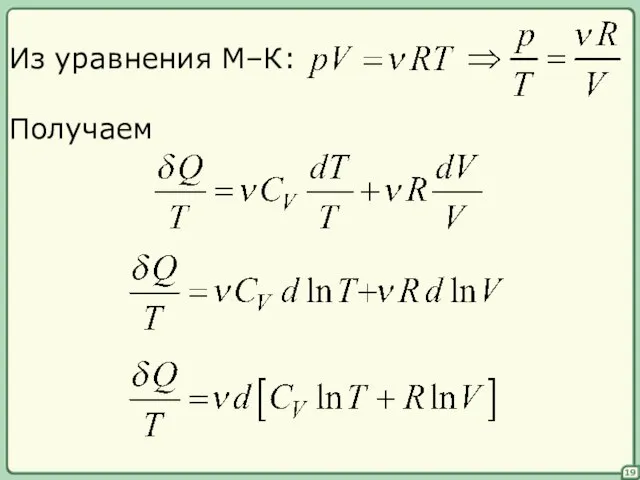










 Автор презентации – учитель МКОУ СОШ №11 г. Палласовки Волгоградской области Букешева Гулзара Нурболатовна
Автор презентации – учитель МКОУ СОШ №11 г. Палласовки Волгоградской области Букешева Гулзара Нурболатовна  КИМ ЕГЭ по физике в 2015 г.
КИМ ЕГЭ по физике в 2015 г. Физический факультет
Физический факультет Отчёт по производственной практике. Анализ обязанностей механика, дежурного слесаря
Отчёт по производственной практике. Анализ обязанностей механика, дежурного слесаря Обработка экспериментальных данных. Часть 2
Обработка экспериментальных данных. Часть 2 Законы динамики Ньютона
Законы динамики Ньютона Лазер. Устройство лазера
Лазер. Устройство лазера Волновые свойства света
Волновые свойства света Презентация по физике. 8 класс. Лабораторная работа №1. Цель: в ходе эксперимента познакомиться с уравнением теплового баланса. А
Презентация по физике. 8 класс. Лабораторная работа №1. Цель: в ходе эксперимента познакомиться с уравнением теплового баланса. А Диффузия. Движение молекул
Диффузия. Движение молекул Исследование динамики развития плазмы вакуумной искры методом высокоскоростной фоторегистрации
Исследование динамики развития плазмы вакуумной искры методом высокоскоростной фоторегистрации Исаак Ньютон
Исаак Ньютон Обработка результатов численного эксперимента
Обработка результатов численного эксперимента Градуировка спектроскопа определение длины волны спектральных линий
Градуировка спектроскопа определение длины волны спектральных линий Закон сохранения энергии
Закон сохранения энергии Энергия
Энергия Интерференция света. Электромагнитная природа света
Интерференция света. Электромагнитная природа света Радиометрия и ядерная геофизика. (Лекция 8)
Радиометрия и ядерная геофизика. (Лекция 8) Electrical potentials of the cell
Electrical potentials of the cell Вимірювання елементарного електричного заряду Мельникова Катя Гринчишин Маріанна 11-А
Вимірювання елементарного електричного заряду Мельникова Катя Гринчишин Маріанна 11-А  Эволюция механики
Эволюция механики Определение проекции силы на координатную ось
Определение проекции силы на координатную ось Отто Штерн
Отто Штерн  Презентация по физике на тему: «Двигатель внутреннего сгорания»
Презентация по физике на тему: «Двигатель внутреннего сгорания» Техническая термодинамика. Первый закон термодинамики. (Лекция 2)
Техническая термодинамика. Первый закон термодинамики. (Лекция 2) Инфракрасная Фурье спектроскопия
Инфракрасная Фурье спектроскопия Георг Симон Ом
Георг Симон Ом Динамика межфазного распределения радионуклидов
Динамика межфазного распределения радионуклидов