Содержание
- 2. Система контроля знаний Виды работ Баллы 1. Контрольные работы: Физико-химические процессы в гидросфере 10 Физико-химические процессы
- 3. Гидросфера - водная оболочка Земли, представляющая совокупность всех водных объектов планеты: океанов, морей, рек, озер, болот,
- 4. Границы гидросферы Воды Мирового океана охватывают территорию в 71% Земли. Средняя глубина океана составляет 3800 метров,
- 5. Вода - единственное химическое вещество, которое находится в природе в 3-х агрегатных состояниях. Свойства воды, играющие
- 6. Высокая теплоемкость воды (выше, чем у всех твердых и жидких веществ- за исключением аммиака и водорода)
- 7. Высокая теплота плавления воды, т.е. льда. Весна и осень на Земле - фазовый переход воды. Сравнительно
- 8. Высокая теплота испарения Наибольшее значение теплоты испарения приводит к тому, что большая часть солнечной энергии, достигающей
- 9. Свойства воды, играющие важную роль в поддержании жизни на Земле: Поверхностное натяжение Максимальное, за исключением ртути,
- 10. Диэлектрическая постоянная Диэлектрическая постоянная имеет аномально высокое значение. Это определяет самую большую растворяющую способность воды по
- 11. Соленость, или общая минерализация Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ.
- 12. Классификация природных вод по величине их минерализации
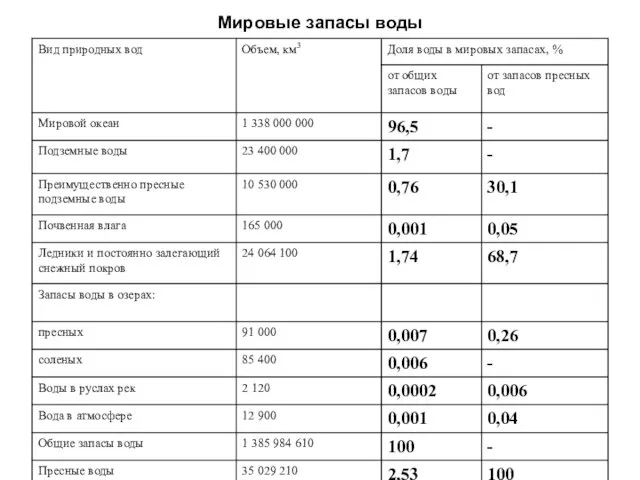
- 14. Мировые запасы воды
- 16. Глобальный кругооборот воды в природе Qиспарения = Qосадки Qиспарения = Qиспарения океан + Qиспарения суша 520
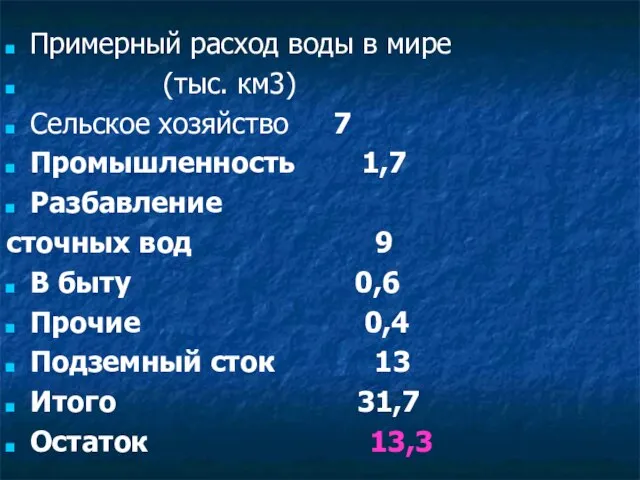
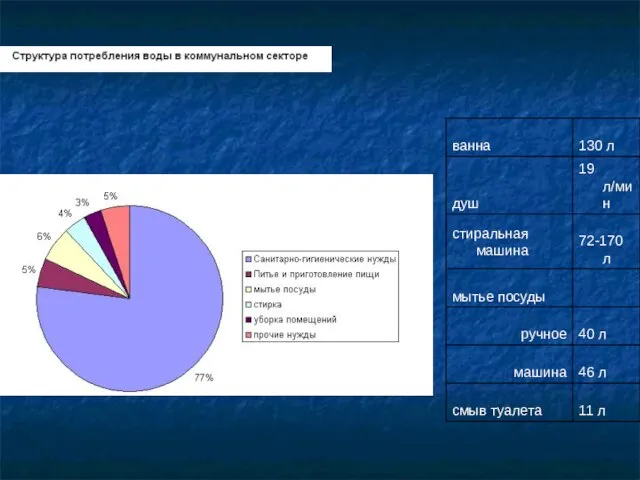
- 17. Примерный расход воды в мире (тыс. км3) Сельское хозяйство 7 Промышленность 1,7 Разбавление сточных вод 9
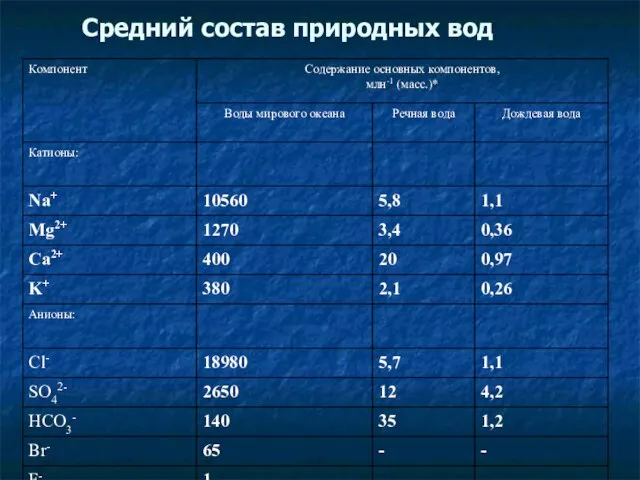
- 21. Средний состав природных вод
- 22. Легко заметить, что для всех рассмотренных нами природных вод более 90% растворенных солей представлено одними и
- 23. В океанической воде обнаружены практически все элементы, но содержание их весьма различно. На первые восемь элементов
- 24. Для выражения концентрации примеси в растворах, как и для газов используется понятие миллионной доли (млн-1 или
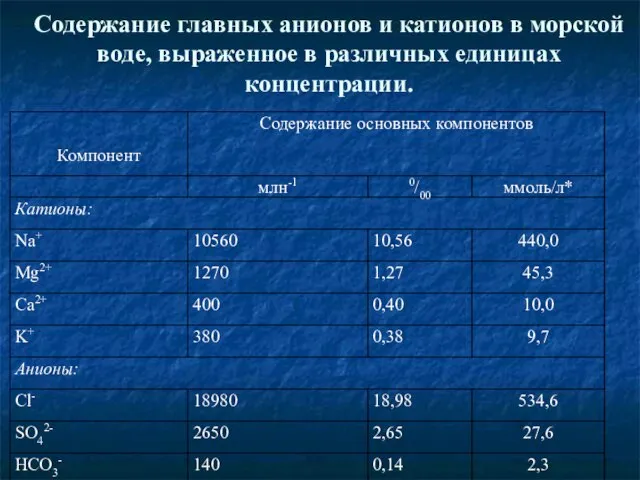
- 25. Пример. Выразите содержание главных катионов и главных анионов морской воды в промиллях и миллимолях на литр.
- 26. Содержание главных анионов и катионов в морской воде, выраженное в различных единицах концентрации.
- 27. Для удобства представления химического состава природных вод принято использовать запись не в виде таблиц, а в
- 28. Пример . Представьте средний состав морской воды, концентрация растворенного диоксида углерода в которой составляет 1000 мг/л,
- 29. Для перевода концентраций в ммоль-экв/л необходимо разделить значение концентрации компонента, выраженные в ммоль/л, на соответствующий фактор
- 30. Для перевода концентраций в ммоль-экв/л необходимо умножить значение концентрации компонента, выраженные в ммоль/л, на соответствующий фактор
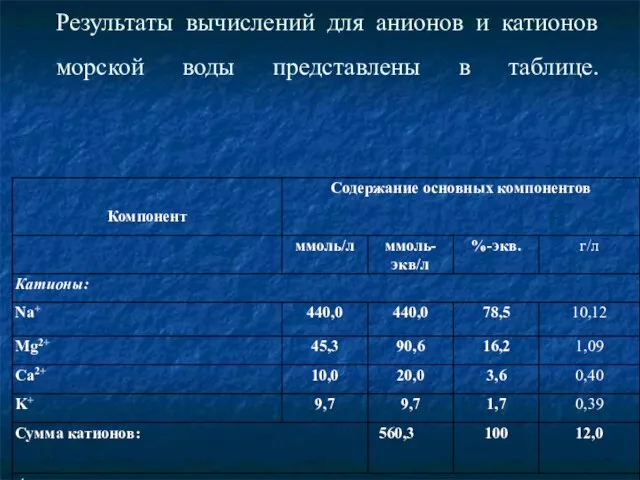
- 31. На следующем этапе определим суммарные концентрации анионов и катионов в ммоль-экв./л и процентное содержание каждого иона
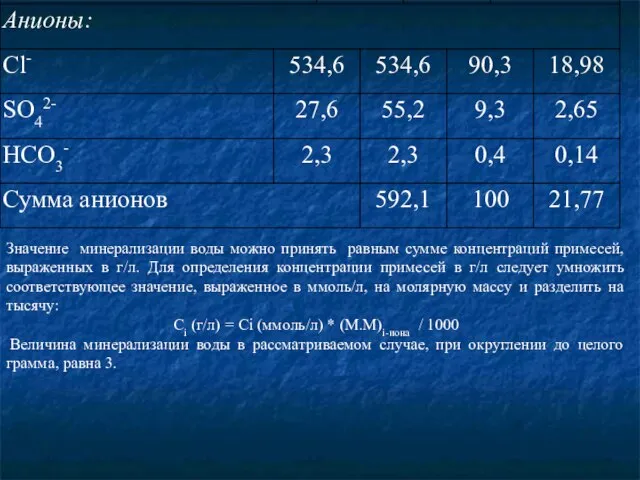
- 32. Результаты вычислений для анионов и катионов морской воды представлены в таблице.
- 33. Значение минерализации воды можно принять равным сумме концентраций примесей, выраженных в г/л. Для определения концентрации примесей
- 34. В соответствии с требованиями записи в виде формулы состав морской воды можно представить в виде дроби,
- 35. Состав данной воды можно представить в следующем виде: СО21000М(3/592)*[Cl(90,3)SO4(9,3)]/[Na(78,5)Mg(16,2)Ca(3,6) K(1,7)]
- 36. Закон Дитмара В воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного
- 37. Под “хлорностью” воды подразумевают число граммов ионов хлора, эквивалентное сумме галогенов, осаждаемых азотнокислым серебром, содержащееся в
- 38. Формирования состава природных вод По характеру воздействия: Физико-географические (рельеф, климат и т.п.); Геологические (вид горных пород,
- 39. Процессы растворения газов в природных водах Закон Генри [Сi,р-р] = КГi * Рi где Сi,р-р –
- 43. «Главные» растворимые минералы Галит – NaCl (KCl) Гипс - CaSO4*2H2O Кальцит – CaCO3 Доломит – СaMg(CO3)
- 44. Жесткость природных вод Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния.
- 45. По величине общей жесткости природные воды принято делить на ряд групп: вода очень мягкая - Ж
- 46. Немецкий градус жесткости соответствует содержанию в воде 10, 0 мг/л СаО. Один Французкий градус жесткости соответствует
- 47. Растворимость карбонатов и рН подземных и поверхностных природных вод Процесс непосредственного растворения карбоната кальция по уравнению:
- 50. Щелочность природных вод Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта
- 51. Процессы закисления поверхностных водоемов Первый этап. Щ=0,1 ммоль/л Обычно рН =7-8. В период интесивного поступления кислых
- 52. Процессы закисления поверхностных водоемов Третий этап закисления Щ = 0; рН водоемов стабилизируется на значениях рН
- 53. Интегральная характеристика загрязненности а) Химическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в
- 54. б) Биологическая потребность в кислороде Это количество кислорода, необходимое для окисления примесей в 1 литре сточной
- 55. Процесс окисления органического вещества общей формулой {CH2О} можно представить следующим уравнением реакции: {CH2О} + О2 =
- 56. СТРАТИФИКАЦИЯ ВОДОЕМОВ Разделение водоема на слои при температурной стратификации Верхний слой ЭПИЛИМНИОН Средний слой Зона термоклина
- 57. Эфтрофикация (эвтрофикация)водоемов. повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов естественного или
- 58. БИОГЕНЫ - нитрат, фосфат, калий - ионы: Удобрения Отходы животноводства Отходы человека Фосфат- содержащие моющие средства.
- 59. 2Cорг + SO42- + 2H2O = H2S + 2HCO3-
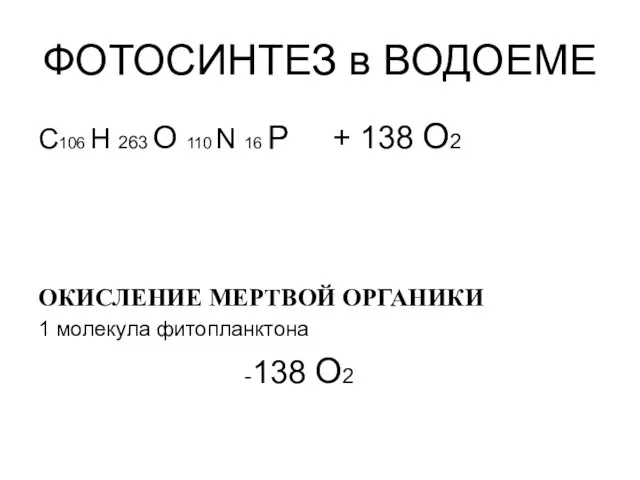
- 60. ФОТОСИНТЕЗ в ВОДОЕМЕ C106 H 263 O 110 N 16 P + 138 О2 ОКИСЛЕНИЕ МЕРТВОЙ
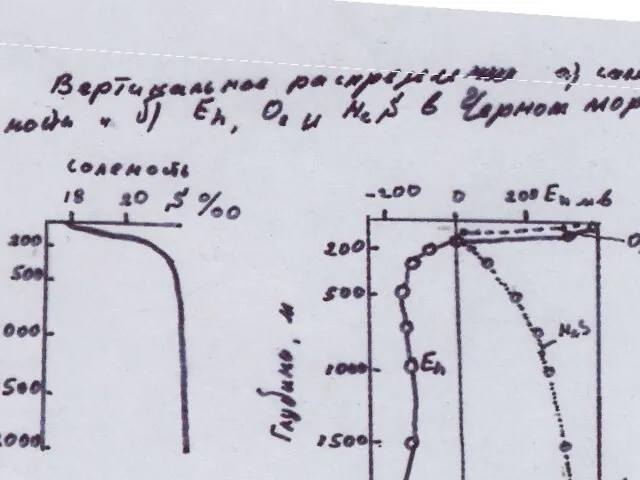
- 61. Окислительно-восстановительные процессы в гидросфере Окислительно-восстановительные реакции исключительно важную роль в описании процессов протекающих в природных водоемах.
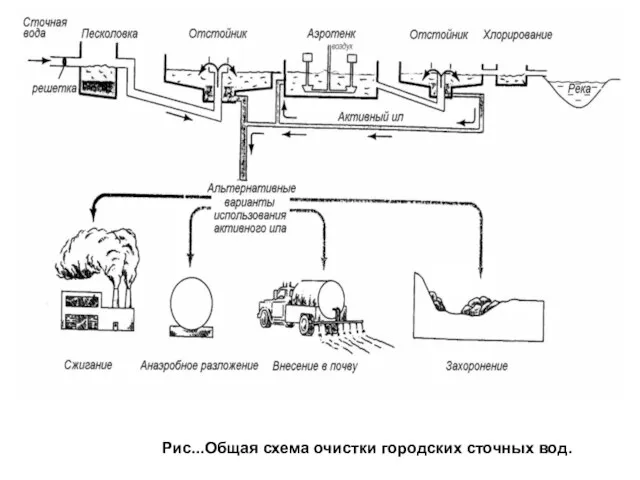
- 65. Рис...Общая схема очистки городских сточных вод.
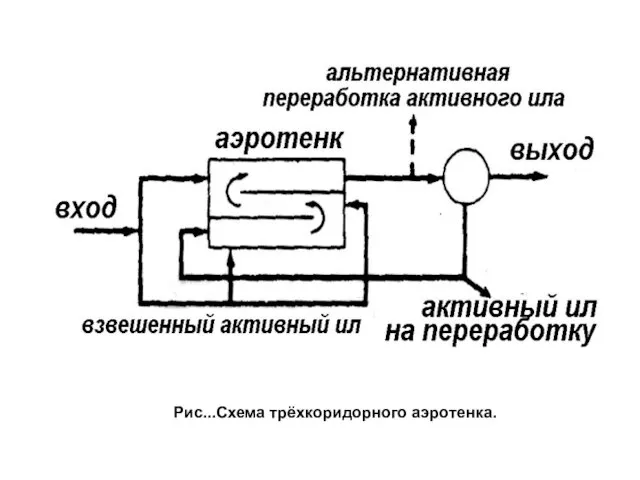
- 66. Рис...Схема трёхкоридорного аэротенка.
- 67. Очистка от органических веществ Аэробный процесс Для жизнедеятельности живых организмов необходимо поддерживать соответствующие условия: температура процесса
- 69. Скачать презентацию
























![Состав данной воды можно представить в следующем виде: СО21000М(3/592)*[Cl(90,3)SO4(9,3)]/[Na(78,5)Mg(16,2)Ca(3,6) K(1,7)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/562236/slide-34.jpg)



![Процессы растворения газов в природных водах Закон Генри [Сi,р-р] = КГi](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/562236/slide-38.jpg)



















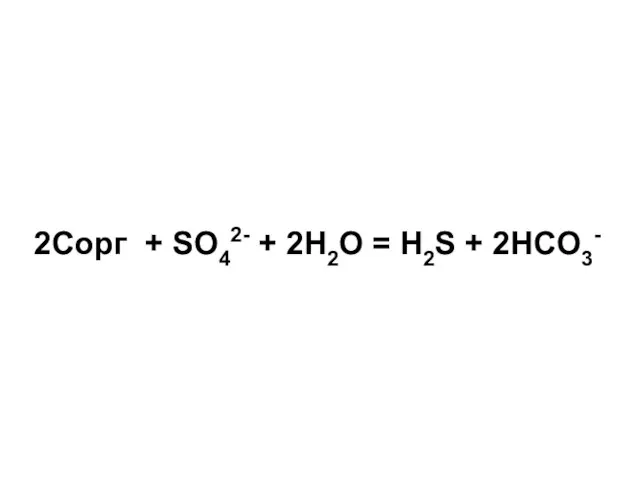



 Африка. Географическое положение
Африка. Географическое положение География и распространение редких и исчезающих видов позвоночных животных ВКО Хромов В.А. Семипалатинский государственный пед
География и распространение редких и исчезающих видов позвоночных животных ВКО Хромов В.А. Семипалатинский государственный пед Причины, влияющие на климат России
Причины, влияющие на климат России НИВЕЛИРОВАНИЕ(2019)
НИВЕЛИРОВАНИЕ(2019) Масштаб и его виды
Масштаб и его виды Презентация на тему Саудовская Аравия
Презентация на тему Саудовская Аравия  Географическое положение и история исследования Южной Америки
Географическое положение и история исследования Южной Америки Подготовка к ОГЭ. Задание 3
Подготовка к ОГЭ. Задание 3 Грозное дыхание Земли
Грозное дыхание Земли Радиация - презентация к уроку Географии
Радиация - презентация к уроку Географии Камни на ножках горы Воттоваара
Камни на ножках горы Воттоваара Специальный административный район КНР- Гонконг
Специальный административный район КНР- Гонконг КУРГАНИНСК- скромный городок
КУРГАНИНСК- скромный городок География 6 класс
География 6 класс  Донецкий економический район Украины - презентация к уроку Географии
Донецкий економический район Украины - презентация к уроку Географии Презентация на тему: Цунами
Презентация на тему: Цунами Нижний Новгород - презентация к уроку Географии
Нижний Новгород - презентация к уроку Географии Презентация На тему : «Кунгурская ледяная пещера»
Презентация На тему : «Кунгурская ледяная пещера» Что изучает география?
Что изучает география? Природные зоны России
Природные зоны России Франція Французька Республіка. Назва країни по етноніму німецького племені — франки. Площа — 552 тис. км кв. Населення — 58,1 млн
Франція Французька Республіка. Назва країни по етноніму німецького племені — франки. Площа — 552 тис. км кв. Населення — 58,1 млн Япония-страна восходящего солнца
Япония-страна восходящего солнца Африка. Пустыня
Африка. Пустыня Глобальная проблема продовольствия - презентация к уроку Географии_
Глобальная проблема продовольствия - презентация к уроку Географии_ Маршруты пройденные туристическим клубом легенда
Маршруты пройденные туристическим клубом легенда География Алтайского края
География Алтайского края  Движение вод Мирового океана
Движение вод Мирового океана Топливно-энергетический комплекс (ТЭК) России
Топливно-энергетический комплекс (ТЭК) России