Содержание
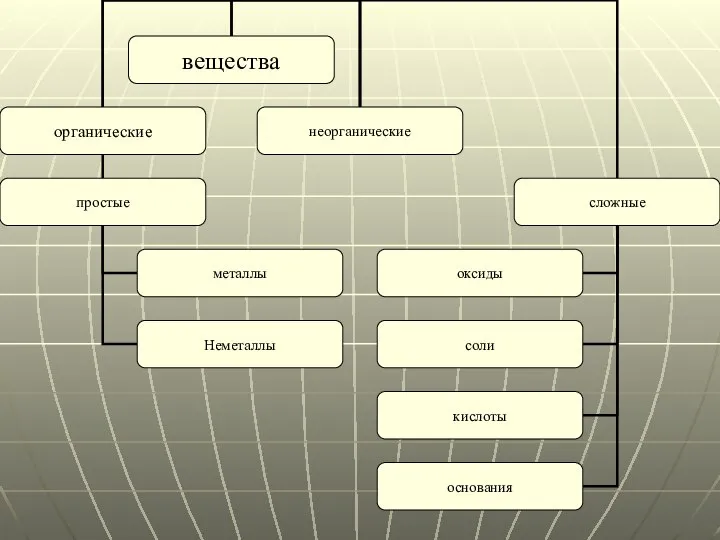
- 2. Содержание Вещества Неорганические соединения Классификация неорганических соединений Простые вещества Металлы Неметаллы Аллотропия Агрегатное состояние Сложные вещества
- 4. Неорганические вещества Неорганическое вещество или неорганическое соединение — это химическое вещество, химическое соединение, которое не является
- 6. Простые вещества Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента. Они делятся на
- 7. Металлы Мета́лл (название происходит от лат. metallum — шахта) — группа элементов, обладающая характерными металлическими свойствами,
- 8. Неметаллы Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы
- 9. Аллотропные модификации Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента, либо различным строением
- 10. Агрегатное состояние При нормальных условиях, соответствующие простые вещества 11-ти элементов являются газами (H, He, N, O,
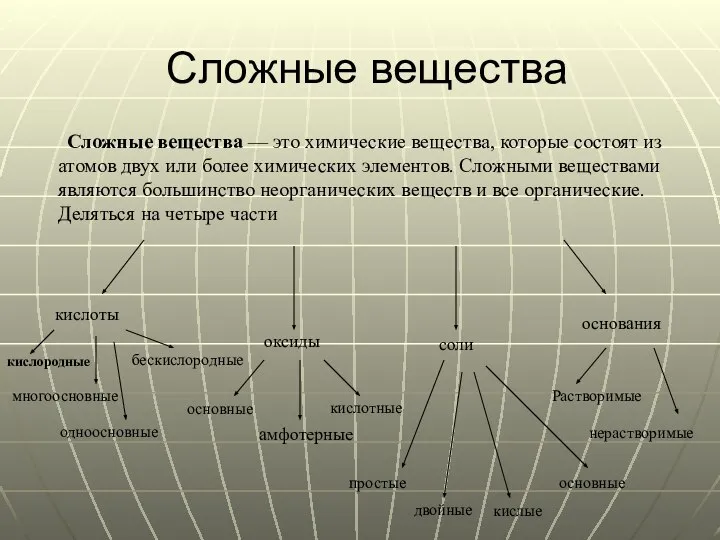
- 11. Сложные вещества Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических
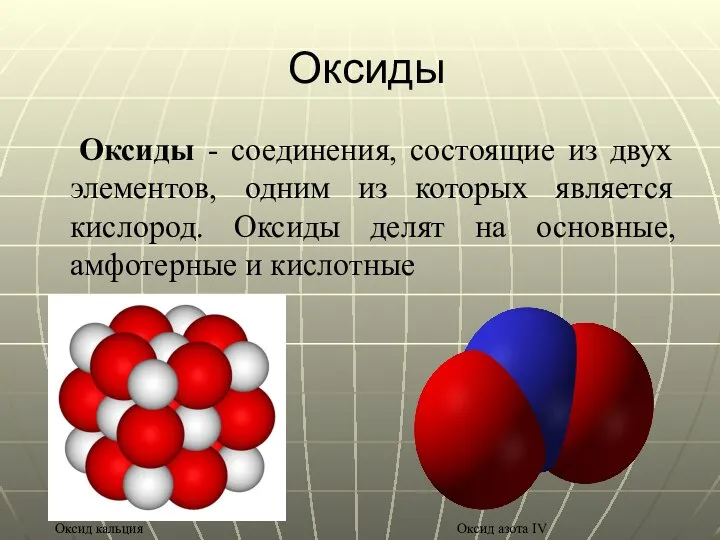
- 12. Оксиды Оксиды - соединения, состоящие из двух элементов, одним из которых является кислород. Оксиды делят на
- 13. Химические свойства Основные оксиды 1. Основный оксид + кислота = соль + вода CuO + H2SO4
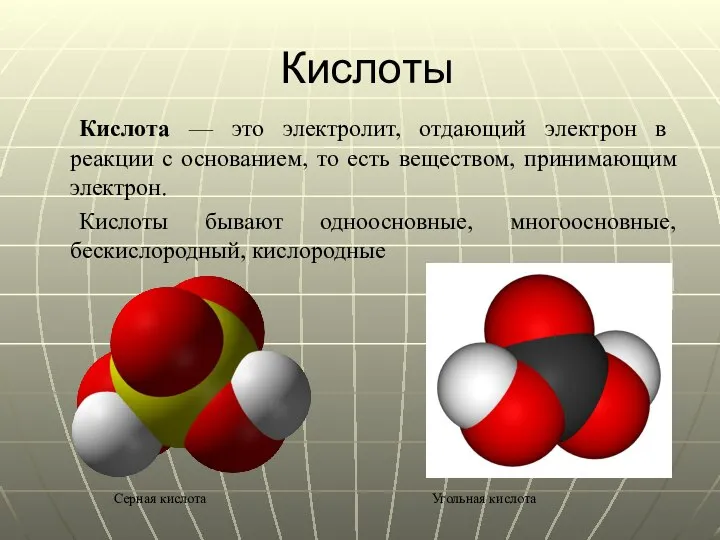
- 14. Кислоты Кислота — это электролит, отдающий электрон в реакции с основанием, то есть веществом, принимающим электрон.
- 15. Химические свойства Взаимодействие с оксидами металлов Взаимодействие с амфотерными оксидами Взаимодействие с щелочами Взаимодействие с нерастворимыми
- 16. Основания Основания — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или
- 17. Химические свойства Действие на индикаторы: лакмус - синий, метилоранж - жёлтый, фенолфталеин - малиновый, 2. Основание
- 18. Соли Соли — вещества, состоящие из катионов металла и анионов кислотного остатка. Бывают простые, двойные, кислотные
- 20. Скачать презентацию













 Фтор (Fluorum), F
Фтор (Fluorum), F Введение. Основные понятия химии
Введение. Основные понятия химии Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій
Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій  Интеллектуальная викторина по химии для учащихся 8-9 классов
Интеллектуальная викторина по химии для учащихся 8-9 классов Хімічні явища в природі
Хімічні явища в природі Алканы
Алканы Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация Лекарства дома
Презентация Лекарства дома Липиды. Строение, свойства, функции. (Лекция 6)
Липиды. Строение, свойства, функции. (Лекция 6) Свойства живого вещества
Свойства живого вещества Применение нитратов
Применение нитратов  Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Исторические аспекты возникновения и развития. Теории химического строения
Исторические аспекты возникновения и развития. Теории химического строения Химия в косметике
Химия в косметике Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2)
Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2) “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Геологические условия формирования месторождений полезных ископаемых. (Лекция 3)
Геологические условия формирования месторождений полезных ископаемых. (Лекция 3) Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Геохимия техногенеза
Геохимия техногенеза Кристаллическая решетка
Кристаллическая решетка Сера
Сера Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  ЕГЭ по химии Технология подготовки учащихся
ЕГЭ по химии Технология подготовки учащихся педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого
педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого Методы определения подлинности лекарственного растительного сырья
Методы определения подлинности лекарственного растительного сырья Алканы. Получение и применение алканов
Алканы. Получение и применение алканов Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Оксиды: получение, свойства, применение
Оксиды: получение, свойства, применение