Содержание
- 2. www.fipi.ru
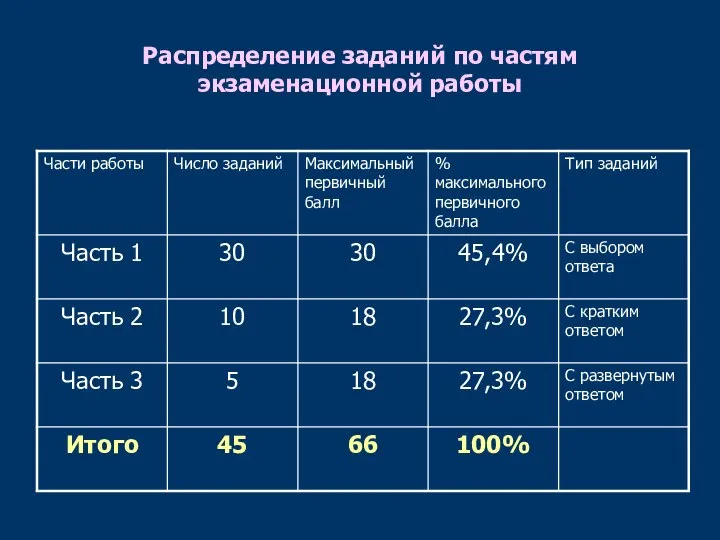
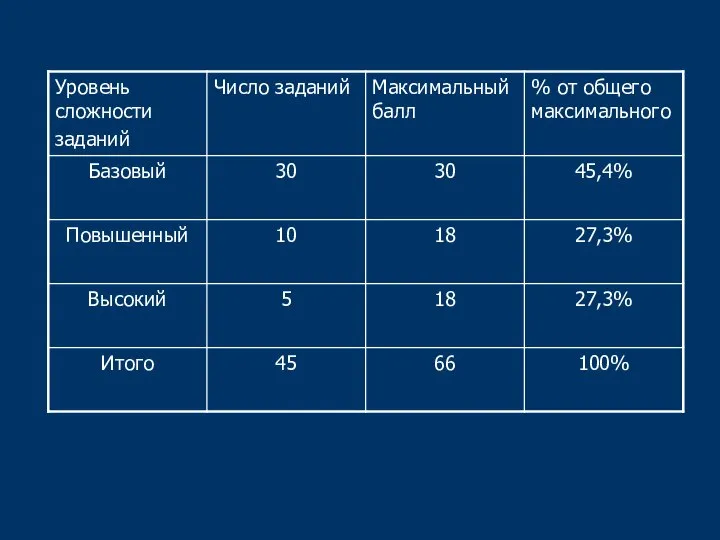
- 4. Распределение заданий по частям экзаменационной работы
- 6. Структура КИМ ЕГЭ A1 Строение атома A2 Периодический закон и ПСХЭ A3 Металлы главных и побочных
- 7. A6 Электроотрицательность. Степени окисления A7 Кристаллические решетки A8 Классификация веществ, номенклатура A9 - A12 Химические свойства
- 8. A14 Изомеры и гомологи σ- и π-Связи. Типы гибридизации A15-A17 Химические свойства классов органических веществ A18
- 9. A21 Классификация химических реакций А22 Скорость химических реакций A23 Обратимые и необратимые реакции A24 Электролитическая диссоциация
- 10. A27 ОВР A28 Вещества в нашей жизни. Применение веществ. Распознавание веществ A29 Химия в промышленности и
- 11. Часть B B1 Классификация и номенклатура веществ B2 Степени окисления. ОВР B3 Электролиз B4 Гидролиз B5
- 12. Часть B B6 Углеводороды B7 Кислородсодержащие орг.вещества B8 Азотсодержащие орг.вещества B9 Задача B10 Задача
- 13. С1 Используя метод электронного баланса, составьте уравнение реакции: Si + HNO3 + HF = = H2SiF6
- 14. C2 Даны вещества: сера сероводород азотная кислота (конц.) серная кислота (конц.) Приведите уравнения четырех возможных реакций
- 15. С3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: H2O, KOH, t ° пропилацетат
- 16. C4 Какой объем хлора (н.у.) выделится, если к 200 мл 35%-ной соляной кислоты (плотность 1,17 г/мл)
- 17. С5 При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г
- 19. Скачать презентацию












 Интеррактивный кроссворд на тему: Химическая посуда и лабораторное оборудование
Интеррактивный кроссворд на тему: Химическая посуда и лабораторное оборудование Химическая термодинамика
Химическая термодинамика Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения Введение в геологию и минералогию
Введение в геологию и минералогию Презентация по Химии "Кристаллы" - скачать смотреть
Презентация по Химии "Кристаллы" - скачать смотреть  Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Нефть и способы её переработки
Нефть и способы её переработки Презентация по Химии "Исследование содержания аскорбиновой кислоты в плодах яблони" - скачать смотреть
Презентация по Химии "Исследование содержания аскорбиновой кислоты в плодах яблони" - скачать смотреть  Кремний. Нахождение в природе. Свойства
Кремний. Нахождение в природе. Свойства Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Органическая химия. (Урок 1-2)
Органическая химия. (Урок 1-2) Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Явище ізомерії. Структурна ізомерія. Близнюки органічного світу
Явище ізомерії. Структурна ізомерія. Близнюки органічного світу Шоколад. Плюсы и минусы
Шоколад. Плюсы и минусы Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Химический элемент. Неон
Химический элемент. Неон Создание косметических средств
Создание косметических средств Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Карбон Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Карбон Характеристика елемента та утворених ним сполук, кругообіг елемента в природі  Влияние галогенов на организм человека
Влияние галогенов на организм человека Карбонильные соединения
Карбонильные соединения Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі Химия углеводородов. Часть 2
Химия углеводородов. Часть 2 Топливо. Механические топки
Топливо. Механические топки