Содержание
- 2. 1 Окислительно-восстановительные реакции. Электронный баланс
- 3. Окислительно-восстановительные реакции (1) Используя метод электронного баланса, составьте уравнение реакции: Cr2(SO4)3 + … + NaOH =
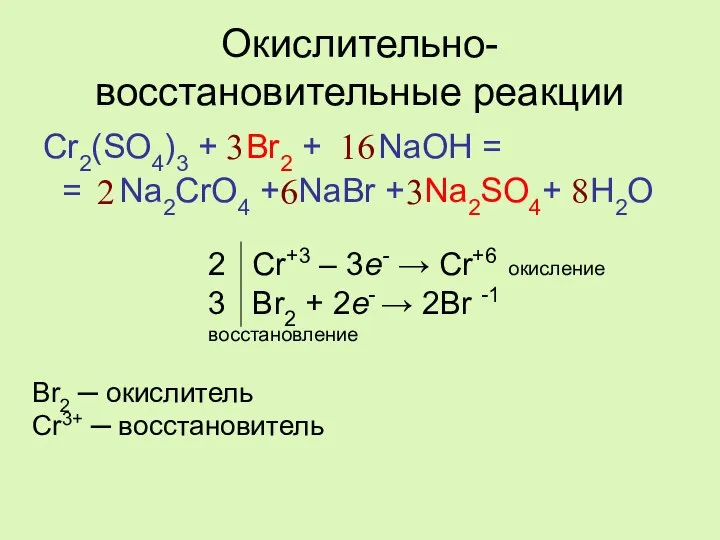
- 4. Окислительно-восстановительные реакции Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O 2
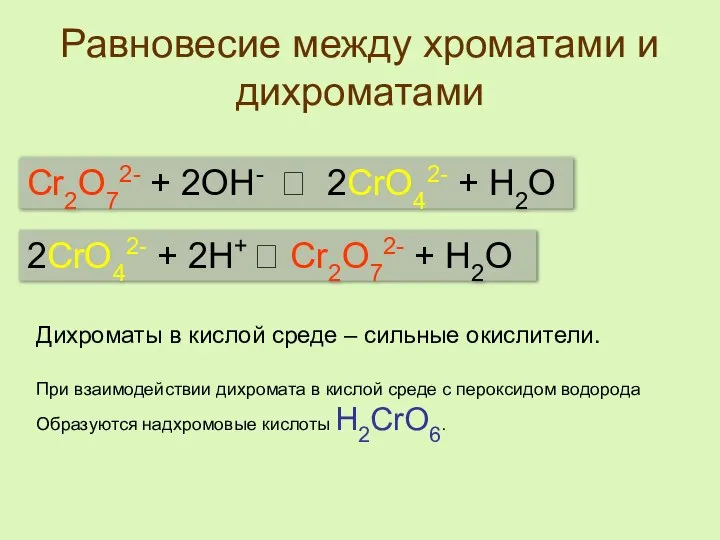
- 5. Равновесие между хроматами и дихроматами Cr2O72- + 2OH- 2CrO42- + H2O 2CrO42- + 2H+
- 6. Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– + 2OH- + 8H2O +3 +6
- 7. Окислительно-восстановительные реакции Используя метод электронного баланса, составьте уравнение реакции: Si + HNO3 + HF = =
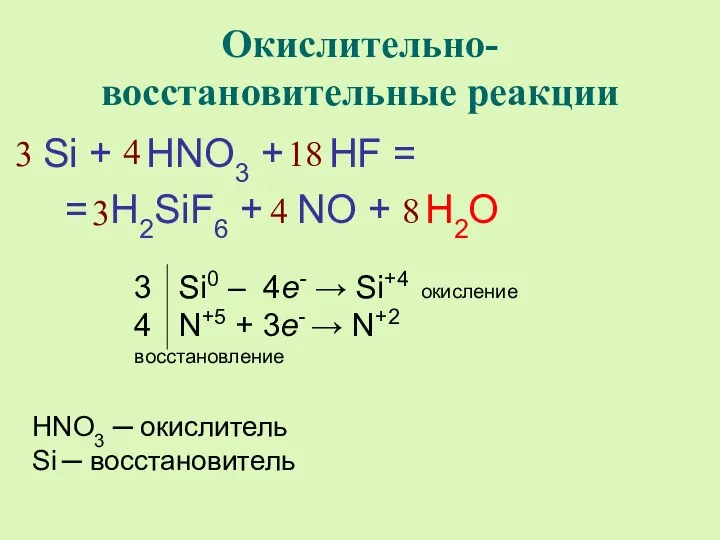
- 8. Окислительно-восстановительные реакции Si + HNO3 + HF = = H2SiF6 + NO + H2O 4 3
- 9. Еще примеры K2Cr2O7 + HCl = Cl2 + KCl + …+ … K2Cr2O7 + … +
- 10. 2 Генетическая связь между классами неорганических веществ
- 11. Образцы заданий (неорг) Даны вещества: магний, азот, аммиак, азотная кислота (разб.). Напишите уравнения четырех возможных реакций
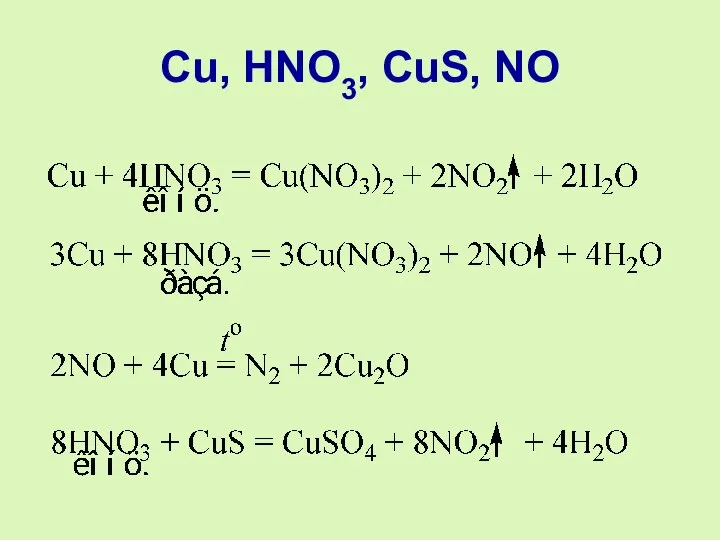
- 12. Cu, HNO3, CuS, NO
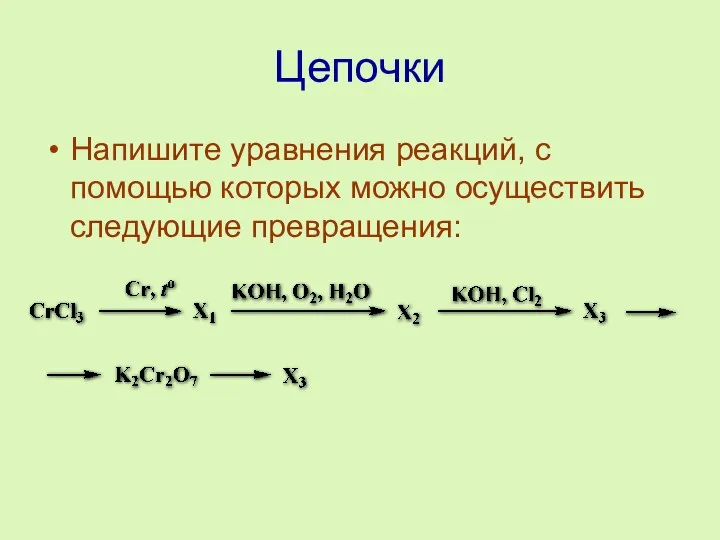
- 13. Цепочки Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
- 14. Решение по Cr
- 15. 3 Генетическая связь между классами органических веществ
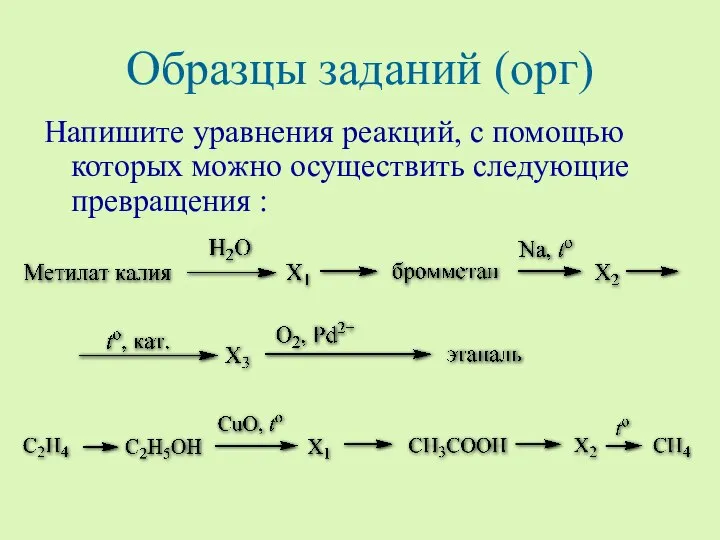
- 16. Образцы заданий (орг) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения :
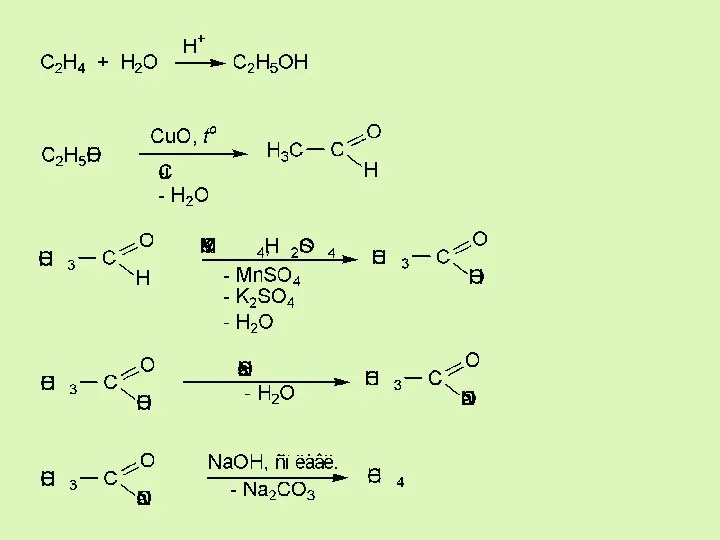
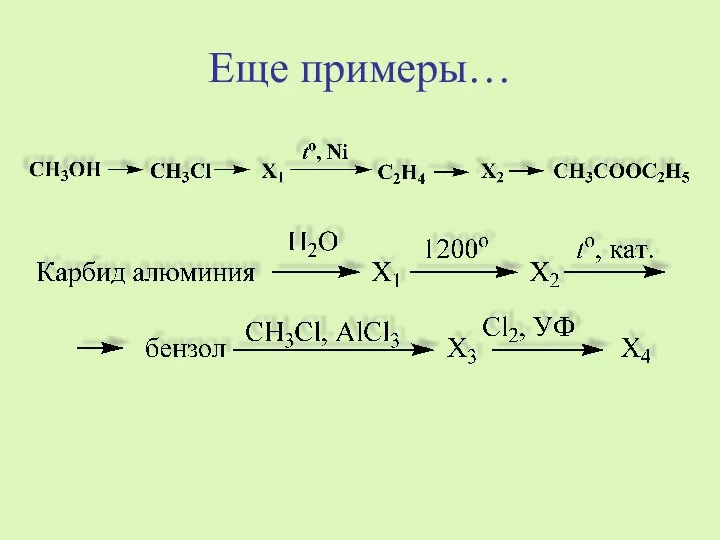
- 18. Еще примеры…
- 19. 4 Задача по теме «Растворы»
- 20. Примеры заданий К 1170 г 0,5% раствора хлорида натрия прилили 1275 г 0,2%-ного раствора нитрата серебра.
- 21. Примеры заданий Хлор без остатка прореагировал с 228,58 мл 5%-ного раствора NaOH (плотность 1,05 г/мл) при
- 22. 5 Задача на вывод формул
- 23. Примеры заданий При термическом разложении вещества образовалось 16 г CuO, 18,4 г NO2 и 2,24 л
- 24. Разберем задачу… При полном сжигании вещества, не содержащего кислорода, образуются азот и вода. Относительная плотность паров
- 25. Решение NxHy + (x/2) O2 = (x/2) N2 + (y/2) H2O DH2 (NxHy) = 16 M
- 27. Скачать презентацию


![Окисление Cr(III) в Cr(VI) [Cr(OH)6]3- + 3 H2O2 = CrO42– +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1192886/slide-5.jpg)

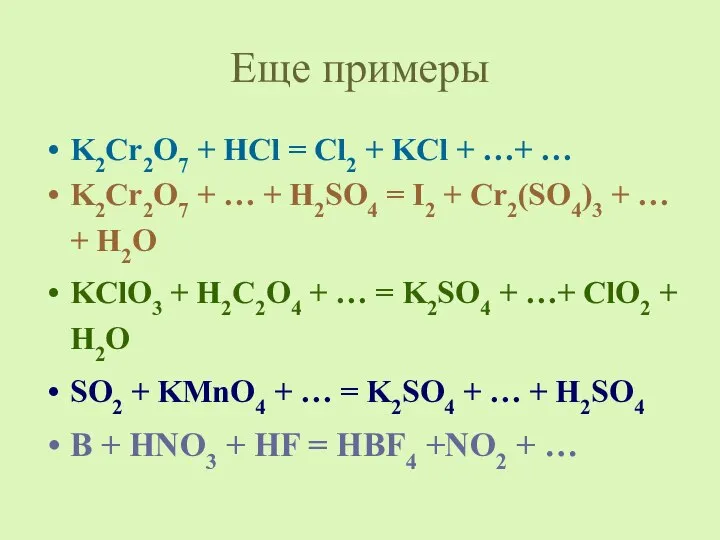











 Фенолы Простые эфиры
Фенолы Простые эфиры Н2, NaCl, Ca, HCl
Н2, NaCl, Ca, HCl A laboratory examination of double replacement reaction
A laboratory examination of double replacement reaction Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Химиялык байланыстар
Химиялык байланыстар Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум
Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум Основы органической химии. Кислородсодержащие органические соединения
Основы органической химии. Кислородсодержащие органические соединения Химия гетероциклических соединений
Химия гетероциклических соединений Ленгмюр адсорбциясының мономолекулярлық теориясы. Дәріс 11
Ленгмюр адсорбциясының мономолекулярлық теориясы. Дәріс 11 Химия в быту
Химия в быту Химическая картина мира
Химическая картина мира Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Азот в природе
Азот в природе Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Характеристика высших гидроксидов по положению в ПСХЭ
Характеристика высших гидроксидов по положению в ПСХЭ Органические соединения и их классификация
Органические соединения и их классификация Тема урока Железо Цель урока: Рассмотреть электронное строение атома железа, дать общую характеристику его. Изучить основные
Тема урока Железо Цель урока: Рассмотреть электронное строение атома железа, дать общую характеристику его. Изучить основные  Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии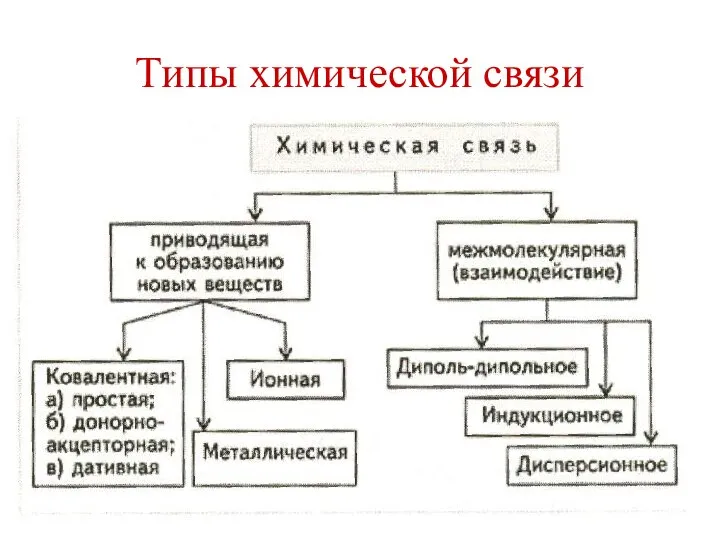 Типы химической связи
Типы химической связи  Общая фармакопейная статья
Общая фармакопейная статья Сероводород. Сульфиды
Сероводород. Сульфиды Строение и химические свойства кислот
Строение и химические свойства кислот Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя
Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя  Воздух- разделение на компоненты
Воздух- разделение на компоненты Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Лекарственное растительное сырье, содержащее витамины
Лекарственное растительное сырье, содержащее витамины ПРЕЗЕНТАЦИЯ КАБИНЕТА ХИМИИ
ПРЕЗЕНТАЦИЯ КАБИНЕТА ХИМИИ