Содержание
- 2. Содержание Строение алканов Изомерия и номенклатура алканов Физические свойства Нахождение в природе Получение Химические свойства Применение
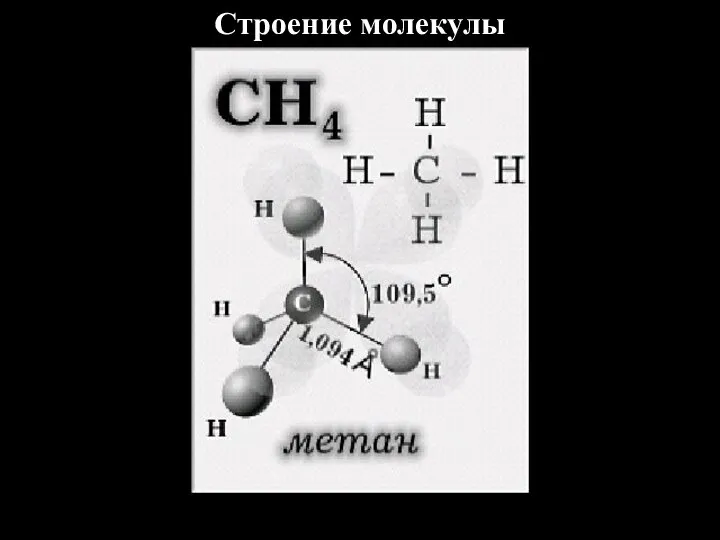
- 3. Строение алканов Алканы – углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных друг с
- 4. Строение молекулы
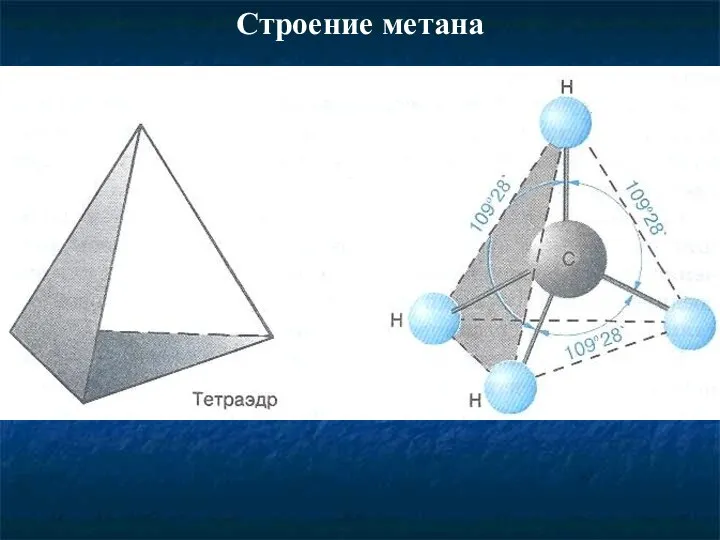
- 5. Строение метана
- 6. Изомерия и номенклатура алканов Изомерия структурная (по углеродному скелету) H3C – CH2 – CH2 – CH2
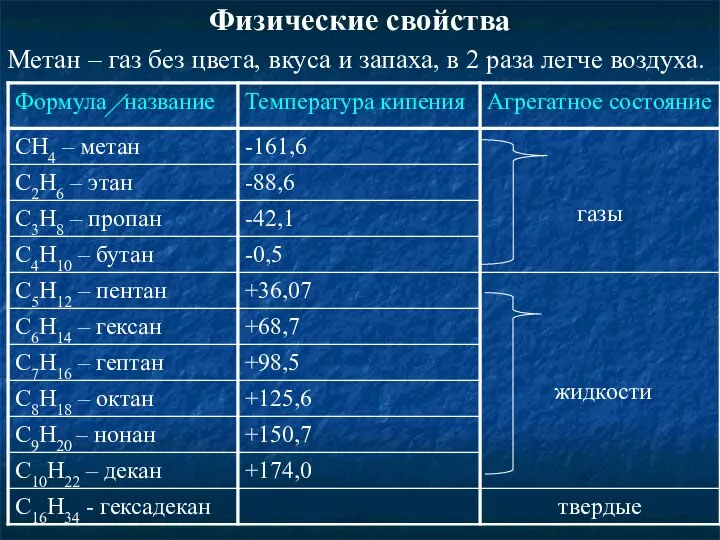
- 7. Физические свойства Метан – газ без цвета, вкуса и запаха, в 2 раза легче воздуха.
- 9. Получение Из природного сырья (нефть, газ) – перегонка Крекинг нефтепродуктов C16H34 C8H18 + C8H16 C8H18 C4H10
- 10. Химические свойства I. Радикальное замещение Галогенирование Нитрование II. Разрушение цепи Изомеризация 1.1.CH4 + Cl2 свет CH3Cl
- 11. III. Отщепление 1. Дегидрирование 2. Ароматизация IV. Окисление Крекинг Пиролиз Горение Химические свойства 3.1. CH3 –
- 12. Нахождение в природе Метан – образуется в природе в результате разложения остатков растений и животных без
- 14. Скачать презентацию








 The mechanism of DNA deactivation by hydrogen peroxide action
The mechanism of DNA deactivation by hydrogen peroxide action Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Железо как химический элемент
Железо как химический элемент Маркировки
Маркировки Общая характеристика углерода
Общая характеристика углерода Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Классификация дисперсных систем. (Лекция 5)
Классификация дисперсных систем. (Лекция 5) Адгезия полимеров
Адгезия полимеров Строение атома
Строение атома Хлориды. Химические свойства
Хлориды. Химические свойства Естественные и искусственные стекла
Естественные и искусственные стекла Хладагент R404a
Хладагент R404a Азотсодержащие вещества. Амины
Азотсодержащие вещества. Амины Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Горные породы
Горные породы Медь. Содержание в природе
Медь. Содержание в природе Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно
Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно Металлы и сплавы
Металлы и сплавы Методы исследования белковых молекул
Методы исследования белковых молекул Презентация по Химии "Нефть" - скачать смотреть бесплатно
Презентация по Химии "Нефть" - скачать смотреть бесплатно Нефть и способы её переработки
Нефть и способы её переработки Нітрати – токсичні речовини
Нітрати – токсичні речовини  Химия вопросы и ответы
Химия вопросы и ответы Степень окисления ОВР
Степень окисления ОВР Новые катализаторы
Новые катализаторы Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов
Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов Электрохимическая коррозии. Катодные процессы электрохимической коррозии
Электрохимическая коррозии. Катодные процессы электрохимической коррозии