Содержание
- 2. Содержание Определение. Общая формула. Гомологический ряд, радикалы. Изомерия и номенклатура. Строение (гибридизация). Физические свойства. Способы получения.
- 3. Определение. Общая формула. Алкины – ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь.
- 4. Гомологический ряд.
- 5. Радикалы.
- 6. Изомерия Структурная изомерия: 1) изомерия углеродного скелета (начиная с C5H8) CH≡C-CH2-CH2-CH3 CH≡C- CH(CH3)- CH3 пентин-1 3-метилбутин-1
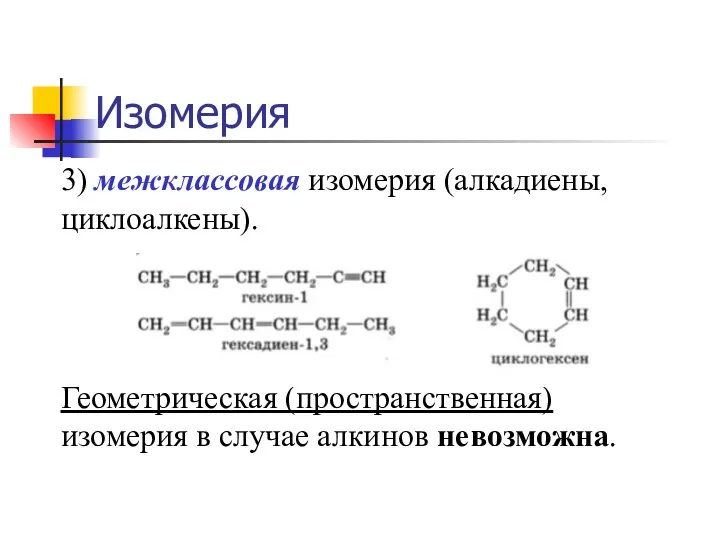
- 7. Изомерия 3) межклассовая изомерия (алкадиены, циклоалкены). Геометрическая (пространственная) изомерия в случае алкинов невозможна.
- 8. Номенклатура Согласно международной номенклатуре названия ацетиленовых углеводородов производят от соответствующего алкана с заменой суффикса –ан на
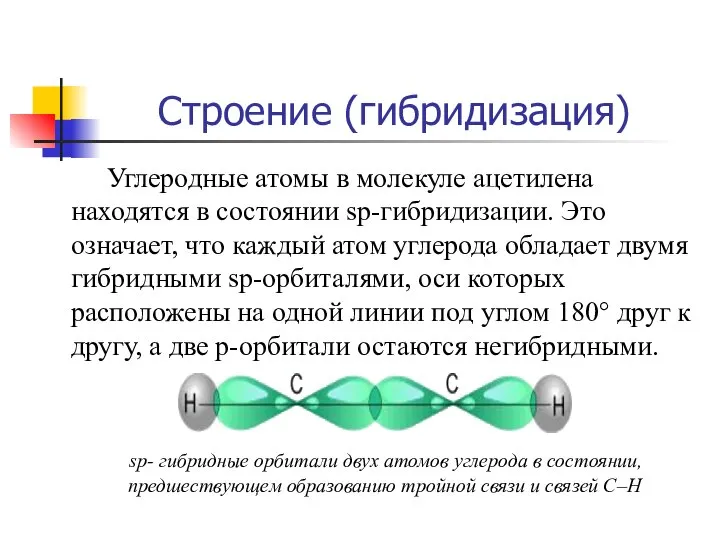
- 9. Строение (гибридизация) Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом
- 10. По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи
- 11. Две негибридные p-орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению σ-связей, взаимно перекрываются
- 12. Физические свойства По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются
- 13. Получение 1) В промышленности ацетилен получают высокотемпературным пиролизом метана. 1500ºС 2CH4 → HC≡CH + 3H2 2)
- 14. Получение 3) Ацетилен получают карбидным способом при разложении карбида кальция водой. t CaCО3 CaО + CО2
- 15. 4) дегидрогалогенирование дигалогенопроизводных алканов Атомы галогена при этом могут быть расположены как у соседних атомов углерода,
- 16. Химические свойства Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой
- 17. Химические свойства Реакции присоединения 1) Гидрирование осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd
- 18. Химические свойства 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов
- 19. 3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова. CH3–C≡CH + HBr → CH3–CBr=CH2 пропин 2-бромпропен CH3–CBr=CH2 +
- 20. 4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал
- 21. Химические свойства Правило В.В. Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то
- 22. Полимеризация. Алкины ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
- 23. Химические свойства б) Тримеризация (для ацетилена) Cакт.,t 3СH≡CH → С6Н6 (бензол)
- 24. Кислотные свойства. 1) Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на
- 25. Химические свойства Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида
- 26. Химические свойства Окисление 1) Горение 2СН≡ СН + 4O2 →CO2 + 2H2O + 3C↓ Так как
- 27. 2) Окисление Тройная связь при вторичном углероде, R–С≡. Звено окисляется до карбоксильной группы R–СOOH, образуется карбоновая
- 28. Химические свойства Тройная связь при первичном углероде, HC≡. Звено окисляется до окисляется до углекислого газа и
- 29. Химические свойства Особый случай: окисление ацетилена. Ацетилен окисляется без разрыва цепи до щавелевой кислоты:
- 30. Применение При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и
- 32. Скачать презентацию



























 Целлюлоза Выполнила студентка 11 группы Сыровацкая Лилия
Целлюлоза Выполнила студентка 11 группы Сыровацкая Лилия  Технология переработки нефти. Синтез метил-трет-бутилового и трет-амилметилового эфиров. (Лекция 4.4)
Технология переработки нефти. Синтез метил-трет-бутилового и трет-амилметилового эфиров. (Лекция 4.4) Химическая связь
Химическая связь Жиры. Классификация
Жиры. Классификация Белки, их строение и свойства. (Лекция 1.1)
Белки, их строение и свойства. (Лекция 1.1) Презентация Техника безопасности на уроке химии
Презентация Техника безопасности на уроке химии Галогены. Основные химические свойства. Качественные реакции
Галогены. Основные химические свойства. Качественные реакции Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман
Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман  Курс лекций по энзимиологии
Курс лекций по энзимиологии Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Барьерные, оптические и др. свойства полимерных материалов
Барьерные, оптические и др. свойства полимерных материалов Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Тема: Неметаллы
Тема: Неметаллы Альдегиды и кетоны
Альдегиды и кетоны Важнейшие химические понятия и законы
Важнейшие химические понятия и законы Алюминий и алюминиевые сплавы
Алюминий и алюминиевые сплавы Ионная химическая связь
Ионная химическая связь Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Основные сведения о строении атома
Основные сведения о строении атома Контрольная работа
Контрольная работа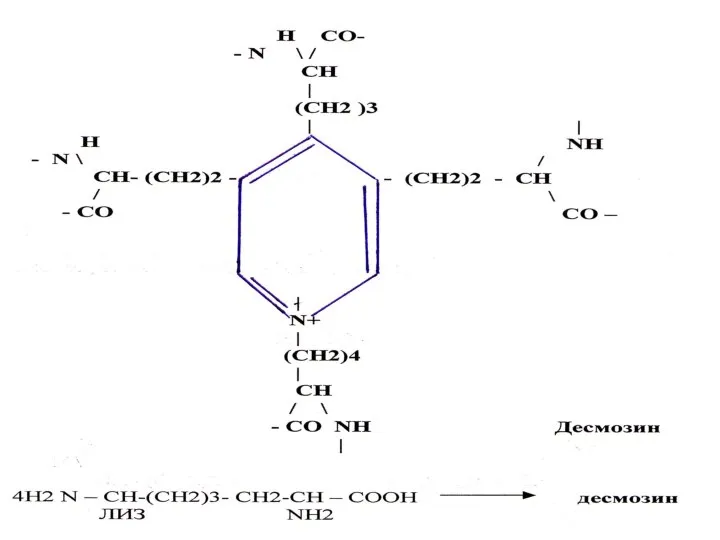 Гиалурон қышқылы
Гиалурон қышқылы 9 класс Урок №2. Предельные углеводороды Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №2. Предельные углеводороды Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Драгоценные камни
Драгоценные камни ПОЛИЭТИЛЕН
ПОЛИЭТИЛЕН  Общие классификации смазочных материалов
Общие классификации смазочных материалов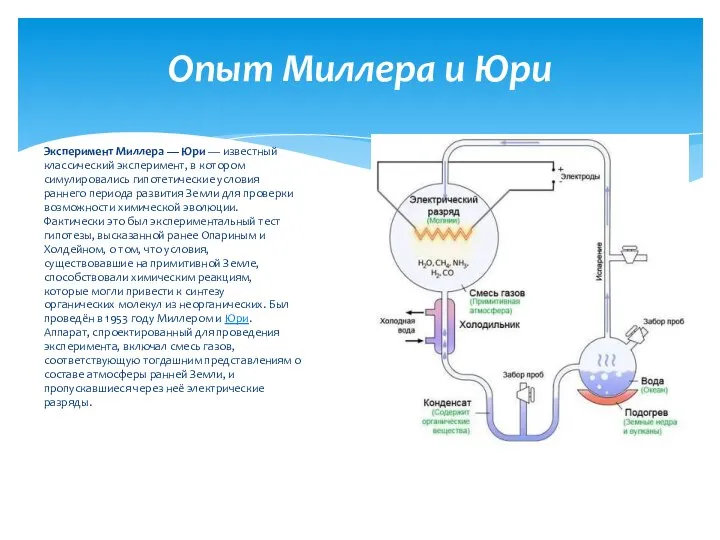 Опыт Миллера и Юри
Опыт Миллера и Юри Атомның кванты – механикалық моделі. Квант сандары
Атомның кванты – механикалық моделі. Квант сандары Нефть и способы её переработки
Нефть и способы её переработки