Содержание
- 2. Основные вопросы по 2-й лекции 1.Закон действующих масс. Скорость и константа скорости химической реакции. 2. Молекулярность
- 3. Лекция 3. Единицы измерения скорости и константы скорости химических реакций. Экспериментальный расчет константы скорости мономолекулярной и
- 4. Различные формы уравнения скорости первого порядка В дифференциальной форме уравнение для скорости первого порядка V =
- 5. Интегрирование этого выражения дает -ln [A]=kt+C, Принимая граничные условия для величин концентрации А (А0 и А)
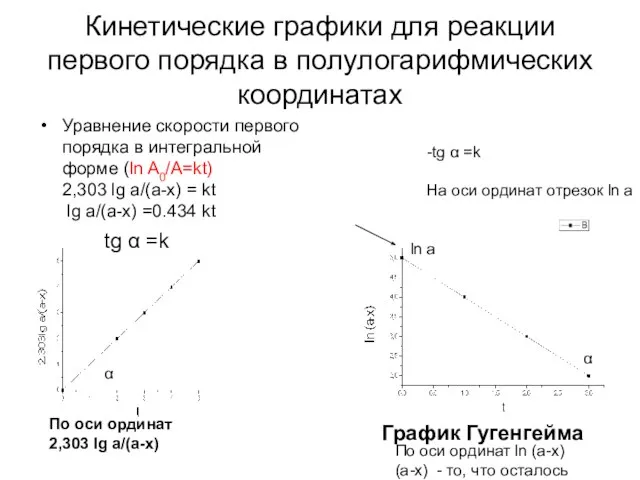
- 6. Уравнение скорости первого порядка в интегральной форме 2,303 lg A0/A = kt или lg A0/A =
- 7. Размерность константы мономолекулярной реакции первого порядка V=k[A] V размерность (моль/л с, моль/л мин) [A] размерность моль/л
- 8. Экспериментальное определение параметров реакции Часто кинетические измерения гораздо проще провести для образования продукта, чем для исчезновения
- 9. За реакцией можно следить, измеряя скорость выделения CO2 Если мы обозначим исходную концентрацию дикарбоновой кислоты через
- 10. Кинетические графики для реакции первого порядка в полулогарифмических координатах Уравнение скорости первого порядка в интегральной форме
- 11. k=2,303/t lg[A]0/[A]t размерность константы скорости первого порядка c-1, мин-1 Пример. Хлористый фенилдиазоний при 500 С в
- 12. Пример. Дипептид при 800 С в воде подвергается термическому распаду по уравнению первого порядка. За 32,4
- 13. k=2,303/t lg[A]0/[A]t При использовании этого уравнения концентрации не обязательно выражать в абсолютных единицах. Можно использовать, например,
- 14. Пример. Дипептид при 800 С в воде подвергается термическому распаду по уравнению первого порядка за 32,4
- 15. Время полупревращения реагента (субстрата) t1/2 Для реакций первого порядка 2,303 lg A0/A = kt Пусть t1/2
- 16. t1/2 =0.693/k Время полупревращения субстрата в случае реакции первого порядка зависит только от константы скорости реакции
- 17. Задача Рассчитать время полупревращения хлористого фенилдиазония при 500 С в воде по уравнению первого порядка с
- 18. Ответ t1/2 =9.76 мин
- 19. Реакции псевдопервого порядка Реакции псевдопервого порядка –это реакции второго порядка, для которых концентрация одного из реагентов
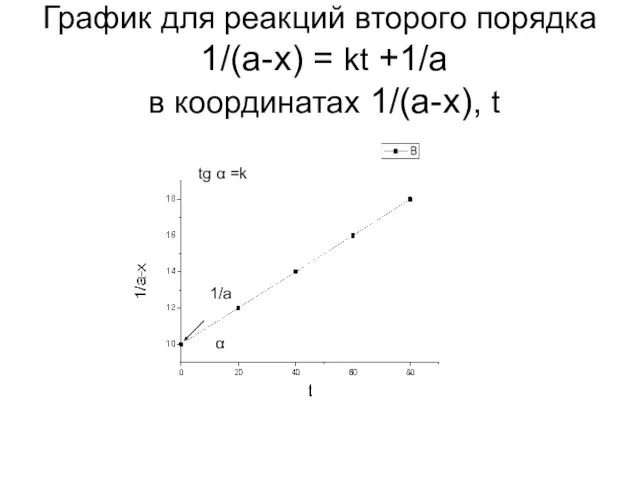
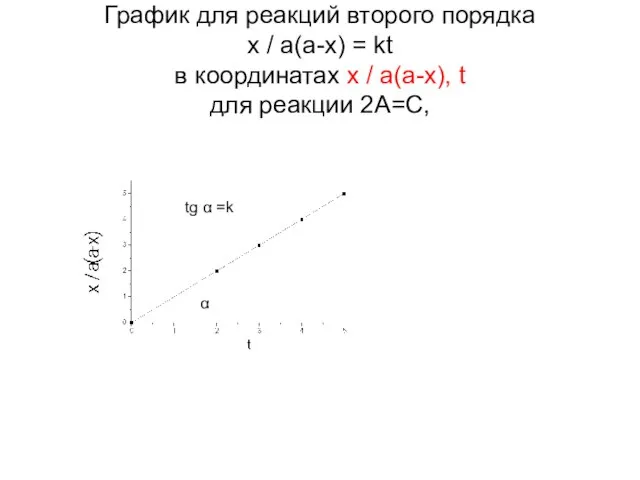
- 20. Уравнение скорости реакции второго порядка 2A=C, v=-d[A]/dt= k[A]2 -d[A]/[A]2 =kdt Интегрируем это уравнение 1/ [A]= kt+C
- 21. График для реакций второго порядка 1/(a-x) = kt +1/a в координатах 1/(a-x), t tg α =k
- 22. График для реакций второго порядка x / a(a-x) = kt в координатах x / a(a-x), t
- 23. Время полупревращения реагента (субстрата) t1/2 для реакций второго порядка При t1/2 , x=1/2 a, 1/(a-x) -1/a
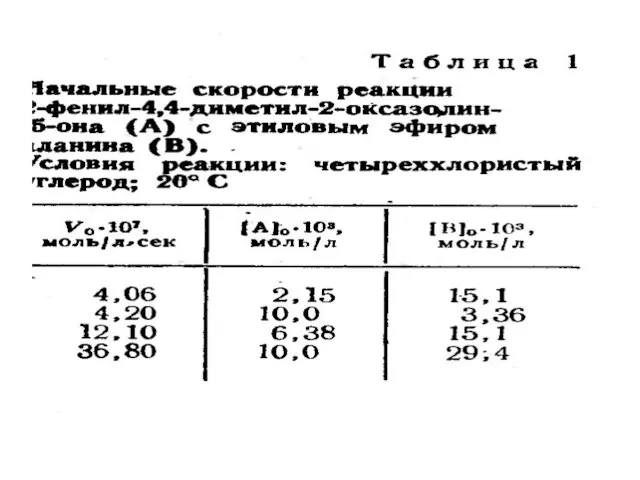
- 24. Реакция второго порядка, в которой участвуют две разные молекулы В случае бимолекулярной реакции A+B=C, v=-d[A]/dt =
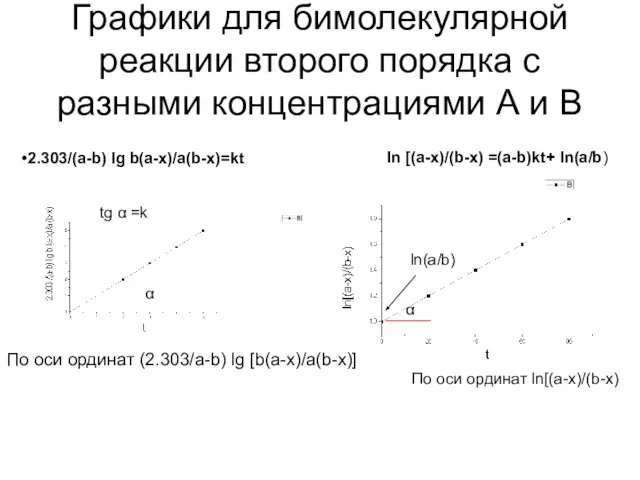
- 25. Если используют разные концентрации А и В Уравнение имеет вид V=dx/dt=k(a-x)(b-x) 2.303/(a-b) lg b(a-x)/a(b-x)=kt
- 26. Графики для бимолекулярной реакции второго порядка с разными концентрациями А и В По оси ординат (2.303/a-b)
- 27. Размерность константы скорости бимолекулярной реакции v= k[A][B] k М-1 мин-1 или М-1 с-1 v (моль/ л
- 28. Для реакций, когда [B]>>[A] можно считать, что концентрация вещества В в ходе реакции остается постоянной и
- 29. Констатна скорости псевдомономолекулярной реакции определяется как и константа скорости истинной мономолекулярной реакции первого порядка, но она
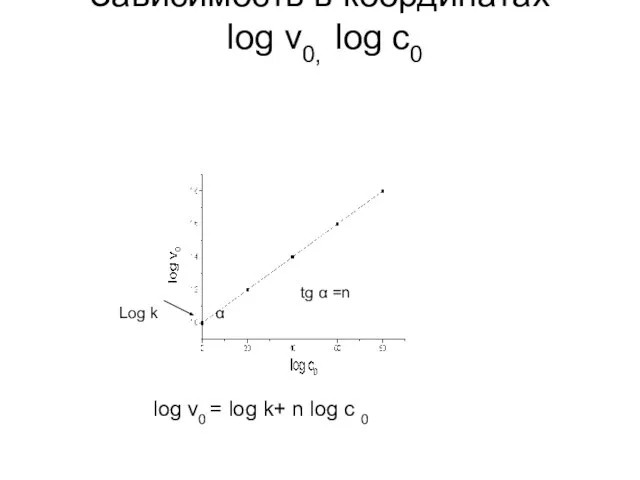
- 30. Реакции n порядка nA=P v=k[A]n V0 = -dA/dt=kc0n с0- концентрация вещества А в начальный момент (начальная
- 32. Зависимость в координатах log v0, log c0 tg α =n α Log k log v0 =
- 34. Решение
- 35. Характеристики реакций простых порядков: резюме График зависимости концентрации от времени дает ключ к порядку реакции. Если
- 37. Скачать презентацию



![Интегрирование этого выражения дает -ln [A]=kt+C, Принимая граничные условия для величин](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-4.jpg)

![Размерность константы мономолекулярной реакции первого порядка V=k[A] V размерность (моль/л с,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-6.jpg)


![k=2,303/t lg[A]0/[A]t размерность константы скорости первого порядка c-1, мин-1 Пример. Хлористый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-10.jpg)

![k=2,303/t lg[A]0/[A]t При использовании этого уравнения концентрации не обязательно выражать в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-12.jpg)





![Уравнение скорости реакции второго порядка 2A=C, v=-d[A]/dt= k[A]2 -d[A]/[A]2 =kdt Интегрируем](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-19.jpg)



![Размерность константы скорости бимолекулярной реакции v= k[A][B] k М-1 мин-1 или](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-26.jpg)
![Для реакций, когда [B]>>[A] можно считать, что концентрация вещества В в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-27.jpg)

![Реакции n порядка nA=P v=k[A]n V0 = -dA/dt=kc0n с0- концентрация вещества](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/578770/slide-29.jpg)



 Фенолы. Простые эфиры
Фенолы. Простые эфиры Митохондрии и пластиды
Митохондрии и пластиды ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2
ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2 Химическое равновесие
Химическое равновесие Промислові способи отримання металів
Промислові способи отримання металів  Уравнения химических реакций
Уравнения химических реакций Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Структура ячейки на примере атома железа
Структура ячейки на примере атома железа Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) ИСКУССТВЕННЫЕ ПОЛИМЕРЫ
ИСКУССТВЕННЫЕ ПОЛИМЕРЫ Классификация веществ по характеру связи
Классификация веществ по характеру связи Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства
Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства Гетерофункционалды органикалық қосылыстар
Гетерофункционалды органикалық қосылыстар Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Кислоты. Определение кислот
Кислоты. Определение кислот Кристаллическое строение материалов. Лекция 2
Кристаллическое строение материалов. Лекция 2 Тесты для самопроверки
Тесты для самопроверки Производство бензина
Производство бензина Использование проектного метода при изучении химии
Использование проектного метода при изучении химии Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Пластмассы
Пластмассы Каустобиолиты, горючие полезные ископаемые органического происхождения
Каустобиолиты, горючие полезные ископаемые органического происхождения Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Алканы CnH2n+2 - Презентация по Химии
Алканы CnH2n+2 - Презентация по Химии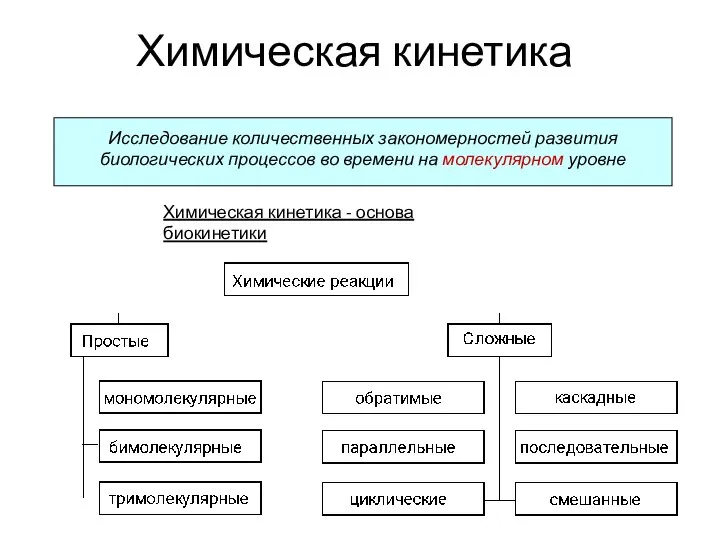 Химическая кинетика
Химическая кинетика Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение