Содержание
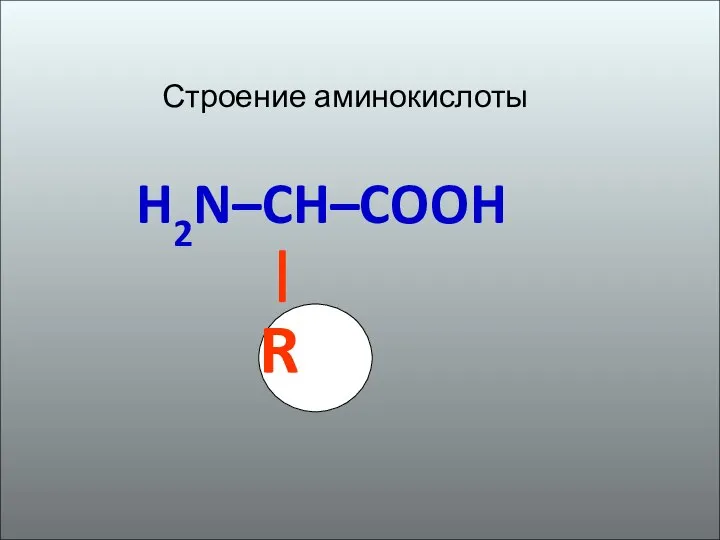
- 2. Строение аминокислоты H2N–CH–COOH | R
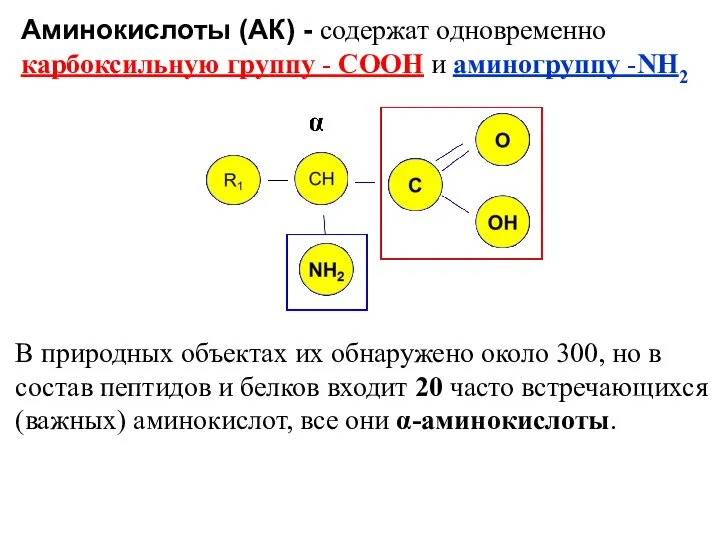
- 3. В природных объектах их обнаружено около 300, но в состав пептидов и белков входит 20 часто
- 4. Классификация аминокислот 1. Моноаминомонокарбоновые 2. Моноаминодикарбоновые 3. Диаминомонокарбоновые 4. Серусодержащие 5. Имеющие спиртовую группу 6. Циклические
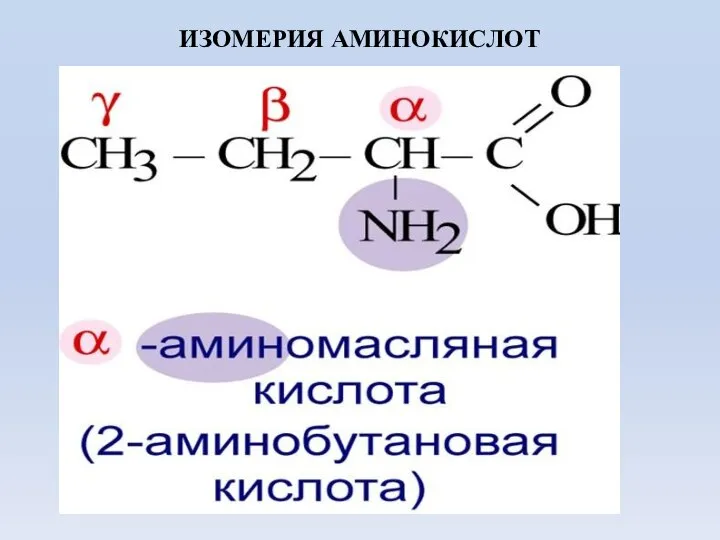
- 6. ИЗОМЕРИЯ АМИНОКИСЛОТ
- 7. Оптическая изомерия аминокислоты существуют в виде зеркальных изомеров
- 8. Стереоизомерия. Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2
- 11. По кислотно-основным свойствам аминокислоты делят на три группы: Кислые - с карбоксильными группами в боковом радикале:
- 13. Изоэлектрическая точка (ИЭТ) – это значение pH раствора, при котором молекулы существуют в виде диполярных ионов.
- 14. Биологически важные реакции α-аминокислот 1.Образование оснований Шиффа 2. Декарбоксилирование 3. Дезаминирование 4. Трансаминирование 5. Образование полипептидов
- 15. Образование оснований Шиффа Образование оснований Шиффа. При взаимодействии аминокислот с альдегидами образуются Образование оснований Шиффа. При
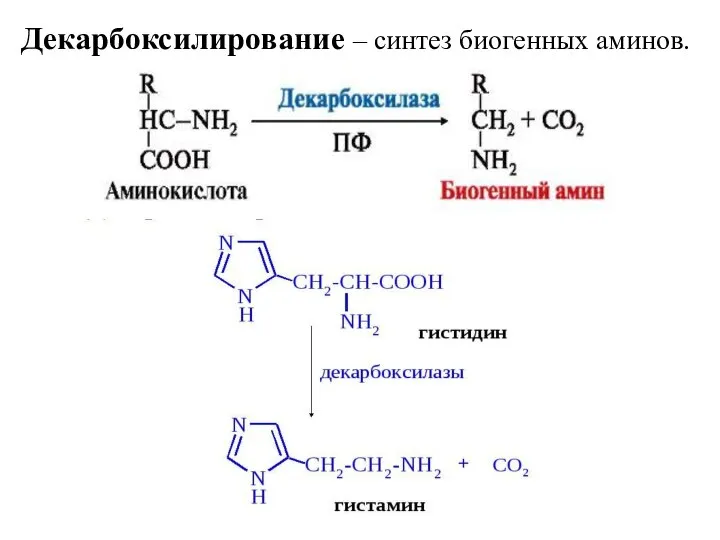
- 16. Декарбоксилирование – синтез биогенных аминов.
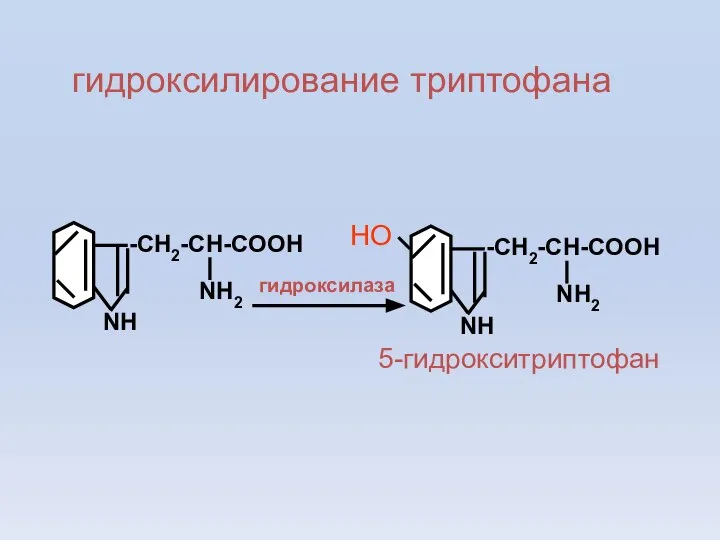
- 17. -CH2-CH-COOH NH2 NH гидроксилирование триптофана -CH2-CH-COOH NH2 NH НО гидроксилаза 5-гидрокситриптофан
- 18. Дезаминирование – удаления α-АК, которая выделяется в виде NH3 и образования α-кетокислоты. Общее количество АК уменьшается.
- 21. Трансаминирование (переаминирование) - реакция переноса –NH2 с АК на α-кетокислоту, образуются новая кетокислота и новая АК.
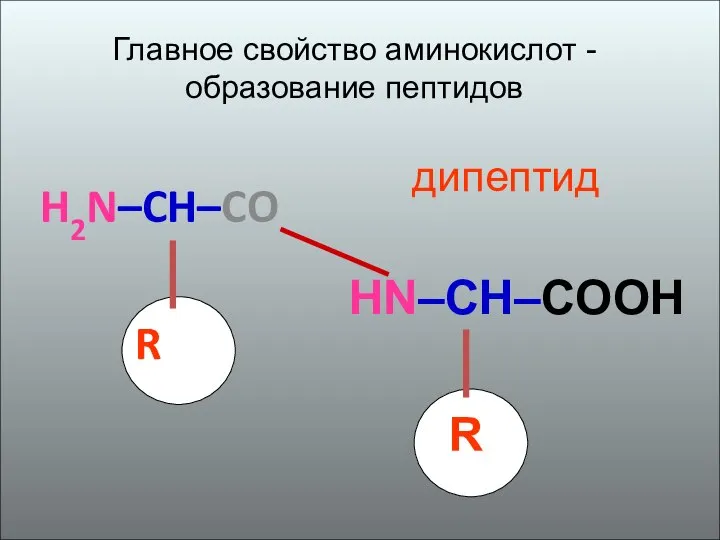
- 23. H2N–CH–CO R HN–CH–COOH R дипептид Главное свойство аминокислот - образование пептидов
- 24. Образование пептидной связи
- 25. Строение белковой молекулы
- 28. Первичная структура белка - линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. аминокислоты
- 40. Скачать презентацию































 Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине
Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине Определение валентности элементов
Определение валентности элементов V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Альдегидтер және кетондар
Альдегидтер және кетондар Кристаллические решетки
Кристаллические решетки Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Теоретические основы органической химии
Теоретические основы органической химии Железо и его соединения.
Железо и его соединения. Beryllium. The physical properties of beryllium
Beryllium. The physical properties of beryllium Физический процесс и химическая реакция.
Физический процесс и химическая реакция. Общая и неорганическая химия
Общая и неорганическая химия Химические свойства алканов
Химические свойства алканов Расчёт равновесного состава
Расчёт равновесного состава Викторина. Дмитрий Иванович Менделеев
Викторина. Дмитрий Иванович Менделеев Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары
Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары Уран. Получение урана
Уран. Получение урана Значение основных химических элементов в жизни человека
Значение основных химических элементов в жизни человека Сведения о воде
Сведения о воде Речь без пословицы - всё равно что еда без соли Речь без пословицы - всё равно что еда без соли · Пуд соли съешь, прежде чем познаешь человека · &nbs
Речь без пословицы - всё равно что еда без соли Речь без пословицы - всё равно что еда без соли · Пуд соли съешь, прежде чем познаешь человека · &nbs Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Имеет ли вода форму
Имеет ли вода форму Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Олово и свинец. (Лекция 2)
Олово и свинец. (Лекция 2) Кислород. Получение кислорода и его физические свойства
Кислород. Получение кислорода и его физические свойства