Содержание
- 2. СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ 20 аминокислот входят в состав белков (протеиногенные аминокислоты). Это α-аминокислоты, в
- 3. По структуре боковой группы R аминокислоты подразделяются на: моноаминомонокарбоновые алифатические (глицин, аланин, валин, лейцин, изолейцин); моноаминодикарбоновые
- 5. *Тирозин, или гидроксифенилаланин – ароматическая, гидрофильная, полярная аминокислота.
- 6. Протеиногенные аминокислоты делятся на: незаменимые – не могут синтезироваться в организме человека (треонин, метионин, валин, лейцин,
- 7. α-Аминоксилоты (кроме глицина) имеют в структуре хиральные (асимметричные) атомы С. Это обусловливает существование двух энантиомеров –
- 8. Химические свойства аминокислот декарбоксилирования (образование аминов) и дезаминирования (образование карбоновых кислот); переаминирования с α-кетокислотами; α-аминокислота +
- 9. образования амидов и сложных эфиров; взаимодействие аминогрупп с альдегидами (образование шиффовых оснований); образование N-гликозидов (при взаимодействии
- 10. Универсальной качественной реакцией на α-аминокислоты, является их взаимодействие с нингидрином, сопровождающееся образованием окрашенного продукта фиолетового цвета
- 12. Амфотерные свойства аминокислот α-Аминокислоты в водных растворах существуют преимуществненно в виде биполярных, или цвиттер-ионов:
- 13. Степень диссоциации ионогенных групп зависит от рН. Значение рН раствора, при котором суммарный заряд молекулы аминокислоты
- 14. Значение рН водного раствора химически чистой аминокислоты называется изоионной точкой. Значения изоэлектрической и изоионной точек в
- 15. Заряд аминокислоты в растворе зависит от его рН Аминокислоты в растворах при любых значениях рН (кроме
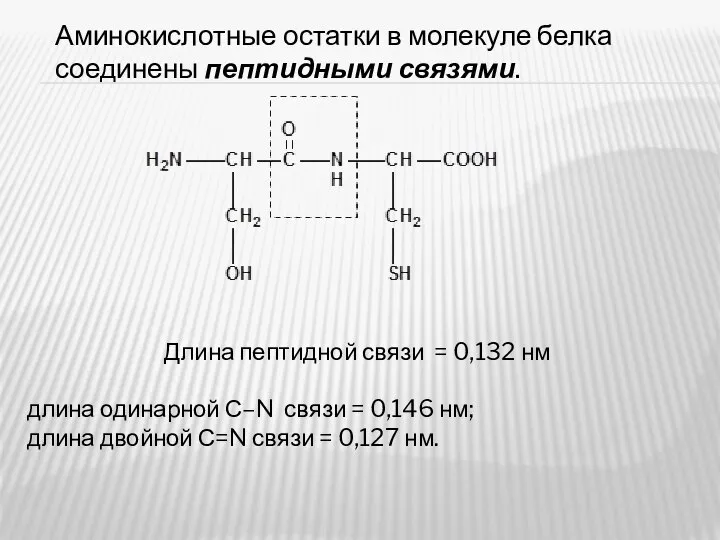
- 16. Аминокислотные остатки в молекуле белка соединены пептидными связями. Длина пептидной связи = 0,132 нм длина одинарной
- 17. Свойства пептидной связи: пептидная группа жесткая планарная (плоская) структура и вращение вокруг пептидной связи невозможно; пептидная
- 18. По числу аминокислотных остатков: олигопептиды (до 10 аминокислотных остатков); полипептиды (от 10 до 50 аминокислотных остатков).
- 19. Полипептиды, состоящие более, чем из 50 аминокислотных остатков, относятся к белкам, или протеинам. В структуре белковой
- 22. В зависимости от степени асимметрии молекулы белка, имеющие пространственную структуру (конформацию), подразделяются на: - глобулярные (при
- 23. Формирование третичной структуры приводит к образованию функционально активной, или нативной, белковой структуры.
- 24. Физико-химические свойства белков Большинство белков – это водорастворимые вещества. В растворах белки проявляют коллоидные свойства и
- 25. Белки способны взаимодействовать и с катионами, и с анионами. Способность белков взаимодействовать с различными заряженными веществами
- 26. Денатурация – изменение пространственной структуры, которая происходит в связи с разрывом связей, поддерживающих и образующих пространственную
- 27. КЛАССИФИКАЦИЯ БЕЛКОВ В зависимости от состава белки делятся на простые и сложные. Простые белки состоят только
- 28. Сложные белки кроме белковой части имеют структуры небелковой природы. Хромопротеины –окрашенные белки: гемопротеины, флавопротеины, родопсин и
- 29. Функции белков Каталитическая функция. Структурная функция. Транспортная функция Защитная функция. Регуляторная функция. Двигательная функция.
- 30. ФЕРМЕНТЫ Ферменты - природные биокатализаторы белковой природы.
- 31. СВОЙСТВА ФЕРМЕНТОВ Общие со всеми катализаторами: 1. способность катализировать только термодинамически возможные процессы. 2. ускорение наступления
- 32. Специфические свойства: 1. более высокая активность ферментов по сравнению с неорганическими катализаторами. 2. высокую специфичность действия
- 33. СТРУКТУРА ФЕРМЕНТОВ Простые ферменты – однокомпонентные, состоят только из полипептидной части; Сложные ферменты (холофермент) – двухкомпонентные,
- 34. Классификация ферментов
- 35. Единицы и формы выражения активности ферментов 1 катал (каt) – количество фермента, которое катализирует превращение 1
- 38. Скачать презентацию


































 Карбон қышқылдары
Карбон қышқылдары Electrochemistry. (Chapter 6)
Electrochemistry. (Chapter 6) Синтетические моющие средства
Синтетические моющие средства Сопутствующие явления. Диффузия
Сопутствующие явления. Диффузия Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Хімія в медицині
Хімія в медицині  Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Тема 3
Тема 3 Будем знакомы -
Будем знакомы - Задача на химическое равновесие
Задача на химическое равновесие Термический анализ
Термический анализ Презентация Классификация органических веществ.
Презентация Классификация органических веществ. Косметика – результат налицо? Тимиргалиева Т.К. ст. преподаватель каф. ИТОиМ тьютор-методист программы Intel® «Обучение для будущего»
Косметика – результат налицо? Тимиргалиева Т.К. ст. преподаватель каф. ИТОиМ тьютор-методист программы Intel® «Обучение для будущего» Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Транспорт веществ через биологические мембраны. (Лекция 12)
Транспорт веществ через биологические мембраны. (Лекция 12) Химия. Тест
Химия. Тест Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Барьерные, оптические и др. свойства полимерных материалов
Барьерные, оптические и др. свойства полимерных материалов Морфология почв
Морфология почв Азот, строение, свойства. Круговорот азота в природе
Азот, строение, свойства. Круговорот азота в природе Возникновение органической химии, как науки
Возникновение органической химии, как науки Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Элементы побочной подгруппы IV
Элементы побочной подгруппы IV Урок по химии в 11 классе. Провела Миронова О.А. МОУ Памятская СОШ.
Урок по химии в 11 классе. Провела Миронова О.А. МОУ Памятская СОШ. Crystal defects and imperfections
Crystal defects and imperfections Алкены. Пропилен
Алкены. Пропилен Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов