Содержание
- 2. Ароматические соединения (от греч. árômа — благовоние), класс органических циклических соединений, все атомы которых участвуют в
- 3. Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные
- 4. История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году
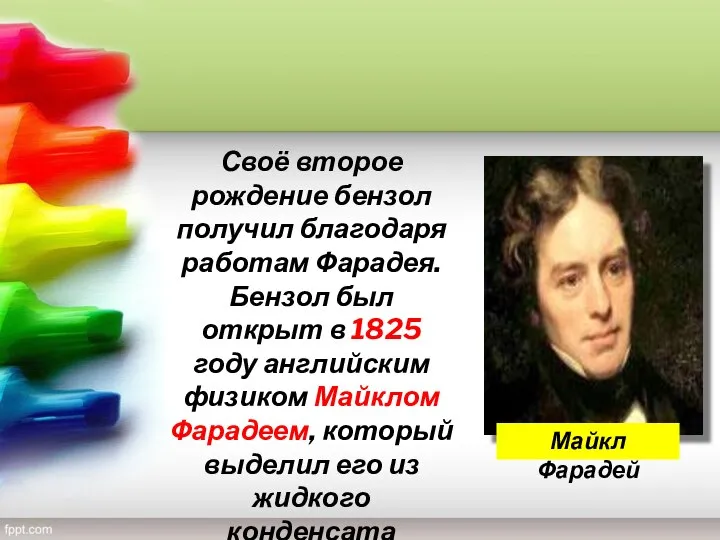
- 5. Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком
- 6. В 1833 году немецкий физик и химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли
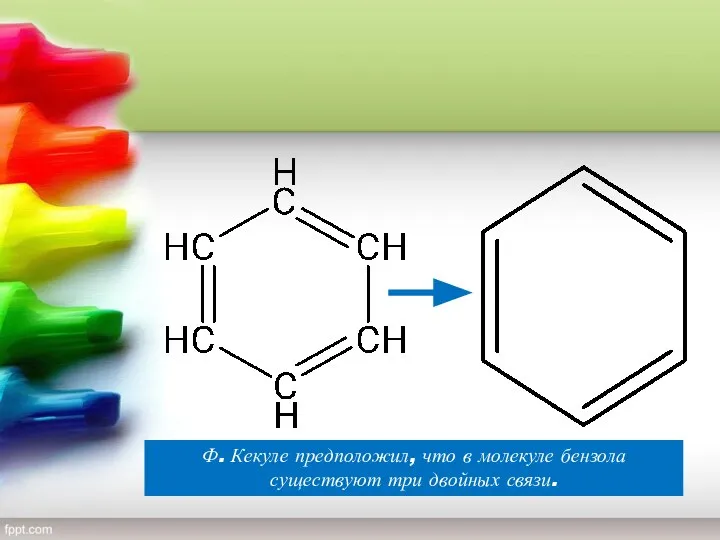
- 7. Структурная формула бензола Была предложена немецким ученым А. Кекуле в 1865 году Бензол не взаимодействует с
- 8. Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
- 9. Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из
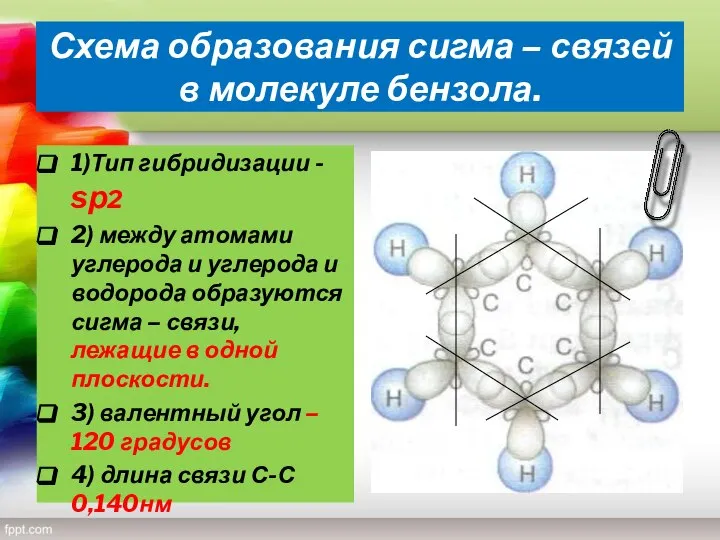
- 10. Схема образования сигма – связей в молекуле бензола. 1)Тип гибридизации - sр2 2) между атомами углерода
- 11. Химические свойства: Реакции замещения. 1) Галогенирование При взаимодействии бензола с галогеном (в данном случае с хлором)
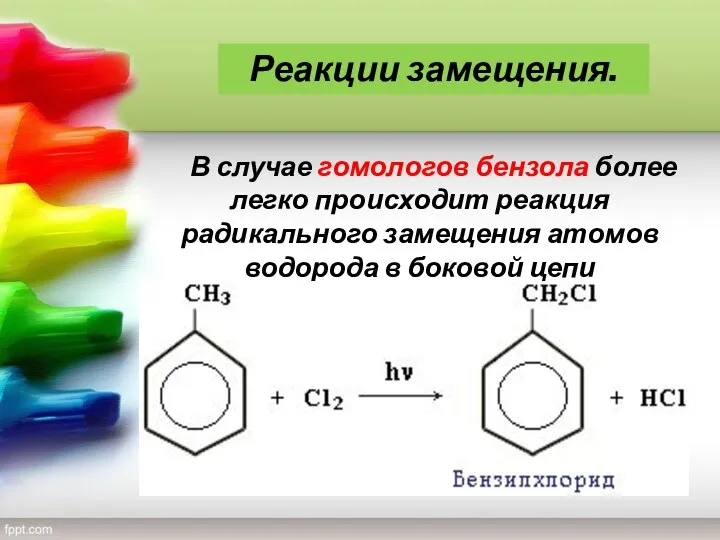
- 12. В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи Реакции
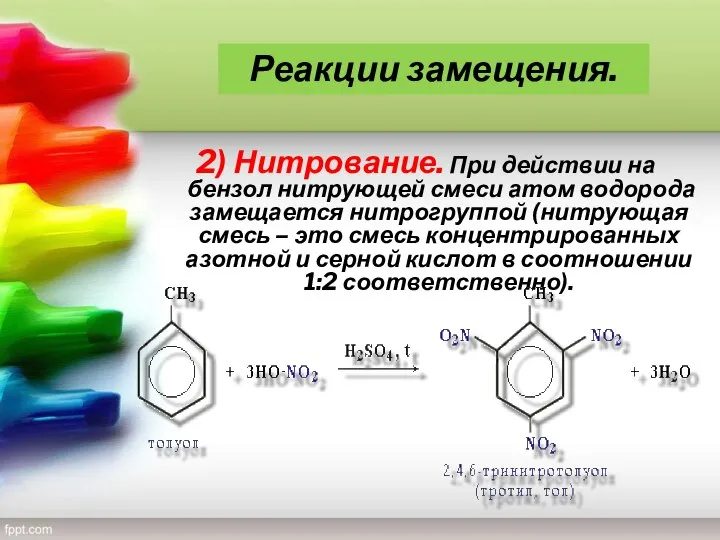
- 13. 2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это
- 14. 3) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный атом замещается сульфогруппой. C6H6
- 15. Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом. Например, при
- 16. Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
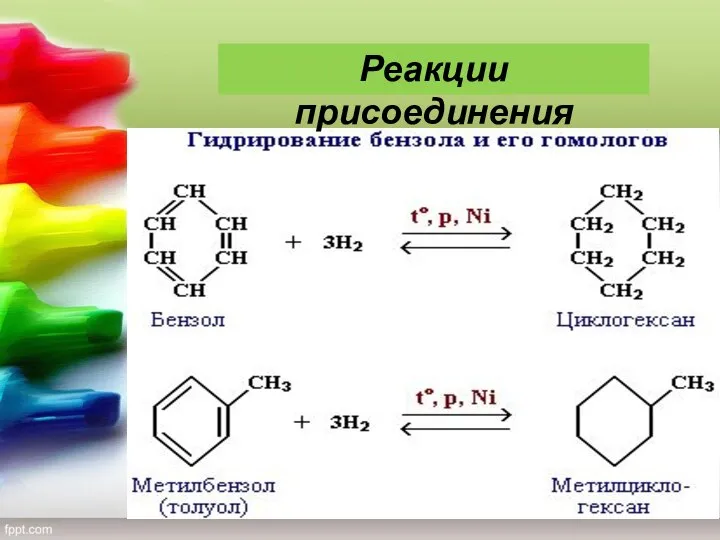
- 17. 5) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с
- 18. Реакции присоединения
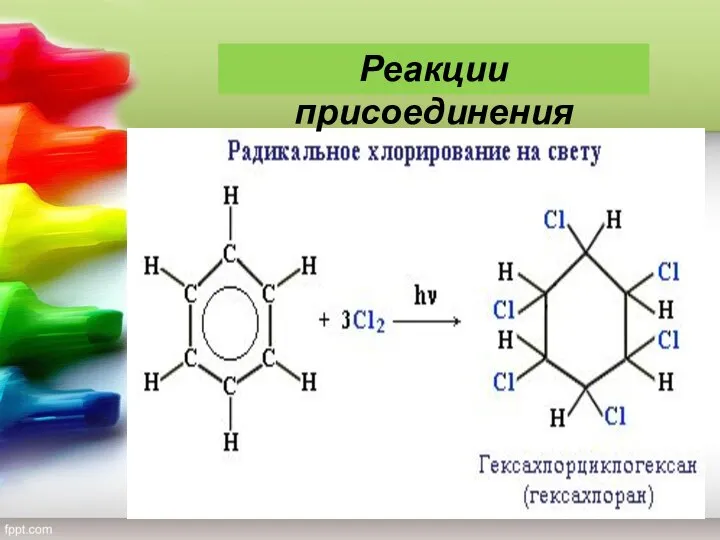
- 19. Реакции присоединения
- 20. Запомните Если в молекуле бензола один из атомов водорода замещен на углеводородный радикал, то в дальнейшем
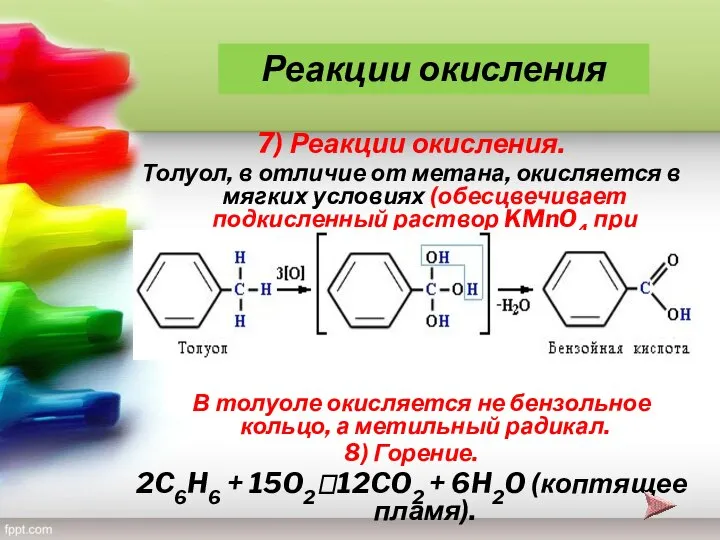
- 21. 7) Реакции окисления. Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4
- 22. 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется
- 23. 2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина
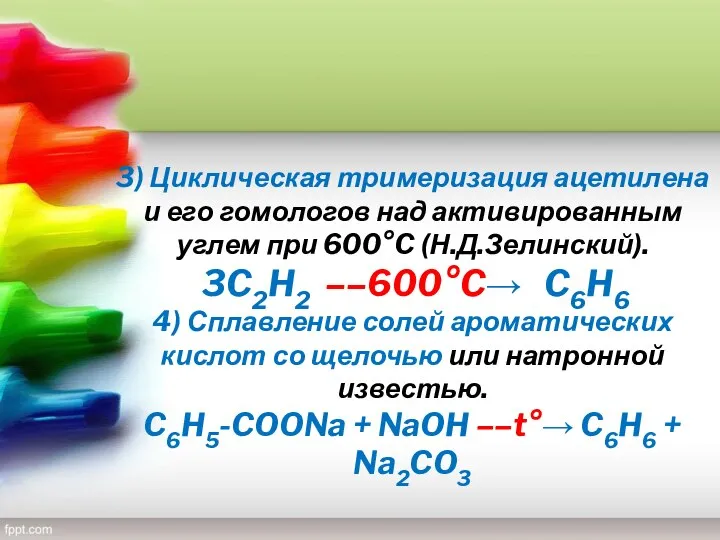
- 24. 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский). 3C2H2 ––600°C→ C6H6
- 25. Применение Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина,
- 26. Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С6Н4(СН3)2 в виде
- 40. Скачать презентацию



























 Презентация по Химии "Щелочные металлы" - скачать смотреть
Презентация по Химии "Щелочные металлы" - скачать смотреть  Основания. Физические свойства оснований
Основания. Физические свойства оснований Биоорганическая химия
Биоорганическая химия Минеральные удобрения: польза и вред
Минеральные удобрения: польза и вред Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Ксенобиотики в окружающей среде и живых организмах. (Лекция 2)
Ксенобиотики в окружающей среде и живых организмах. (Лекция 2) Презентация по Химии "Белый фосфор" - скачать смотреть
Презентация по Химии "Белый фосфор" - скачать смотреть  Химический элемент алюминий
Химический элемент алюминий Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Минералы
Минералы Химический элемент радон
Химический элемент радон Biological effects of nitric oxide and its role in cell signaling
Biological effects of nitric oxide and its role in cell signaling Электросинтез. (Тема 7)
Электросинтез. (Тема 7) Соли как электролиты, их классификация по различным признакам. Химические свойства, получения солей
Соли как электролиты, их классификация по различным признакам. Химические свойства, получения солей Химические формулы веществ (8 класс)
Химические формулы веществ (8 класс) ОВР в гетерогенных системах
ОВР в гетерогенных системах Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Соли, их классификация и свойства
Соли, их классификация и свойства Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3)
Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3) Химическая реакция
Химическая реакция История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Марганец
Марганец Протолитическая теория кислот и оснований
Протолитическая теория кислот и оснований каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Фосфорные удобрения
Фосфорные удобрения