Содержание
- 2. ЭХМА Особенность ЭХМА: используются процессы, связанные с переносом электрических зарядов.
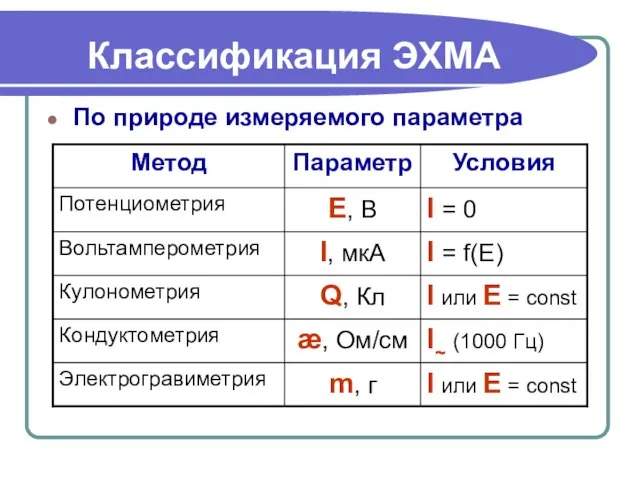
- 3. Классификация ЭХМА По природе измеряемого параметра
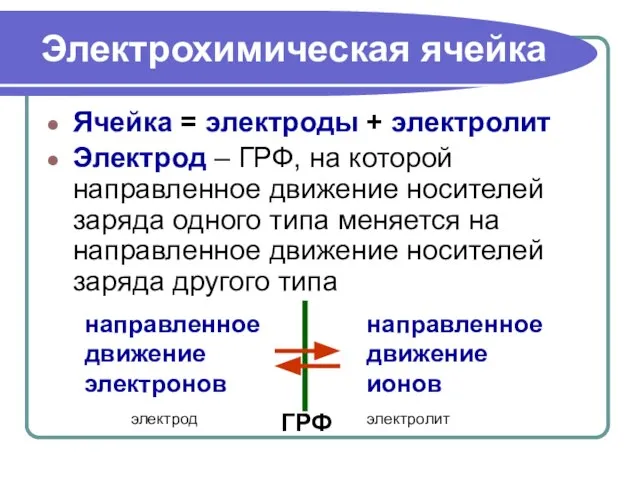
- 4. Электрохимическая ячейка Ячейка = электроды + электролит Электрод – ГРФ, на которой направленное движение носителей заряда
- 5. Электролит – раствор, обеспечивающий направленное движение ионов. 2х-электродная ячейка: ЭС и ИЭ 3х-электродная ячейка: ЭС, ИЭ
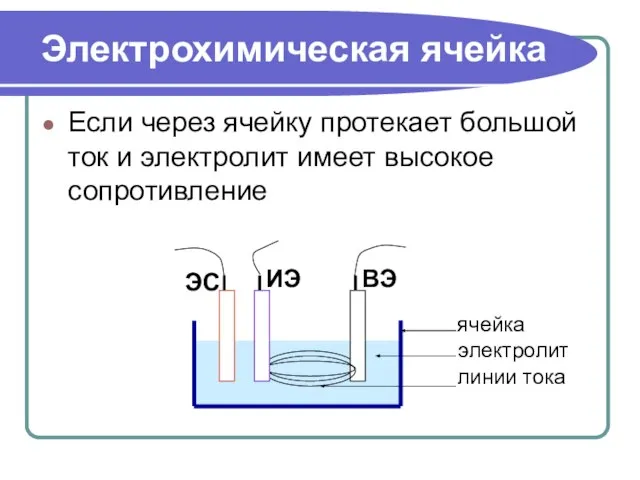
- 6. Если через ячейку протекает большой ток и электролит имеет высокое сопротивление Электрохимическая ячейка
- 7. Инертный электрод – материал электрода не принимает участия в химических и электрохимических реакциях, протекающих на его
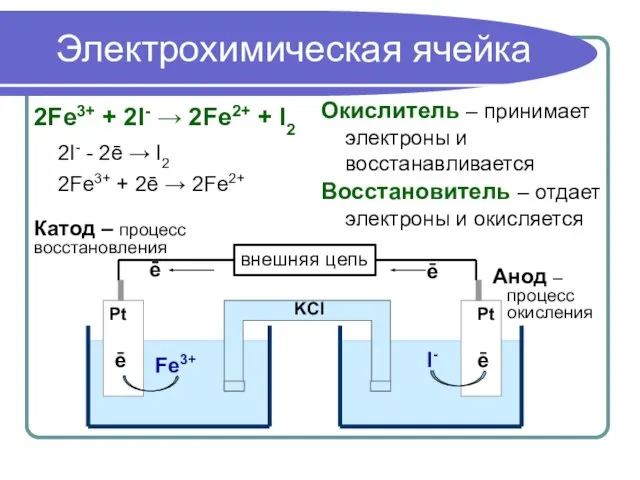
- 8. Электрохимическая ячейка 2Fe3+ + 2I- → 2Fe2+ + I2 2I- - 2ē → I2 2Fe3+ +
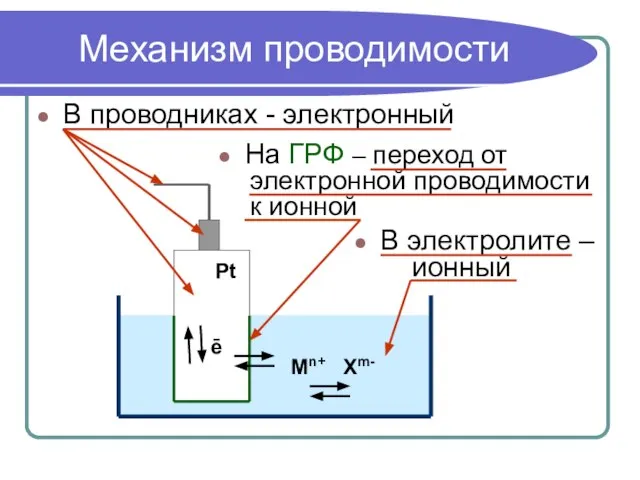
- 9. Механизм проводимости В проводниках - электронный На ГРФ – переход от электронной проводимости к ионной В
- 10. На катоде – катодный ток (ток восстановления) На аноде – анодный ток (ток окисления) Токи, обусловленные
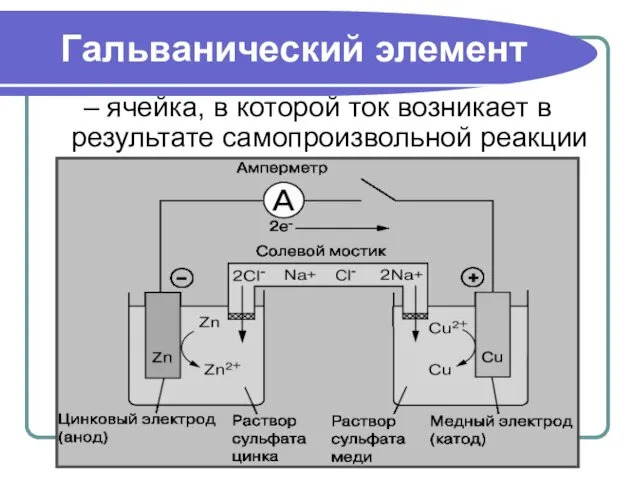
- 11. Гальванический элемент – ячейка, в которой ток возникает в результате самопроизвольной реакции
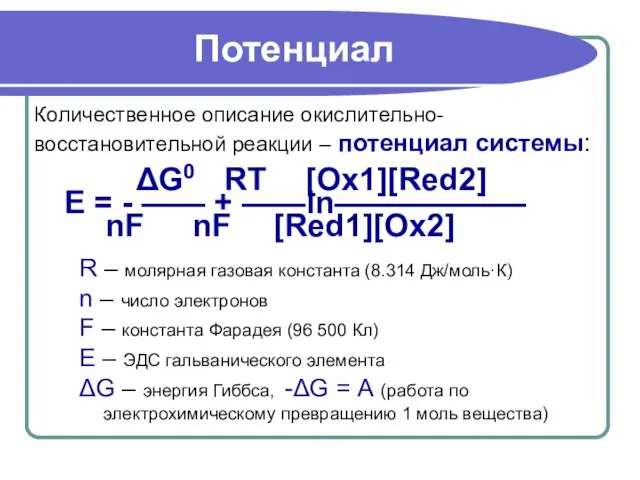
- 12. Потенциал Количественное описание окислительно- восстановительной реакции – потенциал системы: ΔG0 RT [Ox1][Red2] E = - ——
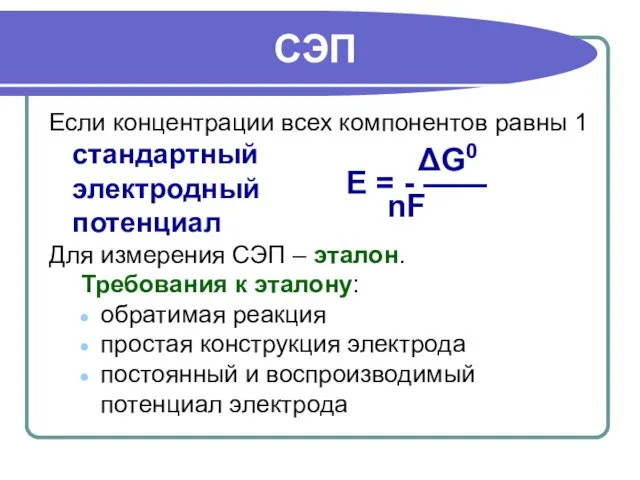
- 13. СЭП Если концентрации всех компонентов равны 1 стандартный электродный потенциал Для измерения СЭП – эталон. Требования
- 14. СВЭ [H+] = 1 M p(H2) = 1 атм EСВЭ = 0 В 2Н+ + 2ē
- 15. Уравнение Нернста RT [Ox] Eox/red = E0ox/red + — ln——— nF [Red] Равновесный электродный потенциал, где
- 16. Red1 + Ox2 Ox1 + Red2 υ1 = υ2 , ток во внешней цепи не идет
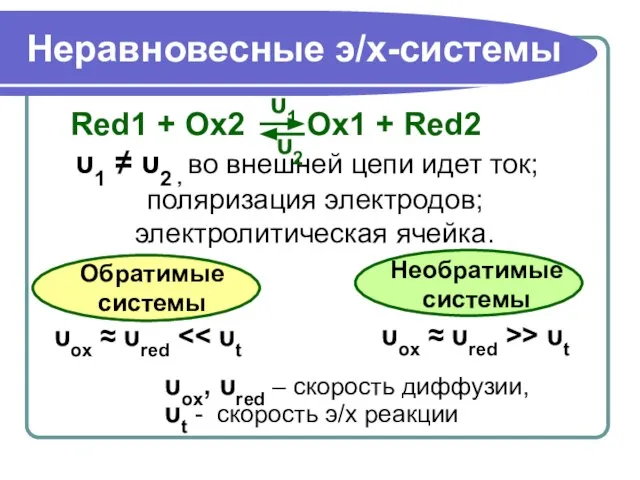
- 17. Неравновесные э/х-системы Red1 + Ox2 Ox1 + Red2 υ1 ≠ υ2 , во внешней цепи идет
- 18. ПОТЕНЦИОМЕТРИЯ Потенциометрический анализ – метод определения концентрации ионов, основанный на измерении равновесного э/х потенциала ИЭ, погруженного
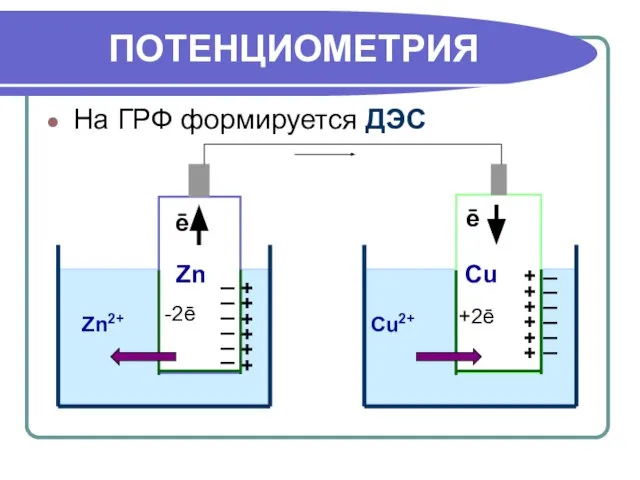
- 19. ПОТЕНЦИОМЕТРИЯ На ГРФ формируется ДЭС
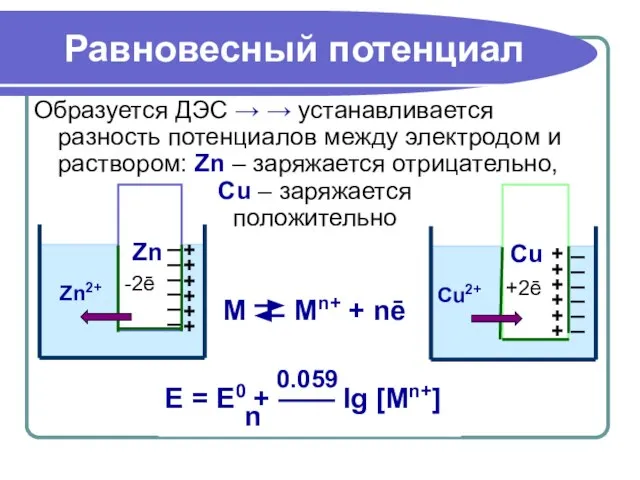
- 20. Равновесный потенциал Образуется ДЭС → → устанавливается разность потенциалов между электродом и раствором: Zn – заряжается
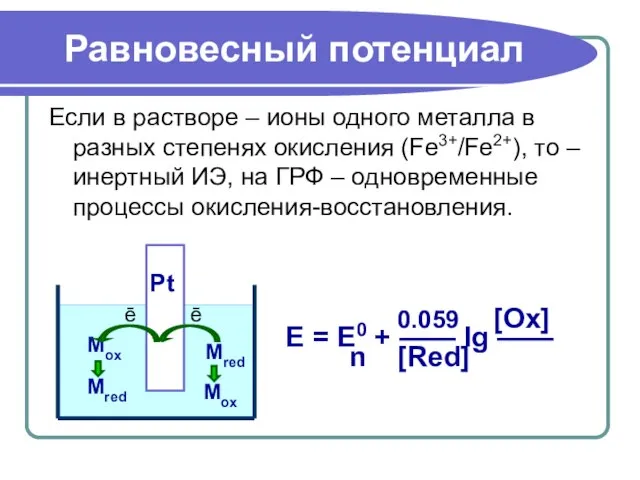
- 21. Равновесный потенциал Если в растворе – ионы одного металла в разных степенях окисления (Fe3+/Fe2+), то –
- 22. Потенциометрия Прямая потенциометрия Ионометрия: анионометрия катионометрия, в т.ч. рН-метрия Ферментные датчики Потенциометрическое титрование Достоинства: Простота Дешевизна
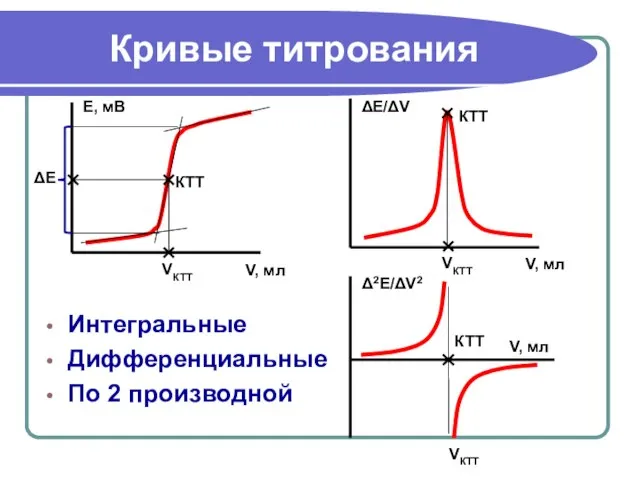
- 23. Потенциометрическое титрование Зависимость равновесного потенциала электрода от состава раствора (концентрации ионов) Достоинства по сравнению с обычным
- 24. Требование к индикаторному электроду: равновесный потенциал должен устанавливаться быстро. Вид Индикаторные титрования: электроды: кислотно-основное – рН-электроды
- 25. Кривые титрования Интегральные Дифференциальные По 2 производной
- 26. Электроды сравнения Обладают постоянным потенциалом, не зависящим от состава раствора Требования: - низкое электрическое сопротивление -
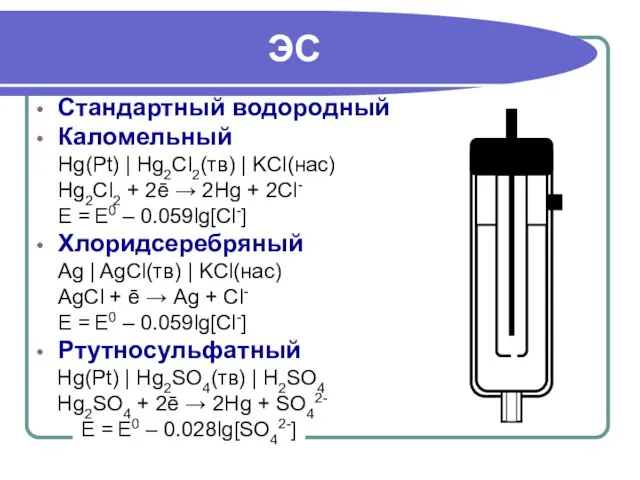
- 27. ЭС Стандартный водородный Каломельный Hg(Pt) | Hg2Cl2(тв) | KCl(нас) Hg2Cl2 + 2ē → 2Hg + 2Cl-
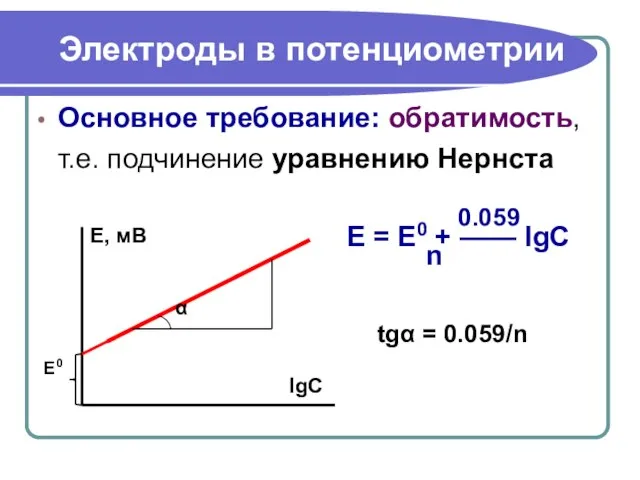
- 28. Электроды в потенциометрии Основное требование: обратимость, т.е. подчинение уравнению Нернста 0.059 E = E0 + ——
- 29. Электроды I рода Катионные: - металлические - амальгамные - водородный Анионные 0.059 E = E0 +
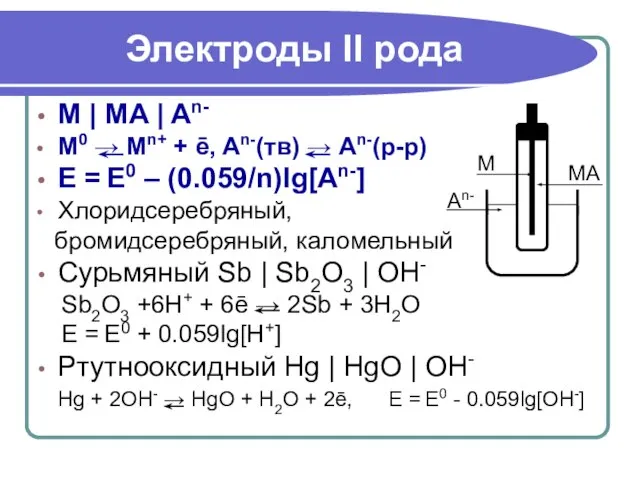
- 30. M | MA | An- M0 → Mn+ + ē, An-(тв) → An-(р-р) E = E0
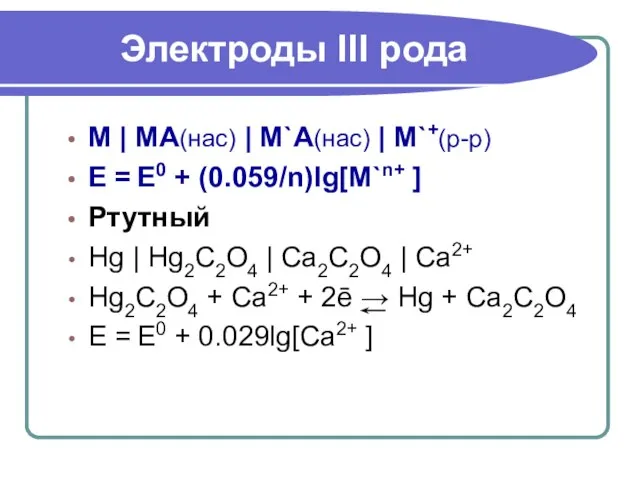
- 31. M | MA(нас) | M`A(нас) | M`+(р-р) E = E0 + (0.059/n)lg[M`n+ ] Ртутный Hg |
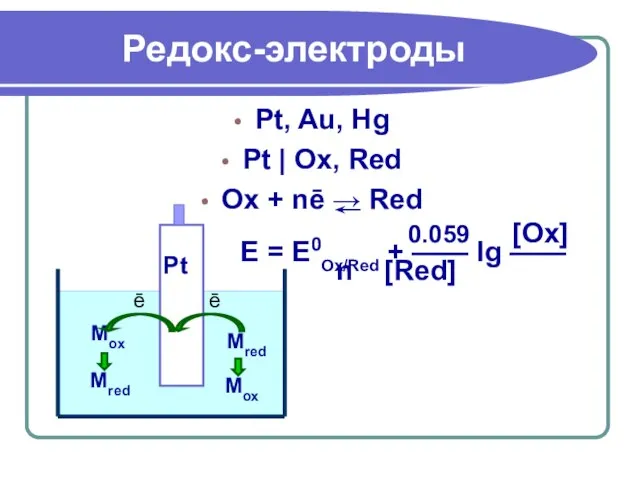
- 32. Редокс-электроды Pt, Au, Hg Pt | Ox, Red Ox + nē → Red 0.059 [Ox] E
- 34. Скачать презентацию




![СВЭ [H+] = 1 M p(H2) = 1 атм EСВЭ =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/540353/slide-13.jpg)
![Уравнение Нернста RT [Ox] Eox/red = E0ox/red + — ln——— nF](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/540353/slide-14.jpg)







 Минералы. Классификация минералов
Минералы. Классификация минералов Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск
Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск  Минералы и горные породы
Минералы и горные породы Производство серной кислоты
Производство серной кислоты Типы химических реакций
Типы химических реакций Презентация по химии Химические уравнения Реакции обмена
Презентация по химии Химические уравнения Реакции обмена  Презентация по химии Аминокислоты и история их открытия
Презентация по химии Аминокислоты и история их открытия  Магній. Знаходження в періодичній системі і основні характеристики
Магній. Знаходження в періодичній системі і основні характеристики Антибиотики. Классификация антибиотиков по механизму действия
Антибиотики. Классификация антибиотиков по механизму действия Синтетические волокна Выполнила
Синтетические волокна Выполнила Современные проблемы геологии. Изотопный взгляд на проблему
Современные проблемы геологии. Изотопный взгляд на проблему Чипсы, вред или польза
Чипсы, вред или польза Водороды
Водороды Как вести себя при встрече с агрессивными собаками Как вести себя при встрече с агрессивными собаками
Как вести себя при встрече с агрессивными собаками Как вести себя при встрече с агрессивными собаками Презентация по химии на тему: Бром
Презентация по химии на тему: Бром Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Химические свойства органических соединений
Химические свойства органических соединений Магматические горные породы
Магматические горные породы Политетрафторэтилен
Политетрафторэтилен Гноеродные (пиогенные) кокки
Гноеродные (пиогенные) кокки Полимеры
Полимеры Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы
Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії Оксиды, их классификация и свойства
Оксиды, их классификация и свойства