Содержание
- 2. УЛЫБНИСЬ НОВОМУ ЗНАНИЮ Давайте изучим мы сегодня отменно элементы галогены. А по-русски - солероды, Все –
- 3. ЦЕЛИ УРОКА: На основе положения в ПСХЭМ рассмотреть и сформулировать знания о строении атомов галогенов, свойствах
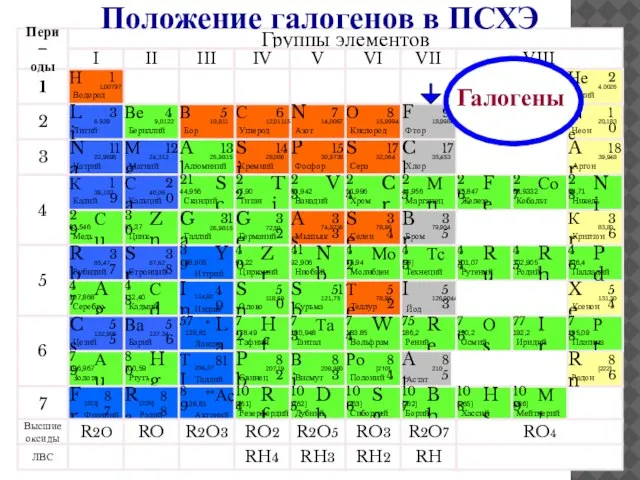
- 4. Галогены Положение галогенов в ПСХЭ
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА +9 ) ) 2 7 +17 ) ) ) 2 8 7 +35 )
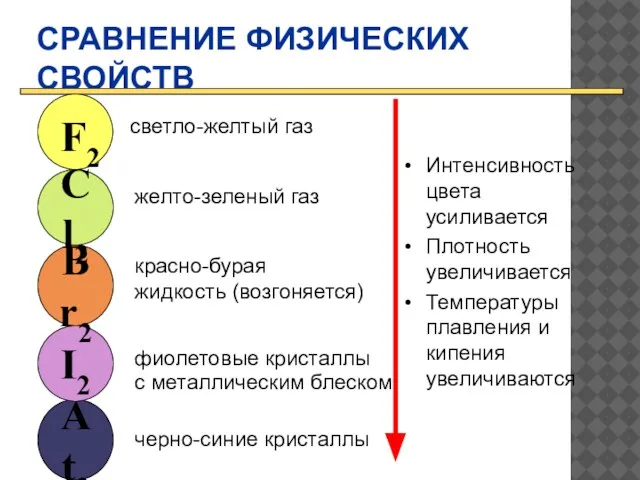
- 6. СРАВНЕНИЕ ФИЗИЧЕСКИХ СВОЙСТВ Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются At2 I2 Br2
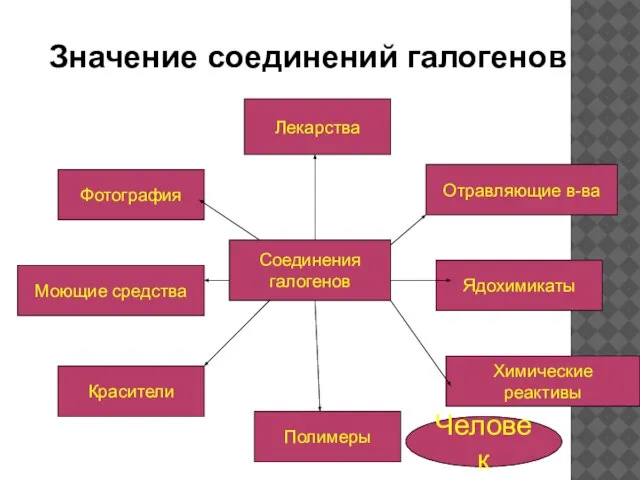
- 7. Лекарства Моющие средства Красители Полимеры Химические реактивы Ядохимикаты Отравляющие в-ва Фотография Значение соединений галогенов Соединения галогенов
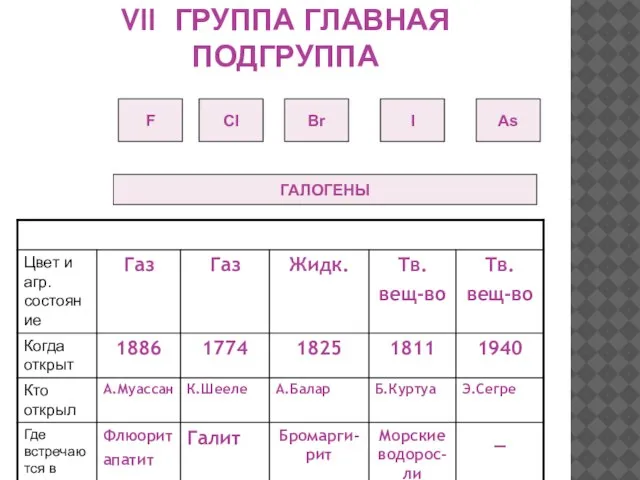
- 8. ИСТОРИЯ ОТКРЫТИЯ ФТОРА В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до
- 9. ИСТОРИЯ ОТКРЫТИЯ ХЛОРА В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной
- 10. ИСТОРИЯ ОТКРЫТИЯ БРОМА В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость,
- 11. ИСТОРИЯ ОТКРЫТИЯ ЙОДА В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов
- 12. ИСТОРИЯ ОТКРЫТИЯ АСТАТА В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как
- 13. НАХОЖДЕНИЕ ГАЛОГЕНОВ В ПРИРОДЕ CaF2 (флюорит) Бесцветный,желтый, голубой, фиолетовый AgBr (бромаргирит)-примеси к другим минералам Бесцветный, розовый,
- 14. НАХОЖДЕНИЕ ГАЛОГЕНОВ В ПРИРОДЕ NaСl (галит) Бесцветный, красный, желтый, синий, голубой 3Ca(PO4 ) 2*CaF2 (апатит) Бесцветный,
- 15. СОЛИ Фториды Хлориды Бромиды Йодиды Галогениды Na F KCl KBr NaI
- 16. VII ГРУППА ГЛАВНАЯ ПОДГРУППА F CI Br I As ГАЛОГЕНЫ
- 17. Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё
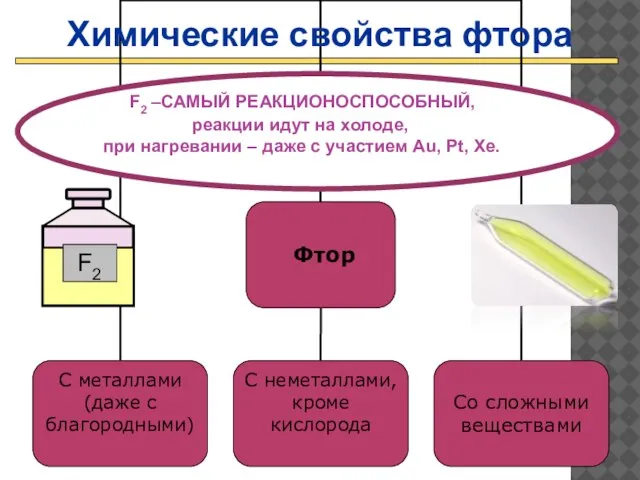
- 18. Проверить F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ, реакции идут на холоде, при нагревании – даже с участием Au, Pt,
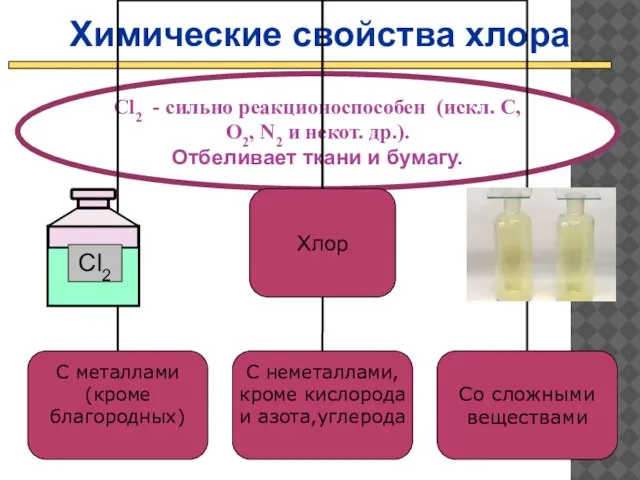
- 19. Химические свойства хлора Cl2 - сильно реакционоспособен (искл. C, O2, N2 и некот. др.). Отбеливает ткани
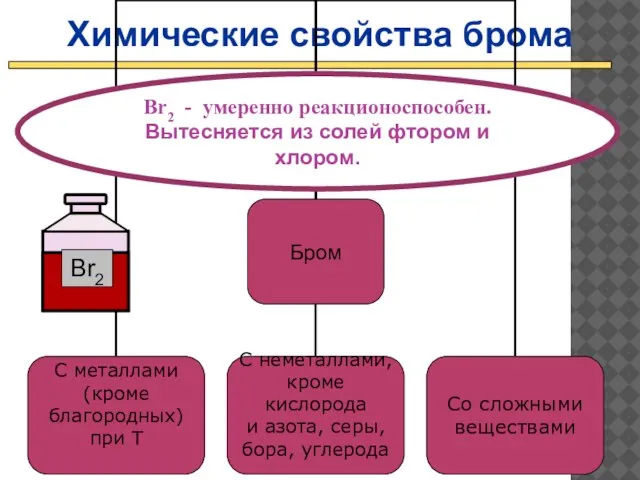
- 20. Химические свойства брома Br2 - умеренно реакционоспособен. Вытесняется из солей фтором и хлором.
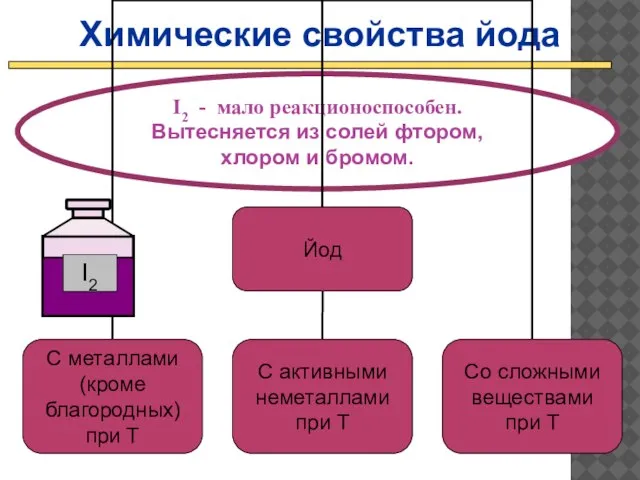
- 21. Химические свойства йода I2 - мало реакционоспособен. Вытесняется из солей фтором, хлором и бромом.
- 22. СОЕДИНЕНИЯ ГАЛОГЕНОВ Галогеноводороды, – Это едкие газы с резким запахом, хорошо раствормые в воде HF HCl
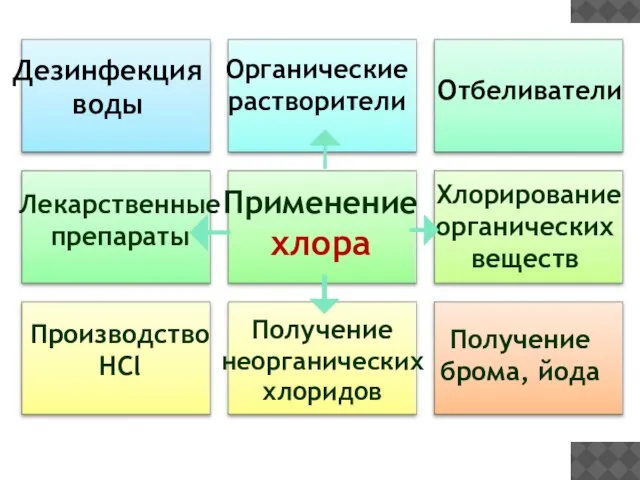
- 23. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
- 24. СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА УВЕЛИЧИВАЕТСЯ 1) KClO3, KCl, KClO 2) Cl2O7, KClO3, KCl 3)KClO4, KCO3, KCl 4)
- 25. ДОПИШИТЕ УРАВНЕНИЯ РЕАКЦИИ 1) Ca(OH)2+ Cl2 2) NaOH + Cl2 * Сафиканов А.Ф.
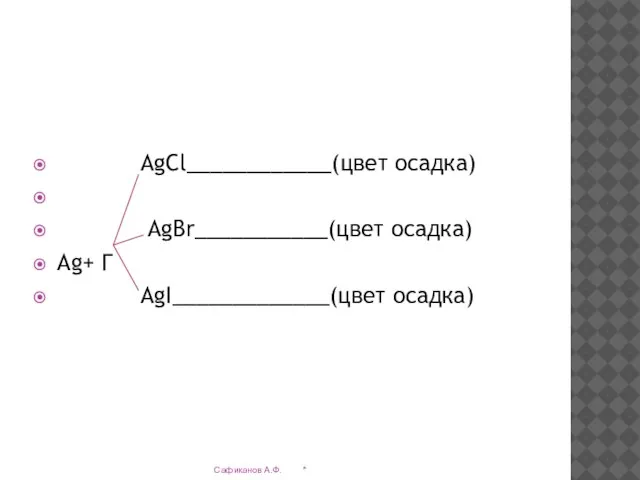
- 26. AgCl____________(цвет осадка) AgBr___________(цвет осадка) Ag+ Г AgI_____________(цвет осадка) * Сафиканов А.Ф.
- 28. Скачать презентацию















 Токсикология и анализ спиртов
Токсикология и анализ спиртов Общая характеристика углерода
Общая характеристика углерода Свинец. Строение атома свинца
Свинец. Строение атома свинца Галогены. Применение галогенов и их соединений
Галогены. Применение галогенов и их соединений Отравляющие и высокотоксичные вещества раздражающего и пульмонотоксического действия
Отравляющие и высокотоксичные вещества раздражающего и пульмонотоксического действия Презентация по Химии "Химия вокруг нас" - скачать смотреть
Презентация по Химии "Химия вокруг нас" - скачать смотреть  Структура нуклеиновых кислот. Обмен нуклеотидов
Структура нуклеиновых кислот. Обмен нуклеотидов Изомерия и ее виды
Изомерия и ее виды Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли  ХТА пестицидов ФОС
ХТА пестицидов ФОС Спирти. Одноатомні насичені спирти (алканоли)
Спирти. Одноатомні насичені спирти (алканоли) Основы коллоидной химии и коагуляции загрязняющих веществ в процессах очистки воды
Основы коллоидной химии и коагуляции загрязняющих веществ в процессах очистки воды Природные источники углеводородов
Природные источники углеводородов Презентация по Химии "Биогенные элементы" - скачать смотреть бесплатно
Презентация по Химии "Биогенные элементы" - скачать смотреть бесплатно Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений
Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений Хлориди.
Хлориди. ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН
ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН  Общие свойства живых организмов
Общие свойства живых организмов Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Применение наноматериалов
Применение наноматериалов Презентация по Химии "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" - скачать смотреть
Презентация по Химии "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" - скачать смотреть  Оксиды и кислородсодержащие кислоты неметаллов
Оксиды и кислородсодержащие кислоты неметаллов Алкадиены
Алкадиены Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения