Содержание
- 2. Химические свойства – способность веществ превращаться в другие под воздействием определенных условий: при изменении температуры, давления
- 3. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Взаимодействие веществ с кислородом называется окислением или горением. с неметаллами с металлами C
- 4. Кислород – сильный окислитель. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar.
- 5. ВЗАИМОДЕЙСТВИЕ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ С КИСЛОРОДОМ НАЗЫВАЕТСЯ ОКИСЛЕНИЕМ. ГОРЕНИЕ —ХИМИЧЕСКАЯ РЕАКЦИЯ,ПРИ КОТОРОЙ ПРОИСХОДИТ ОКИСЛЕНИЕ ВЕЩЕСТВ
- 6. ЗАДАНИЕ № 1 Вставь вместо «?» необходимую формулу с коэффициентом. ? 2P2O5 ? 4P 2Al2O3 3O2
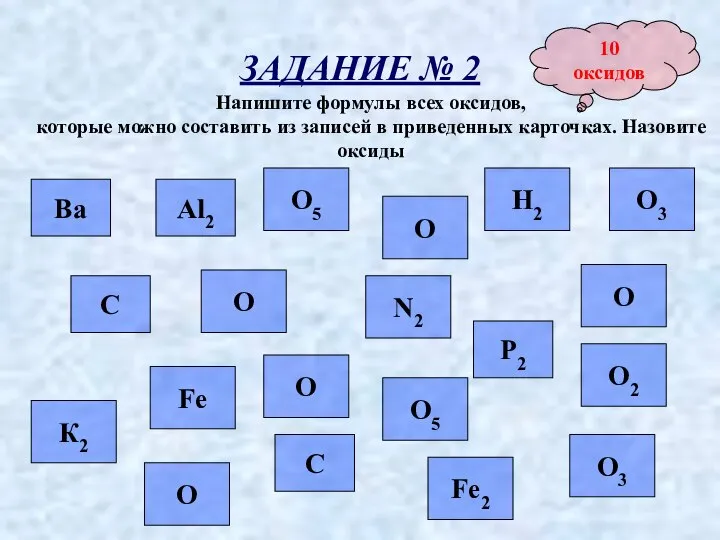
- 7. ЗАДАНИЕ № 2 Напишите формулы всех оксидов, которые можно составить из записей в приведенных карточках. Назовите
- 8. Задание № 3 Из перечисленных формул веществ выпишите оксиды, и назовите их: HCl, SO3, KOH, CO2,
- 9. НАХОЖДЕНИЕ КИСЛОРОДА В ПРИРОДЕ Он всюду и везде: В камне, в воздухе, в воде. Он и
- 10. КРУГОВОРОТ КИСЛОРОДА Растения, поглощая атмосферный кислород в темное время суток, в утренние часы активно выделяют его
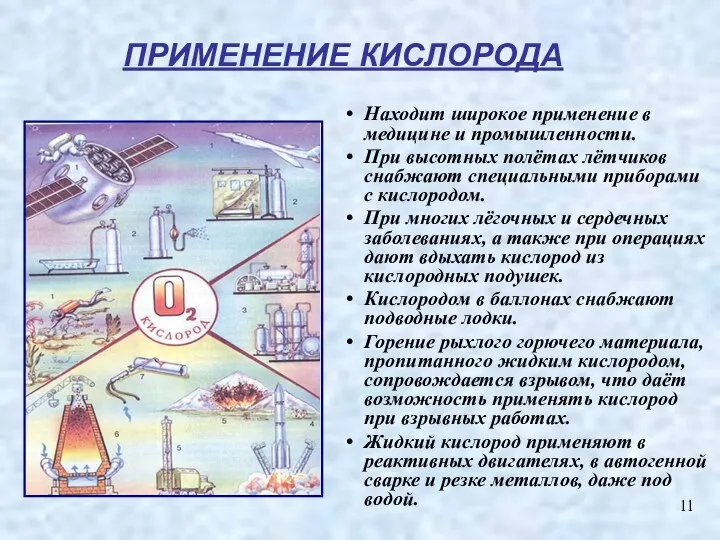
- 11. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 13. Скачать презентацию








 Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Предмет органической химии
Предмет органической химии Образование растворов ВМС
Образование растворов ВМС Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е.
Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е. Химическое равновесие в газах и растворах
Химическое равновесие в газах и растворах Гидролиз. Применение
Гидролиз. Применение Газообразные вещества. Парниковый эффект
Газообразные вещества. Парниковый эффект Мессбауэровские исследования легированных атомами магния литиевых фосфатов железа при деинтерколяции лития
Мессбауэровские исследования легированных атомами магния литиевых фосфатов железа при деинтерколяции лития Дисперсные системы
Дисперсные системы Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Презентация по Химии "Оксиды получение, свойства, применение" - скачать смотреть бесплатно
Презентация по Химии "Оксиды получение, свойства, применение" - скачать смотреть бесплатно Молярный объём газов
Молярный объём газов Химическая связь
Химическая связь Нефть, состав, свойства, переработка
Нефть, состав, свойства, переработка Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Получение дезинфицирующих средств
Получение дезинфицирующих средств Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Тема урока: «Карбонаты» Цель урока: Изучить химические свойства солей угольной кислоты – карбонатов и гидрокарбонатов; приобрес
Тема урока: «Карбонаты» Цель урока: Изучить химические свойства солей угольной кислоты – карбонатов и гидрокарбонатов; приобрес Органические соединения
Органические соединения Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Азотная кислота HNO3 Презентация Ученицы 9 класса «б» Гончаренко Инны
Азотная кислота HNO3 Презентация Ученицы 9 класса «б» Гончаренко Инны  Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Промышленные типы месторождений железа
Промышленные типы месторождений железа