Содержание
- 2. Примеры самопроизвольных процессов Газ расширяется и заполняет свободный объём, но спонтанно не сжимается до меньшего объёма;
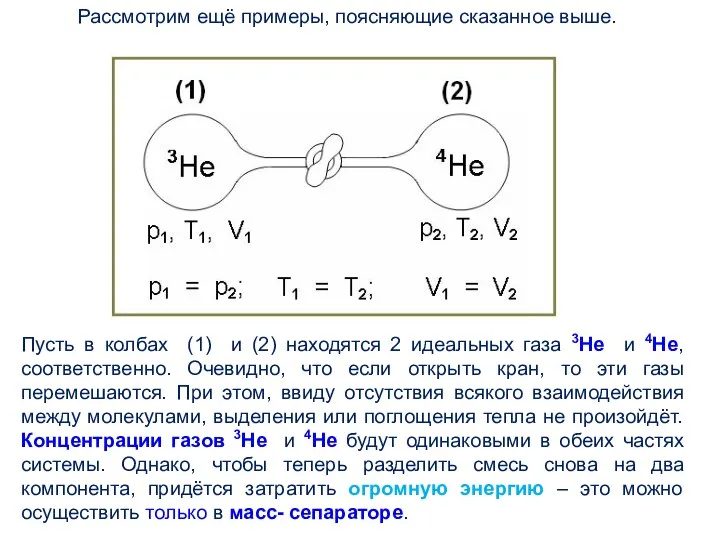
- 3. Рассмотрим ещё примеры, поясняющие сказанное выше. Пусть в колбах (1) и (2) находятся 2 идеальных газа
- 4. Пусть мы хотим удалить примеси из кристалла Ge. Известно, что для полупроводниковой техники необходимо иметь Ge
- 5. Из этих примеров очевидно, что имеется нечто, не связанное непосредственно с энергией, что характеризует направление спонтанного
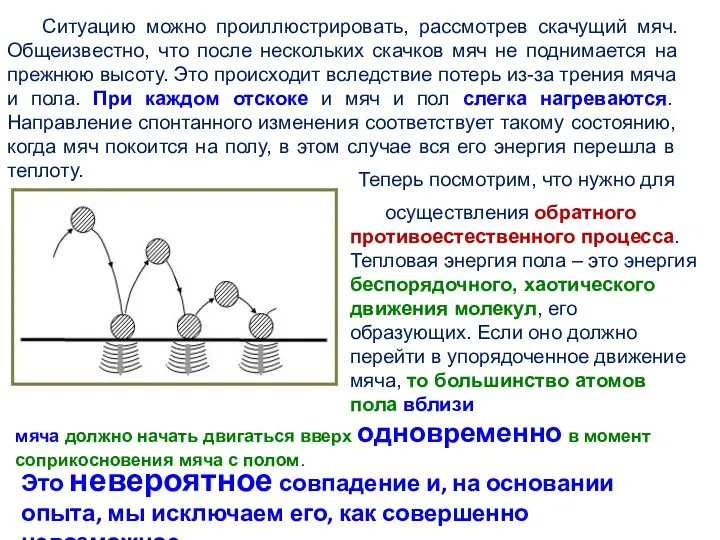
- 6. Ситуацию можно проиллюстрировать, рассмотрев скачущий мяч. Общеизвестно, что после нескольких скачков мяч не поднимается на прежнюю
- 7. Теперь можно понять, почему направление спонтанного изменения будет именно таким, каким мы его описали. Энергия мяча
- 8. То же относится к примеру с двуокисью углерода и алмазом. Энергия, запасённая в небольшом упорядоченном кристалле
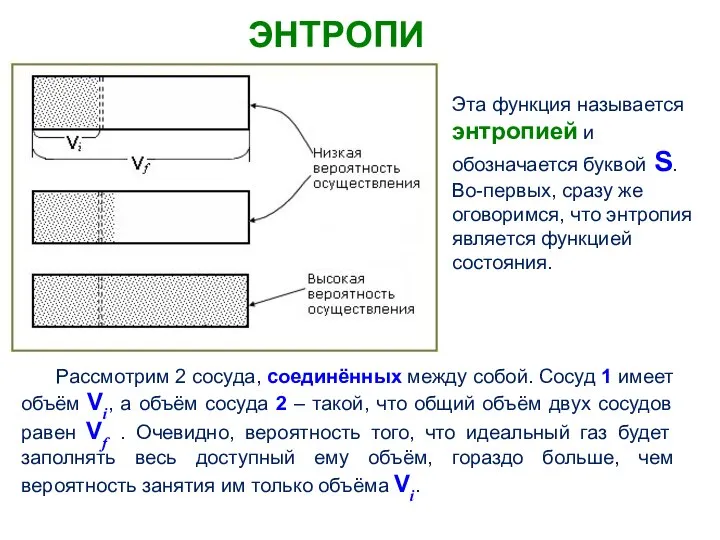
- 9. ЭНТРОПИЯ. Рассмотрим 2 сосуда, соединённых между собой. Сосуд 1 имеет объём Vi, а объём сосуда 2
- 10. В этом смысле равновесное состояние – это наиболее вероятное состояние. Спонтанное изменение имеет направление: от ситуации
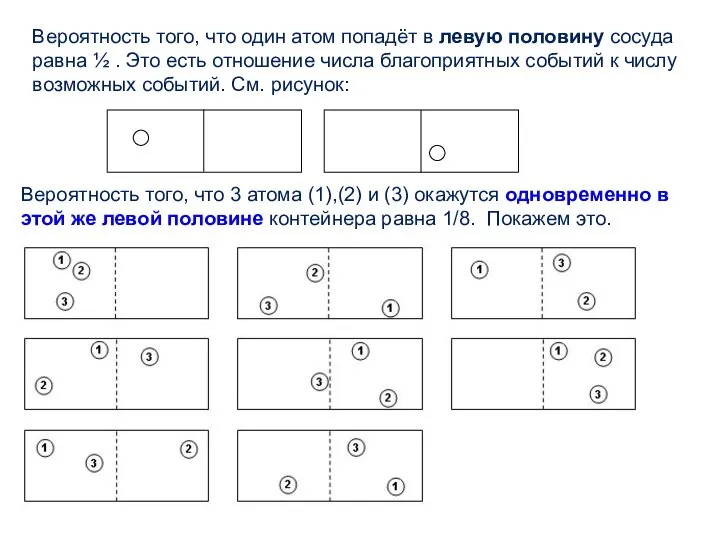
- 11. Вероятность того, что один атом попадёт в левую половину сосуда равна ½ . Это есть отношение
- 12. Здесь указаны все возможные распределения 3-х молекул по двум половинам контейнера. Благоприятной является лишь 1 единственная
- 13. Итак, мы установили, что: 1) система изменяется спонтанно в направлении большего рассеивания энергии; 2) для идеального
- 14. Свободная энергия Гиббса Рассмотрим некоторую химическую реакцию. Например, образование аммиака: N2 + 3 H2 ⇄ 2
- 15. Из предыдущего изложения известно, что мерой изменения энергии системы является величина и знак ΔН, а мерой
- 16. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Для любой химической реакции: аА + bB + cC + … = lL +
- 17. Но, кроме того, для любой реакции положение равновесия при 25°С (298.16К) определяется величиной ΔG°, которую как
- 18. Для реакций, в которых ΔG° = 0 К = 1. Очевидно, что чем более отрицательна ΔG°,
- 19. . При этом возможны три случая: 1. Обе величины и ΔН° и ΔS° благоприятствуют протеканию реакции:
- 20. Примеры Случай 1. ½ O2(г) + С(т) = СО(г) ΔG° = – 137.2 кДж/моль ΔН° =
- 21. Случай 2. ΔН° N2(г) + 3 H2(г) 2 NH3(г) Случай 3. Самый редкий. Реакция растворения в
- 22. ЗАВИСИМОСТЬ КОНСТАНТЫ ХИМИЧЕСКОГО РАВНОВЕСИЯ ОТ ТЕМПЕРАТУРЫ. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ. Константа равновесия химической реакции (или для любого другого
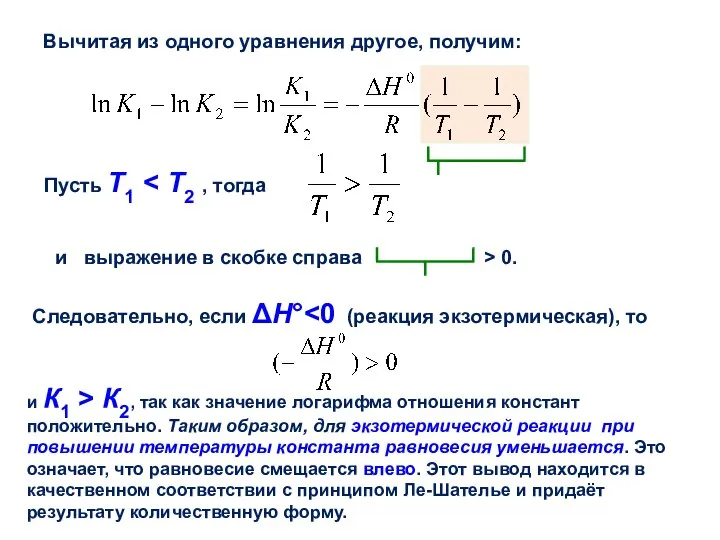
- 23. Вычитая из одного уравнения другое, получим: Пусть Т1 и выражение в скобке справа > 0. Следовательно,
- 24. Принцип Ле-Шателье. При возмущении системы, находящейся в равновесии, она отвечает на возмущение таким путём, чтобы снять
- 25. Решение. a) Пусть у нас имеется 1 литр смеси газов (т.е. в сосуде объёмом 1 л
- 26. d) Гетерогенные равновесия До сих пор мы ограничивались рассмотрением только гомогенных равновесий, то есть равновесий существующих
- 27. С(т) + O2(г) СO2(г) и запишем для неё обычным образом выражение для константы равновесия Рассмотрим обратимую
- 28. Общее правило: Концентрации чистых конденсированных фаз являются постоянными и принимаются равными 1 (или их можно включить
- 29. Гетерогенные реакции, в которых принимает участие твёрдая фаза, обычно ограничены поверхностью или границей раздела между твёрдой
- 30. Это исключает необходимость введения концентрации твёрдого NH4Cl в выражение для константы равновесия. Примером сдвига равновесия и
- 32. Скачать презентацию
























 Дослідження розчинності речовин природознавство
Дослідження розчинності речовин природознавство Францій БІОЛОГІЧНА РОЛЬ
Францій БІОЛОГІЧНА РОЛЬ  Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Составы и температуры плавления смесей
Составы и температуры плавления смесей Химическая коррозия
Химическая коррозия Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Что такое полупроводники
Что такое полупроводники Направление окислительно-восстановительного процесса
Направление окислительно-восстановительного процесса Приготовление основного и рабочих растворов хлорной извести
Приготовление основного и рабочих растворов хлорной извести Презентация по Химии "Вклад Д.И. Менделеева в развитие агрохимии. Значение его вклада в современном сельском хозяйстве" - скач
Презентация по Химии "Вклад Д.И. Менделеева в развитие агрохимии. Значение его вклада в современном сельском хозяйстве" - скач Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Растворение. Растворимость веществ в воде. 8 класс
Растворение. Растворимость веществ в воде. 8 класс гетероциклич
гетероциклич Железо-углеродистые сплавы
Железо-углеродистые сплавы Изомерия - презентация_
Изомерия - презентация_ Презентация по Химии "Избранные главы металлоорганической химии" - скачать смотреть
Презентация по Химии "Избранные главы металлоорганической химии" - скачать смотреть  Сшивка и контролируемая деструкция полиолефинов
Сшивка и контролируемая деструкция полиолефинов Типы химических реакций
Типы химических реакций Периодический закон и Периодическая система химических элементов
Периодический закон и Периодическая система химических элементов Оксиды азота
Оксиды азота Российские химические технологии
Российские химические технологии Хімічні властивості кислот
Хімічні властивості кислот Получение водорода с использованием технологии газификации угля и отходов угольной промышленности
Получение водорода с использованием технологии газификации угля и отходов угольной промышленности Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения