Содержание
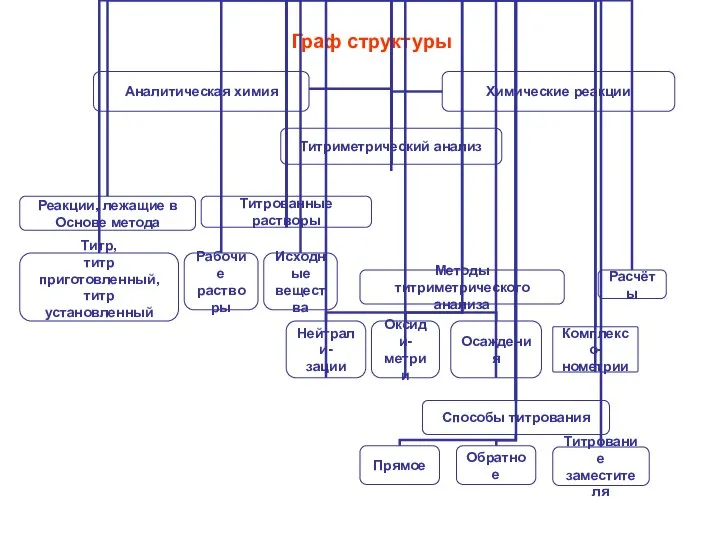
- 2. Граф структуры
- 3. Восстановитель – молекула, атом или ион, отдающий электроны, при этом степень окисления его растет. Окислитель –
- 4. В 1888-1889 гг. Нернст изучал поведение электролитов при пропускании электрического тока и открыл фундаментальный закон, известный
- 5. Электродные потенциалы в водных растворах при 25оС и при парциальном давлении газов, равном нормальному атмосферному давлению.
- 6. Пользуясь значениями ео, можно прогнозировать возможность протекания и направление окислительно-восстановительной реакции. F2 + 2e → 2F-
- 7. I2 +2e → 2I- φ0 = 0.54 В S4O62- +2e → 2S2O32- φ0 = 0.17 В
- 8. Электродные потенциалы в водных растворах при 25оС и при парциальном давлении газов, равном нормальному атмосферному давлению.
- 9. Растворы тиосульфата обычно готовят из кристаллического Na2S2О3∙5Н2О, который при хранении постепенно теряет часть кристаллизационной воды. Важнейшими
- 10. Приготовление и стандартизация раствора иода. Кристаллический иод мало растворим в воде (0,00133 моль/л), но его растворимость
- 11. В качестве индикатора в иодометрии используется раствор крахмала в воде, который с I2 дает интенсивно синюю
- 12. При титровании раствора йода раствором тиосульфата синяя окраска исчезает. Для исключения потерь I2 за счет адсорбции
- 13. Приборы для определения йода в иодидах металлов.
- 14. Прямое титрование используется для определения активных восстановителей. I2 + 2Na2S2O3 = 2NaI + Na2S4O6 К определенному
- 15. Растворами иода можно непосредственно титровать соединения As(III), Sb(III), Sn(II), сульфиты, сульфиды, тиосульфаты, сероводород и некоторые другие
- 16. Метод заместителя Иодометрическое определение окислителей основано на окислении иодид-иона и тировании выделившегося иода тиосульфата натрия. (например,
- 17. Одной из наиболее важных реакций этого типа является реакция иодида с дихроматом Сr2О72- + 6I- +
- 18. Определение железа Ионы Fе3+ окисляют I- в кислом растворе: 2Fе3+ + 2I- = 2Fe2+ + I2
- 19. Определение витамина С в чёрной смородине Отмеряем 20 мл отжатого сока чёрной смородины и разбавляем его
- 20. Обратное титрование ( используется для определения малоактивных и летучих восстановителей). I2 + Na2S = 2NaI +
- 21. Перманганатометрия Метод химического титриметрического анализа, основанный на применении растворов перманганата калия (KMnO4) для количественных объемных определений.
- 22. В большинстве случаев титрование восстановителей (например, Fe(II) и Mn(II), Mo(III) и Ti(III), -C2O42-, AsO2-, NO2- ,
- 23. Некоторые вещества (например, сульфиты, сульфиды, тиосульфаты, гидразин) окисляются легче в нейтральной или щелочной среде; в этом
- 24. Рабочим раствором в этом методе является раствор KMnO4. Например, нужно приготовить 1 л 0,1н. раствора KMnO4.
- 25. Хранить раствор KMnO4 следует в склянке из темного стекла либо в темном месте. Охлажденный приготовленный раствор
- 26. Затем раствор фильтруют и устанавливают точную концентрацию, используя исходные вещества: H2C2O4, Na2C2O4
- 27. Для определения концентраций: а) перекиси водорода Н2О2 (пергидроль) – методом прямого титрования 2KMnO4 + 5H2O2 +
- 28. б) Ионов Fe(II), Cr(III), TI(I), W(V), V(IV), Sb(III), гидразина, других органических восстановителей методом прямого титрования в)
- 29. г) Восстановителей, медленно реагирующих с KMnO4 (иодиды, цианиды, тиоцианаты), а также летучих, например НСООН, Н2S методом
- 30. В медицине: а) для контроля качества пероксидов водорода, лактата и глюконата кальция, нитрита натрия, левомицетина, фумарата
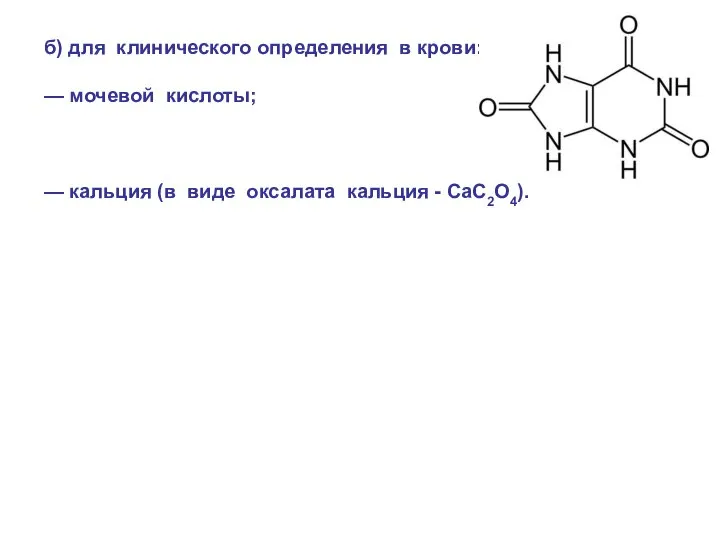
- 31. б) для клинического определения в крови: — мочевой кислоты; — кальция (в виде оксалата кальция -
- 32. Комплексоны (хелаты) - полидентатные лиганды – органические соединения, образующие комплексные соединения с ионами металлов. Трилонометрия Происхождение
- 33. Комплексонометрическое титрование: Метод основан на образовании хорошо растворимых в воде и слабо диссоциированных комплексных соединений при
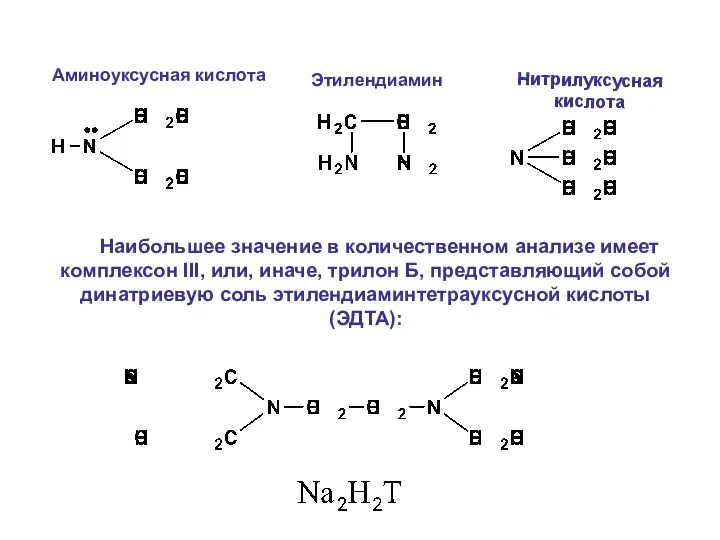
- 34. Аминоуксусная кислота Нитрилуксусная кислота Этилендиамин Наибольшее значение в количественном анализе имеет комплексон III, или, иначе, трилон
- 35. Состав комплекса Ме-Трилон «Б» всегда 1:1!!! И все они бесцветны!
- 36. Чем выше заряд иона Мех+, тем образующийся комплекс прочнее! По возрастающей степени устойчивости комплекса металл-ЭДТА двухвалентные
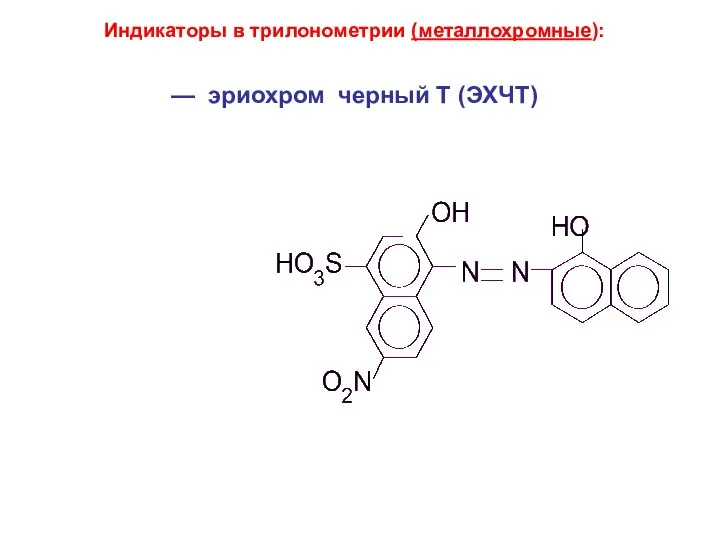
- 37. Индикаторы в трилонометрии (металлохромные): — эриохром черный Т (ЭХЧТ)
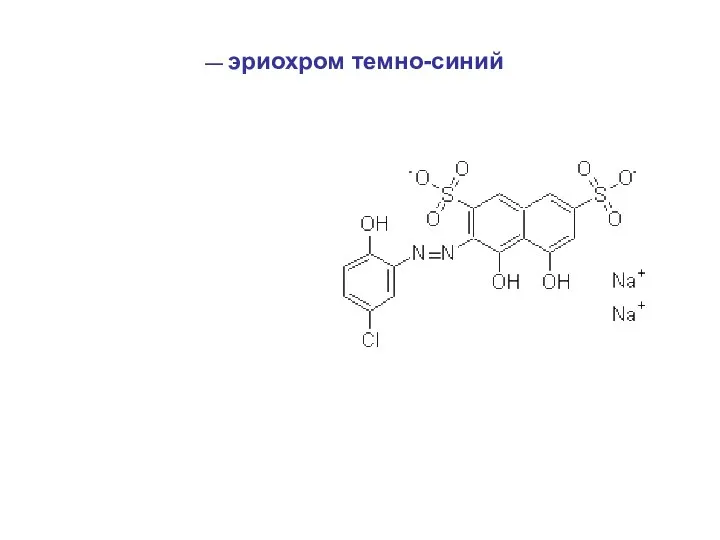
- 38. — эриохром темно-синий
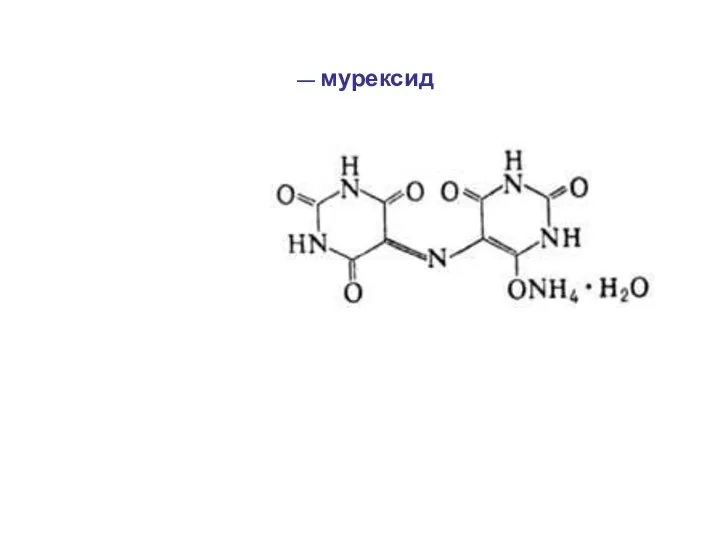
- 39. — мурексид
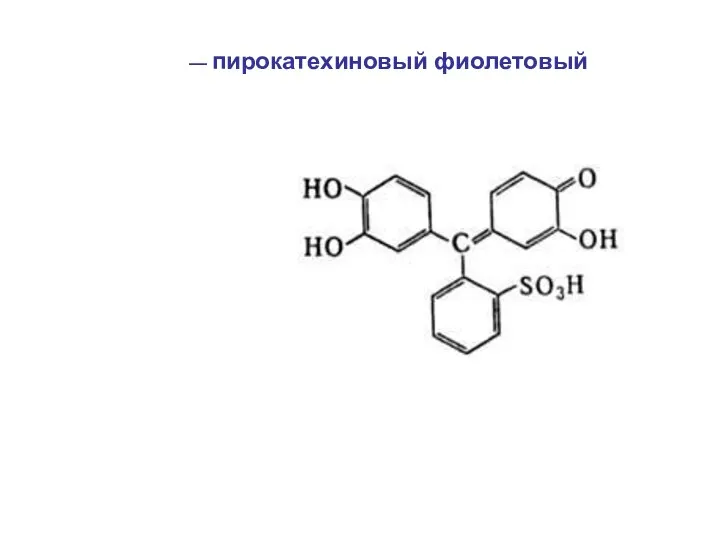
- 40. — пирокатехиновый фиолетовый
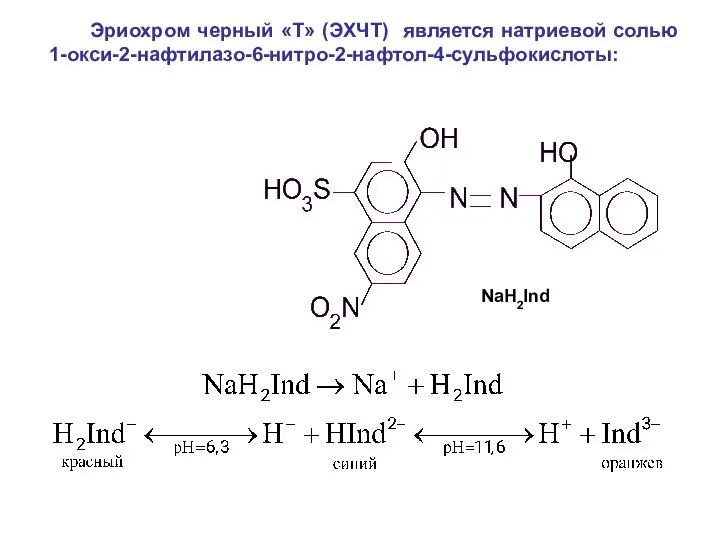
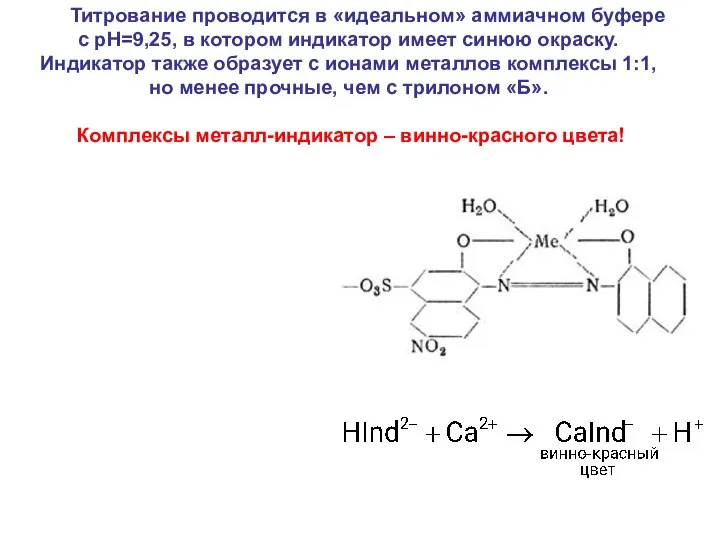
- 41. Эриохром черный «Т» (ЭХЧТ) является натриевой солью 1-окси-2-нафтилазо-6-нитро-2-нафтол-4-сульфокислоты: NaH2Ind
- 42. Титрование проводится в «идеальном» аммиачном буфере с рН=9,25, в котором индикатор имеет синюю окраску. Индикатор также
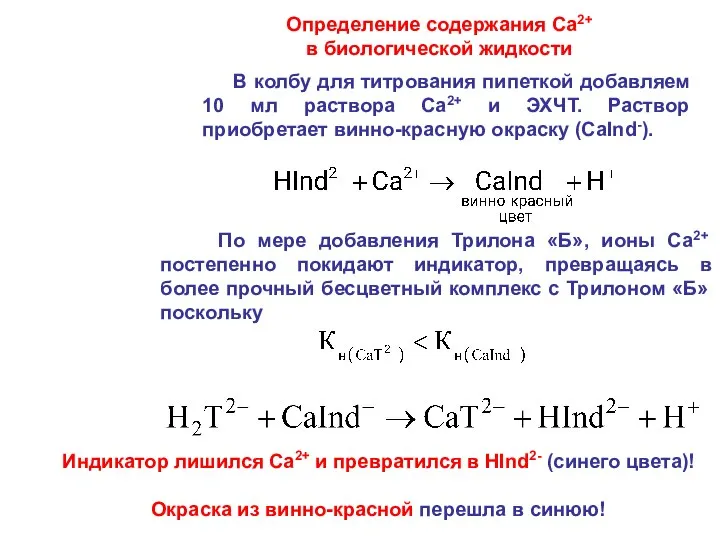
- 43. Определение содержания Ca2+ в биологической жидкости В колбу для титрования пипеткой добавляем 10 мл раствора Ca2+
- 45. Расчёты ведём по формулам:
- 46. Применение: 1. Для определения жесткости воды. Раствор с индикатором до начала титрования В точке эквивалентности цвет
- 47. 2. В медицине для определения в различных жидкостях и тканях человеческого организма микроэлементов и содержания различных
- 48. 3. Комплексоны успешно применяются для растворения камней, образующихся в почках, печени и желчном пузыре. Такое применение
- 49. 5. При свинцовых и ртутных отравлениях. 4. Для лечения лучевой болезни.
- 50. 6. Для устранения жесткости воды (уменьшения концентрации ионов Са 2+ и Mg 2+
- 51. Методы осаждения Ag+ + Cl- = AgCl↓ Ba2+ + SO42- = BaSO4 ↓ 3Ca2+ + 2PO43-
- 53. Скачать презентацию








































 Второе начало термодинамики. Направленность химических процессов
Второе начало термодинамики. Направленность химических процессов Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов  Мое любимое химическое вещество: Серебро
Мое любимое химическое вещество: Серебро Кристаллические решетки
Кристаллические решетки Относительная атомная масса
Относительная атомная масса Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Реакционная способность аренов
Реакционная способность аренов NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Вчені - хіміки
Вчені - хіміки  Строение атома
Строение атома Плазма та її властивості. Практичне застосування плазми. (11 клас)
Плазма та її властивості. Практичне застосування плазми. (11 клас) Свойства покрытий на основе акрилового лака
Свойства покрытий на основе акрилового лака СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Презентация по Химии "Токсикологическая химия" - скачать смотреть
Презентация по Химии "Токсикологическая химия" - скачать смотреть  Нуклеиновые кислоты
Нуклеиновые кислоты Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4)
Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4) Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей Тайна воды которую мы пьём
Тайна воды которую мы пьём L’introduction a la biochimie. La structure et les proprietes des proteines
L’introduction a la biochimie. La structure et les proprietes des proteines Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Системы эвтектического типа
Системы эвтектического типа Тренировочный вариант заданий для подготовки к ГИА по химии
Тренировочный вариант заданий для подготовки к ГИА по химии Химическое строение рецепторов и лигандов. Агонисты и антогонисты, принцип структурной комплементарности
Химическое строение рецепторов и лигандов. Агонисты и антогонисты, принцип структурной комплементарности Презентация по химии Количество вещества
Презентация по химии Количество вещества Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения
Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения