Содержание
- 2. Содержание Электролитическая диссоциация воды Ионное произведение воды Водородный показатель (рН) Определение рН водных растворов Буферные растворы
- 3. Диссоциация воды Упрощенная запись уравнения диссоциации воды : H2O H+ + OH− Константа диссоциации воды при
- 4. Ионное произведение воды Kw при Т=298 К При повышении температуры Kw увеличивается Модуль 2. Лекция 9.
- 5. Концентрации ионов H+ и OH− Расчет [H+] и [OH-] в 0,01 М растворе NaOH NaOH =
- 6. Водородный показатель рН pH = -lg [H+] Расчет рН 0,01 М раствора соляной кислоты HCl =
- 7. Расчет рН 0,01 М раствора HBrO HBrO - слабый электролит HBrO H+ + BrO− [H+] =
- 8. Расчет рН 0,01 М раствора аммиака Гидрат аммиака - слабый электролит Модуль 2. Лекция 9. Ионное
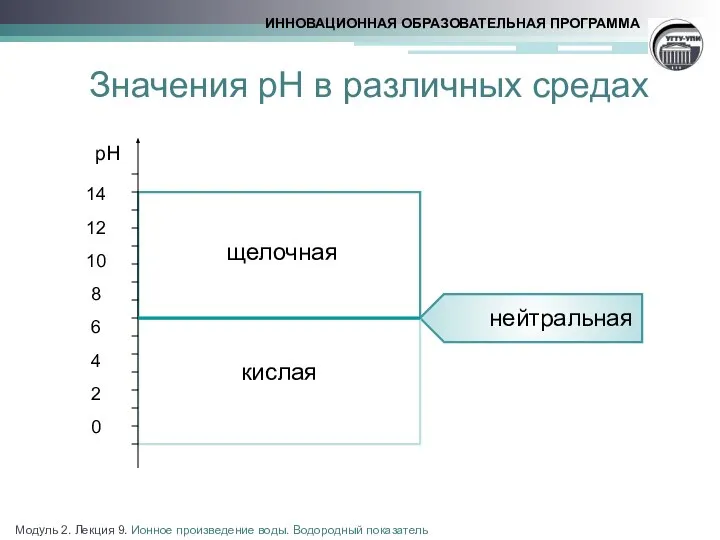
- 9. Нейтральная среда Кислая среда Щелочная среда Количественные характеристики среды Модуль 2. Лекция 9. Ионное произведение воды.
- 10. Значения рН в различных средах Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
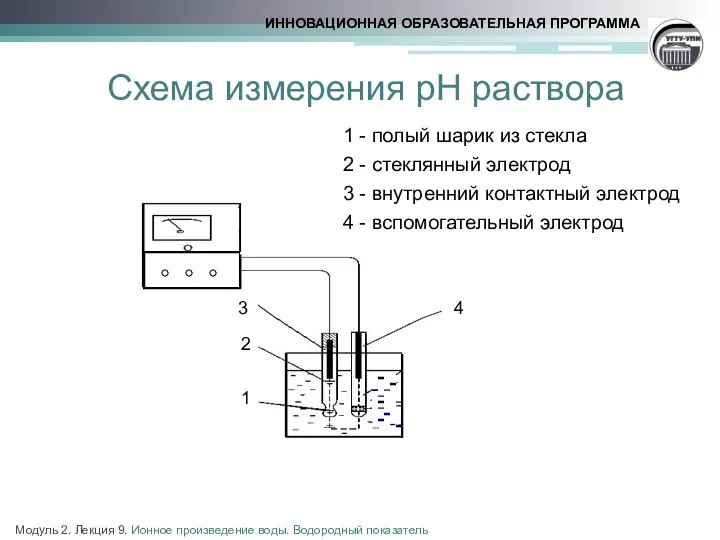
- 11. Схема измерения рН раствора 1 - полый шарик из стекла 2 - стеклянный электрод 3 -
- 12. Прибор для измерения рН рН-метр «ЭКСПЕРТ-рН» Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
- 13. Индикатор фенолфталеин преобладает молекулярная форма преобладает ионная форма HInd H+ + Ind- бесцветный малиновый Модуль 2.
- 14. Индикатор метиловый оранжевый преобладает молекулярная форма преобладает ионная форма 1 2 3 4 5 6 7
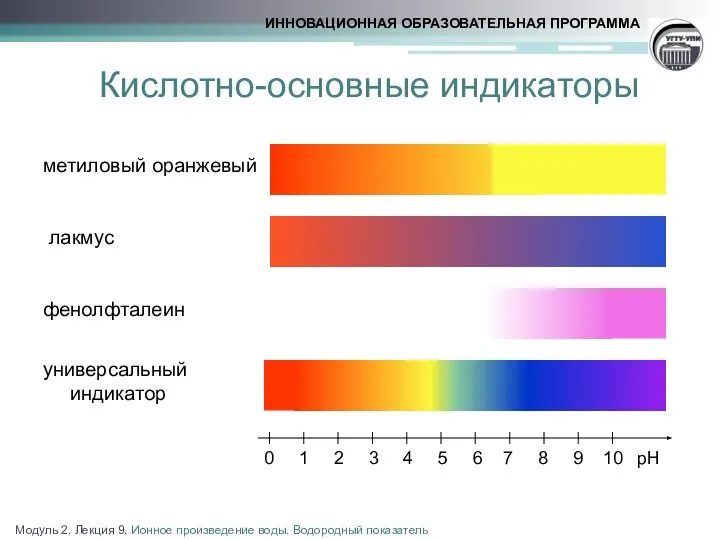
- 15. Кислотно-основные индикаторы метиловый оранжевый лакмус фенолфталеин универсальный индикатор рН 0 1 2 3 4 5 6
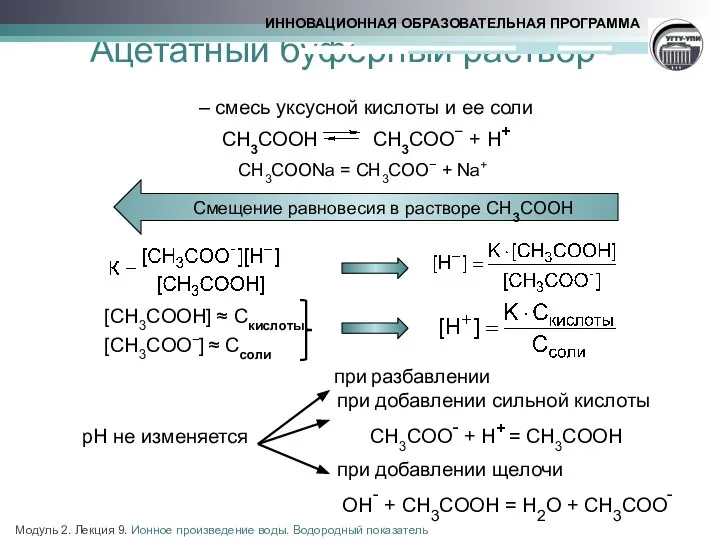
- 16. Ацетатный буферный раствор - – смесь уксусной кислоты и ее соли СН3СООН СН3СОО− + Н+ СН3СООNa
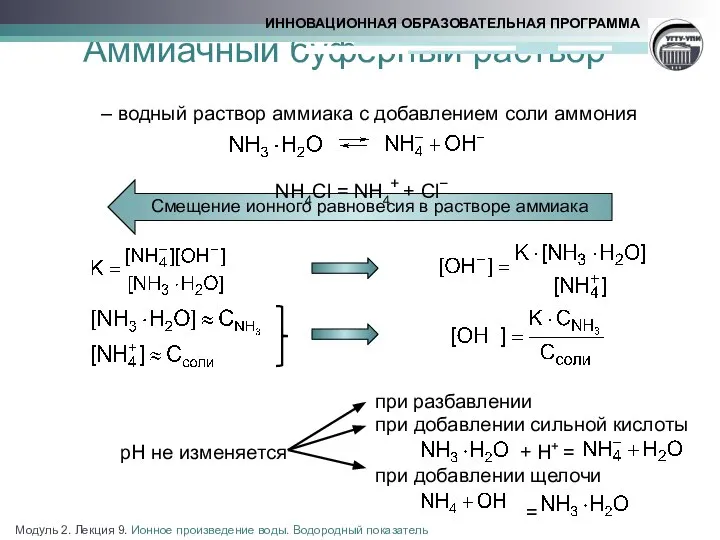
- 17. Аммиачный буферный раствор – – водный раствор аммиака с добавлением соли аммония NН4Cl = NH4+ +
- 18. Заключение Электропроводность чистой воды обусловлена ее автопротолизом. Вода проявляет свойства слабого электролита Для воды и разбавленных
- 20. Скачать презентацию



![Концентрации ионов H+ и OH− Расчет [H+] и [OH-] в 0,01](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395276/slide-4.jpg)
![Водородный показатель рН pH = -lg [H+] Расчет рН 0,01 М](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395276/slide-5.jpg)







 Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Кислоты. Классификация кислот
Кислоты. Классификация кислот ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Методы защиты растений от вредителей
Методы защиты растений от вредителей Твердость минералов и их применение
Твердость минералов и их применение Современные представления о происхождении нефти и газа
Современные представления о происхождении нефти и газа Органические вещества 9 класс
Органические вещества 9 класс Элементы IV группы, побочной подгруппы периодической системы Менделеева
Элементы IV группы, побочной подгруппы периодической системы Менделеева Органические вещества
Органические вещества Молекулы. Свойства молекул
Молекулы. Свойства молекул Уравнения химической реакции 8 класс
Уравнения химической реакции 8 класс Оксид кремния
Оксид кремния Жуғыш заттар және жуғыш әсері. 1 Лекция
Жуғыш заттар және жуғыш әсері. 1 Лекция Чугуны. Структура и свойства. Классификация и применение
Чугуны. Структура и свойства. Классификация и применение Алканы. Хлороформ
Алканы. Хлороформ Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Минералы. Классификация
Минералы. Классификация Строение атома кремния
Строение атома кремния Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим
Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим Занимательные опыты по химии
Занимательные опыты по химии Enantioselective Total Synthesis
Enantioselective Total Synthesis Углерод. 9 класс
Углерод. 9 класс Спирты
Спирты Биополимеры: естественные и искусственные
Биополимеры: естественные и искусственные Коллигативные свойства растворов
Коллигативные свойства растворов Производство аммиака
Производство аммиака