Содержание
- 2. Содержание Определение Классификация кислот Номенклатура Изомерия Получение Химические свойства (как минеральные кислотыкислоты; специфические свойства ) Применение
- 3. Определение Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH.
- 4. Классификация кислот В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные
- 5. Дайте классификацию следующим кислотам: COOH O O O || || || HO – C – (CH2)2
- 6. HCOOH Муравьиная (метановая) - формиат CH3COOH Уксусная (этановая) - ацетат CH3CH2COOH Пропионовая (пропановая) - пропионат CH3(CH2)2COOH
- 7. Номенклатура В систематической номенклатуре кислот действуют следующие правила: 1. Главная цепь должна начинаться и нумероваться с
- 8. 4 3 2 1 CH3 – CH2 – CH – COOH 2 – метилбутановая кислота |
- 9. Изомерия 1)углеродного скелета CH3 – CH2 – CH2 – COOH CH3 – CH – COOH |
- 10. Получение: 1.Вытеснение кислот из солей более сильной кислотой (лаб. способ): 2CH3COONa + H2SO4 → Na2SO4 +
- 11. 3.Окисление альдегидов (в лаб.- Ag2O; Cu(OH)2; в пром.- O2, kat) kat 2R-CH = O + O2
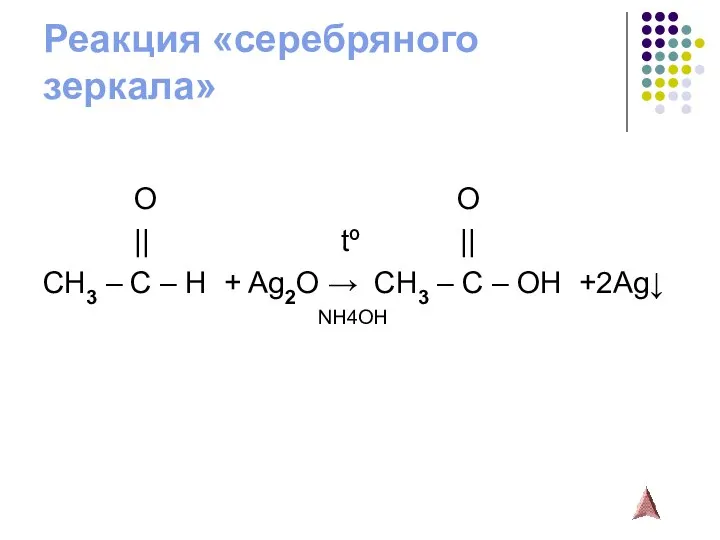
- 12. Реакция «серебряного зеркала» O O || tº || CH3 – C – H + Ag2O →
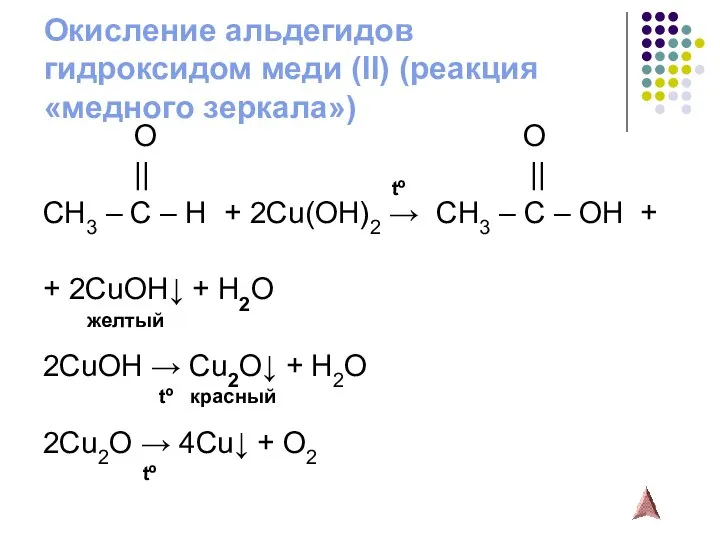
- 13. Окисление альдегидов гидроксидом меди (II) (реакция «медного зеркала») O O || tº || CH3 – C
- 14. Химические свойства I.Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. 1.Из-за смещения электронной плотности от гидроксильной
- 15. 2. Они реагируют с активными металлами. 2СH3COOH + Mg → (CH3COO)2Mg + H2↑ 3. Реагируют с
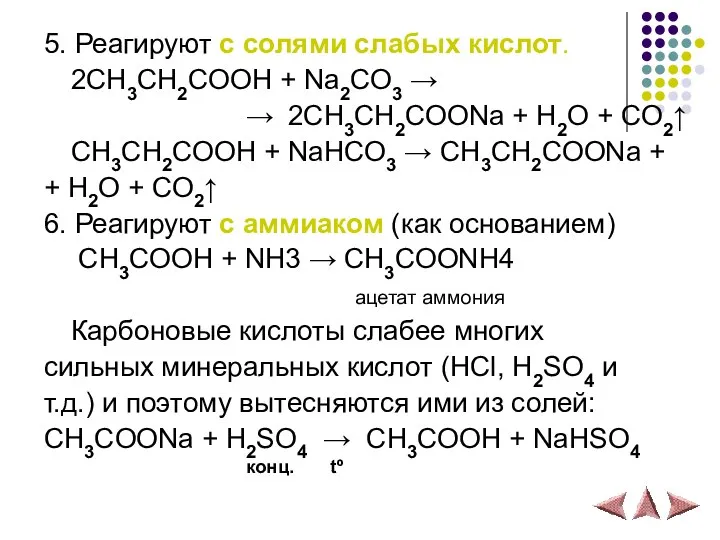
- 16. 5. Реагируют с солями слабых кислот. 2СH3CH2COOH + Na2CO3 → → 2CH3CH2COONa + H2O + CO2↑
- 17. II.Специфические свойства карбоновых кислот. 7. Реакция этерификации. H2SO4 конц. CH3–COOH + HO–CH3 ↔ CH3–COOCH3 + H2O
- 18. Внимание! Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации.
- 19. 8. При воздействии водоотнимающих реагентов в результате межмолекулярной дегидратации образуются ангидриды. CH3–С–OH + H–O–С–CH3 → CH3–С–O–С–CH3+
- 20. 9. Галогенирование. У карбоновых кислот под влиянием карбоксильной группы Увеличивается подвижность атомов водорода, стоящих при атоме
- 21. 10. Восстановление и каталитическое гидрирование (с большим трудом). СH3COOH+ H2 → СH3CH=O+ H2O kat,tº этаналь СH3CH=O
- 22. Применение Муравьиная кислота – в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов;
- 23. Масляная кислота – для получения ароматизирующих добавок, пластификато- ров и флотореагентов. Щавелевая кислота – в металлургической
- 24. Источники информации 1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./ Под ред.
- 26. Скачать презентацию




















 Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине
Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине Определение валентности элементов
Определение валентности элементов V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Альдегидтер және кетондар
Альдегидтер және кетондар Кристаллические решетки
Кристаллические решетки Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Теоретические основы органической химии
Теоретические основы органической химии Железо и его соединения.
Железо и его соединения. Beryllium. The physical properties of beryllium
Beryllium. The physical properties of beryllium Физический процесс и химическая реакция.
Физический процесс и химическая реакция. Общая и неорганическая химия
Общая и неорганическая химия Химические свойства алканов
Химические свойства алканов Расчёт равновесного состава
Расчёт равновесного состава Викторина. Дмитрий Иванович Менделеев
Викторина. Дмитрий Иванович Менделеев Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары
Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары Уран. Получение урана
Уран. Получение урана Значение основных химических элементов в жизни человека
Значение основных химических элементов в жизни человека Сведения о воде
Сведения о воде Речь без пословицы - всё равно что еда без соли Речь без пословицы - всё равно что еда без соли · Пуд соли съешь, прежде чем познаешь человека · &nbs
Речь без пословицы - всё равно что еда без соли Речь без пословицы - всё равно что еда без соли · Пуд соли съешь, прежде чем познаешь человека · &nbs Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Имеет ли вода форму
Имеет ли вода форму Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Олово и свинец. (Лекция 2)
Олово и свинец. (Лекция 2) Кислород. Получение кислорода и его физические свойства
Кислород. Получение кислорода и его физические свойства