Содержание
- 2. Вспомните ! Что изучает химия? Химия – наука о веществах, их свойствах и превращениях. В чём
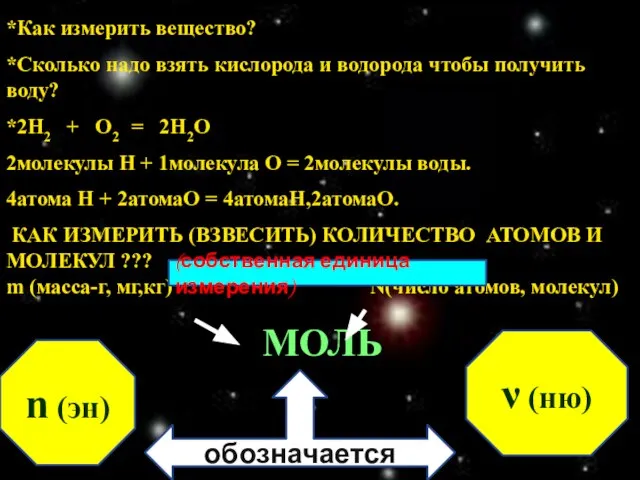
- 3. *Как измерить вещество? *Сколько надо взять кислорода и водорода чтобы получить воду? *2Н2 + О2 =
- 4. Ar(Fe)=56 Мr (O2 )=32 Мr (H2O)= 18 1моль ВЫВОД: МАССА 1 МОЛЯ ВЕЩЕСТВА численно равна атомной
- 5. Вопрос: что нужно сделать, чтобы отмерить один моль вещества? Ответ: Взять столько граммов этого вещества, какова
- 6. Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ и измеряется в г/моль, обозначается М Отсюда:1 моль в-ва=
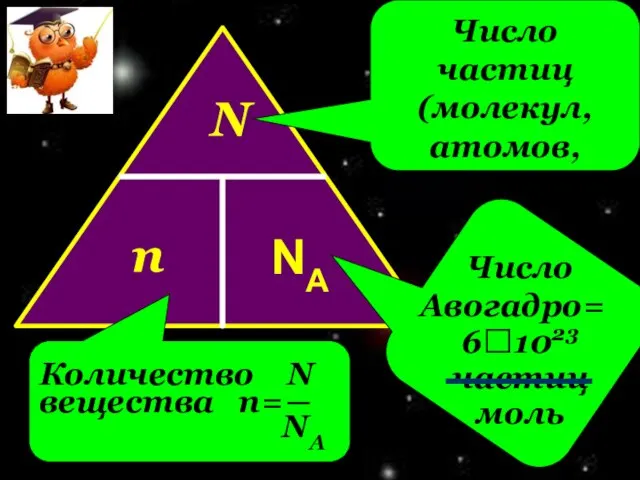
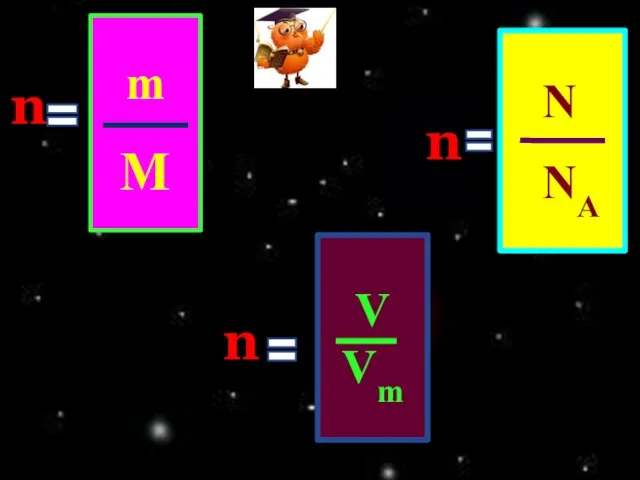
- 7. m n M Масса порции вещества m=n∙M Молярная масса[M]= молекулярной массе [Mr] Количество m вещества n=―
- 8. Если брать столько граммов вещества, какова его относительная молекулярная масса, сколько же там будет содержаться молекул?
- 10. Оказалось… NA= 6. 10 23 (Число Авогадро) Вывод: 1моль любого вещества содержит число частиц (атомов, молекул,
- 11. N n NA Число частиц(молекул,атомов,ионов) Число Авогадро= 6?1023 частиц моль Количество N вещества n=― NA
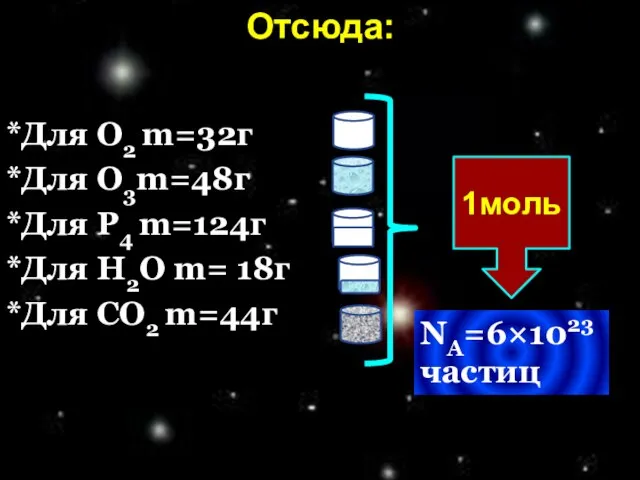
- 12. Отсюда: 1моль NА=6×1023 частиц *Для О2 m=32г *Для О3m=48г *Для Р4 m=124г *Для Н2О m= 18г
- 13. Сколько молекул кислорода содержится в 1,25моль? N=NA.n N(O2)=6?1023молекул?1,25моль моль =7,5?1023 молекул
- 14. 1 м о л ь CO2 N2 Fe H2O O2 m=56г m=18г m=32г m=44г m=28г V-?
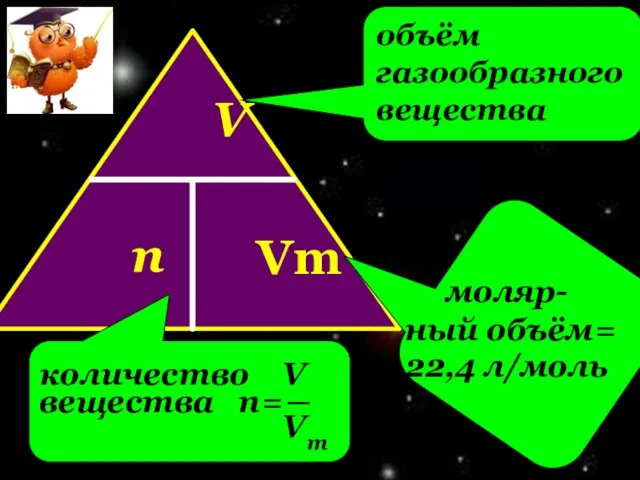
- 15. V n Vm объём газообразного вещества моляр- ный объём= 22,4 л/моль количество V вещества n=― Vm
- 16. Для расчета количества вещества необходимо использовать следующие формулы: m n M n n NA N Vm
- 17. ᵐ M V Vm N NA n n n
- 18. VM=22,4 Л/МОЛЬ Mг/моль = Mr NA = 6 ×1023 частиц/моль
- 20. Скачать презентацию




![m n M Масса порции вещества m=n∙M Молярная масса[M]= молекулярной массе](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/512508/slide-6.jpg)







 Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Бензол: строение и свойства
Бензол: строение и свойства Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Йод
Йод Области применения спиртов
Области применения спиртов Гетероциклические соединения
Гетероциклические соединения Нечаев 18
Нечаев 18 Буровые растворы на углеродной основе
Буровые растворы на углеродной основе Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно
Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Пены. Свойства пен
Пены. Свойства пен Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Накопление химических знаний в доисторические времена
Накопление химических знаний в доисторические времена Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть
Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть  Кислород. 8 класс
Кислород. 8 класс Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров Алюминий и его сплавы. Назначение
Алюминий и его сплавы. Назначение Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Методи одержання нанодисперсних порошкових матеріалів
Методи одержання нанодисперсних порошкових матеріалів Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер
Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер Природный и искусственный каучук
Природный и искусственный каучук Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Поліаміди
Поліаміди Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016