Содержание
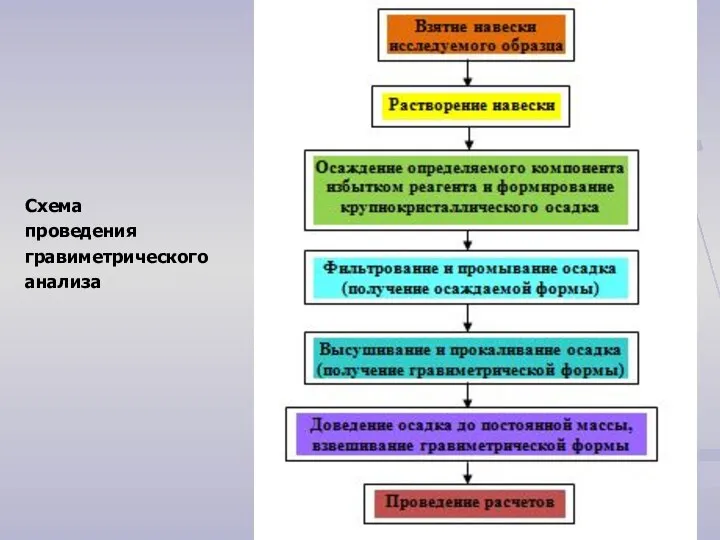
- 3. Схема проведения гравиметрического анализа
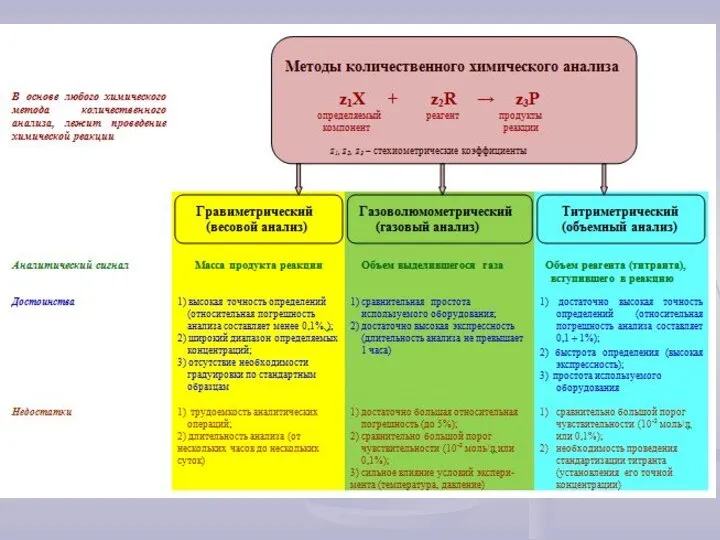
- 4. Титриметрические методы Основы титриметрических методов z1Х + z2R → z3Р Для использования в титриметрическом анализе, химические
- 6. Титриметрический метод анализа (титриметрия) основан на измерении объема титранта, пошедшего на реакцию с определяемым веществом. В
- 7. Закон эквивалентов или эквивалентных соотношений Для фиксирования ТЭ применяют индикаторы. Индикаторы – это вещества, которые резко
- 8. Таблица 4.1 - Типы индикаторов
- 9. Свойства индикаторов KInd Ind1 ↔ х + Ind2 окраска 1 окраска 2 прологарифмируем и заменим (–lg)
- 10. Основные расчетные формулы титриметрии Расчеты титриметрических определений основаны на использовании закона эквивалентов или эквивалентных соотношений: Данное
- 11. Закон эквивалентов можно выразить и через массу определяемого вещества: Решив последнее выражение относительно m(X), получим вторую
- 13. Метод кислотно-основного титрования Протолитические равновесия Современные представления о кислотах и основаниях: 1. Теория Аррениуса была создана
- 14. Применительно к аналитической химии удобнее всего использовать теорию Брнстеда-Лоури. Обозначим кислоту, способную отдавать протон, как НА,
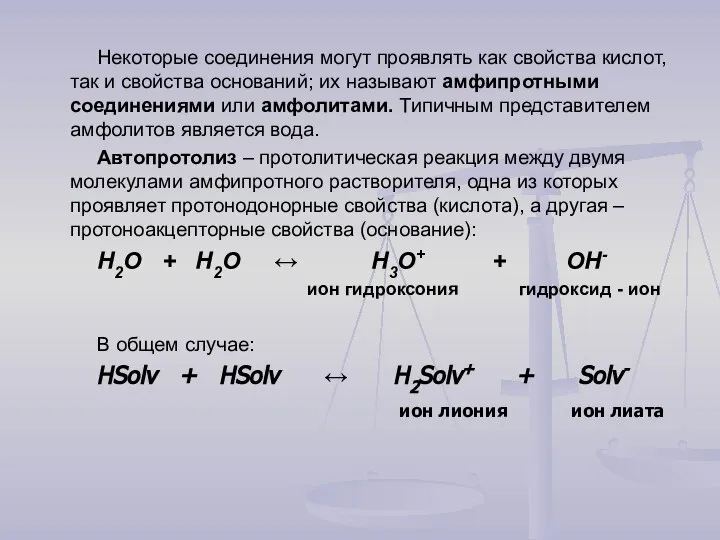
- 15. Некоторые соединения могут проявлять как свойства кислот, так и свойства оснований; их называют амфипротными соединениями или
- 16. Выражение для константы равновесия автопротолиза воды или При постоянной температуре в воде , поэтому произведение тоже
- 17. Из значения KW получим, что при 25оС в водном растворе [Н+] = [ОН-]= 10-7 моль/л (среда
- 18. Кислоты (НА) и основания (ВОН) в водных растворах способны диссоциировать на ионы: НА + Н2О ↔
- 19. рKа (рKв) – показатель силы кислоты (основания): чем больше рKа (рKв), тем слабее кислота (основание). Между
- 20. Вычисление рН растворов сильных кислот и оснований В водном растворе сильной кислоты имеет место равновесие :
- 21. Вычисление рН растворов слабых кислот и оснований Пусть НА – слабая кислота, которая диссоциирует в водном
- 22. При отрицательном логарифмировании выражения получим уравнение для вычисления рН в растворах слабых кислот: , откуда Проведя
- 24. Скачать презентацию












![Из значения KW получим, что при 25оС в водном растворе [Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1406026/slide-16.jpg)





 Способы очистки воды в быту
Способы очистки воды в быту Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Кадмий
Кадмий Предмет химии. Вещества
Предмет химии. Вещества Гомологи бензола
Гомологи бензола Презентация Жидкие кристаллы
Презентация Жидкие кристаллы  Виды химической связи в неорганических веществах Урок-повторение
Виды химической связи в неорганических веществах Урок-повторение Methods for processing of liquid waste
Methods for processing of liquid waste Бром және оның қасиеттері
Бром және оның қасиеттері Узинская ООШ исслед.работа Лобановой Елизаветы
Узинская ООШ исслед.работа Лобановой Елизаветы ФКХ-Л2 2016
ФКХ-Л2 2016 Типы химических реакций в органической химии
Типы химических реакций в органической химии Фосфор
Фосфор Хімія в побуті
Хімія в побуті Химические свойства алкенов (10 класс) Автор: Воложанина Л. Е., учитель химии
Химические свойства алкенов (10 класс) Автор: Воложанина Л. Е., учитель химии Этиленовые, олефины, непредельные алкены
Этиленовые, олефины, непредельные алкены Люминесцентный анализ
Люминесцентный анализ Взаимосвязь между классами неорганических веществ
Взаимосвязь между классами неорганических веществ Щавелевая кислота. Этандиовая кислота. Этандикислота
Щавелевая кислота. Этандиовая кислота. Этандикислота Углеводы. Аэробный обмен. Глюконеогенез. Биосинтез глюкозаминогликанов. Механизмы регуляции уровня глюкозы в крови. (Тема 3)
Углеводы. Аэробный обмен. Глюконеогенез. Биосинтез глюкозаминогликанов. Механизмы регуляции уровня глюкозы в крови. (Тема 3) Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды ВИТАМИН В12 Сергеев Никита 10A
ВИТАМИН В12 Сергеев Никита 10A  Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах
Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах Метаболизм липидов
Метаболизм липидов Химия в косметике
Химия в косметике Нефть, состав, свойства, переработка
Нефть, состав, свойства, переработка Soluţiile sunt amestecuri omogene de două sau mai multe substanţe
Soluţiile sunt amestecuri omogene de două sau mai multe substanţe Минералы и горные породы
Минералы и горные породы