Содержание
- 2. Литература: 1. Лившиц Б.Г. Металлография. М.: Металлургия, 1971 или 1990. 2. Лахтин Ю.М. Металловедение и термическая
- 3. Павел Петрович Аносов П.П. Аносовым впервые было введено в практику и распространено понятие о макроструктуре как
- 4. Дмитрий Константинович Чернов [20. 10(1.11). 1839, Петербург, - 2.1.1921, Ялта], русский учёный в области металлургии, металловедения,
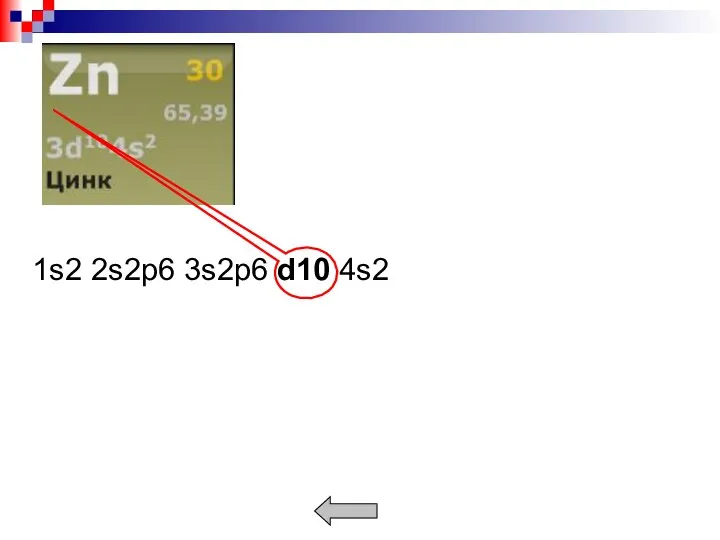
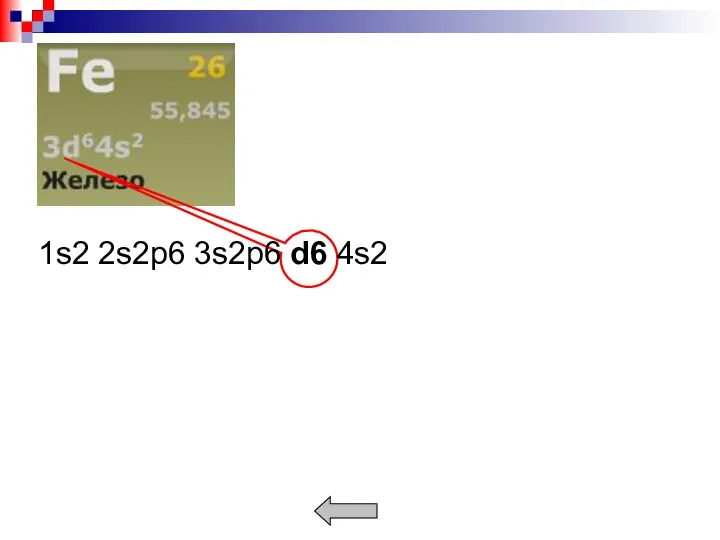
- 5. Простые – металлы с полностью заполненными или полностью незаполненными электронами d- и f- оболочки. Пример. Переходные
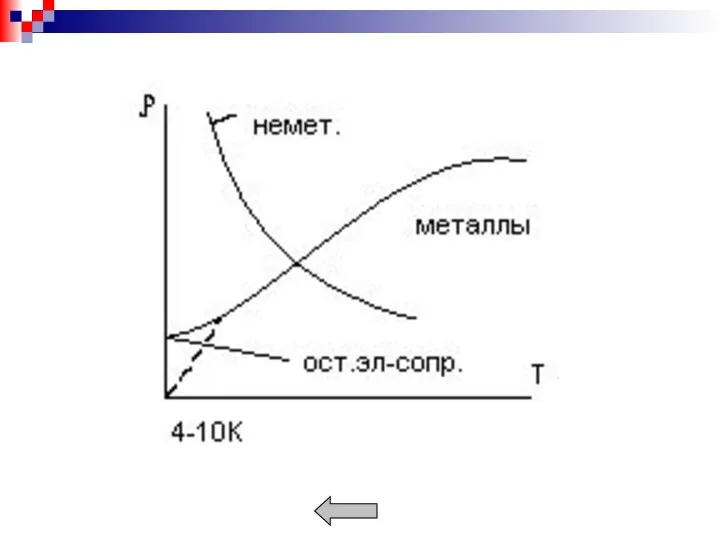
- 6. Металлы обладают рядом характерных свойств: - высокой тепло- и электропроводностью; - положительным температурным коэффициентом электро-сопротивления; -
- 7. Металл можно рассматривать как коллектив положительных ионов, находящихся в среде свободных электронов. Взаимодействие между положительными ионами
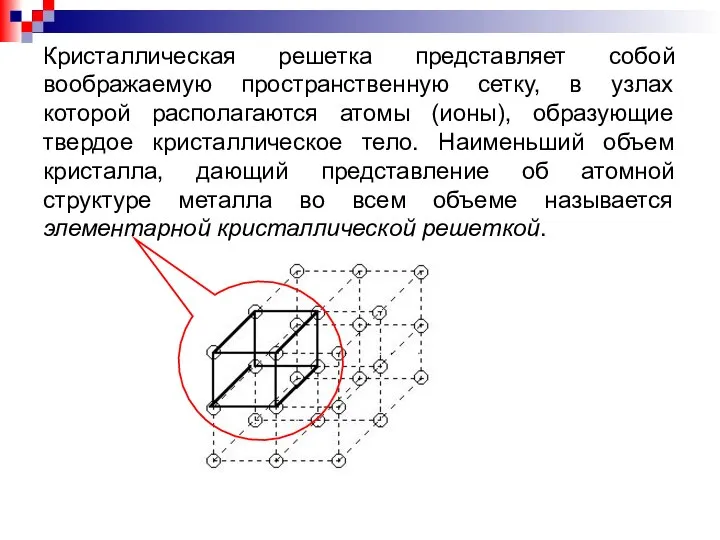
- 8. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие твердое кристаллическое
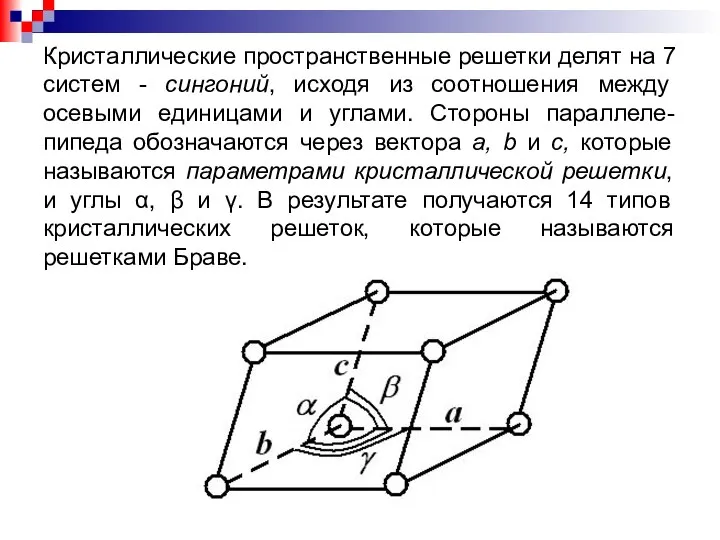
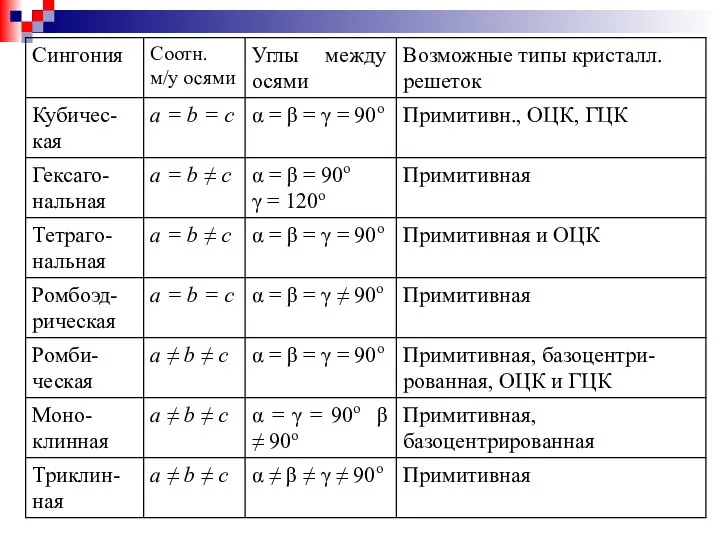
- 9. Кристаллические пространственные решетки делят на 7 систем - сингоний, исходя из соотношения между осевыми единицами и
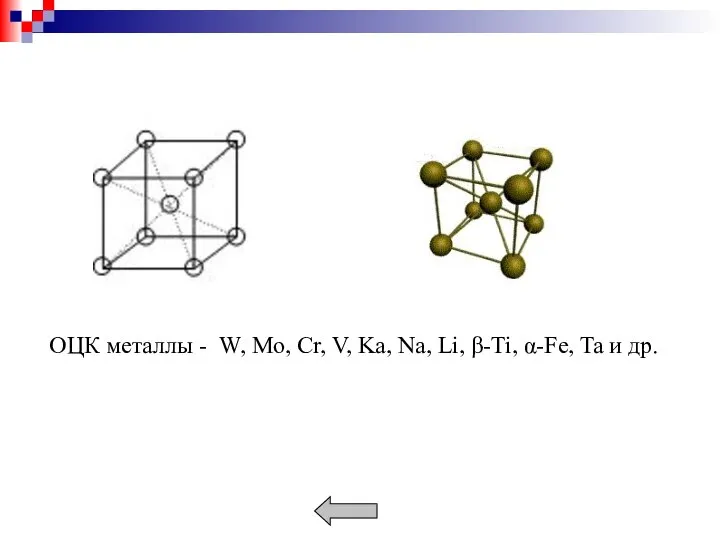
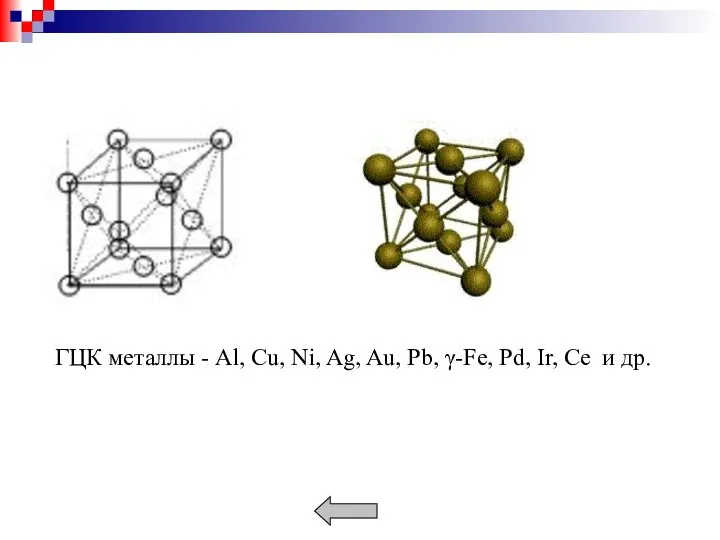
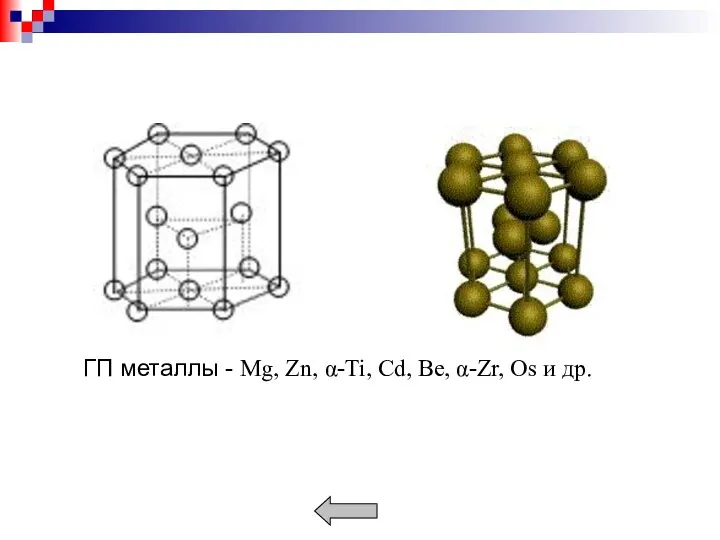
- 11. Металлы образуют кристаллические решетки: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК), гексагональную (ГП). Плотность кристаллической решетки характеризуется
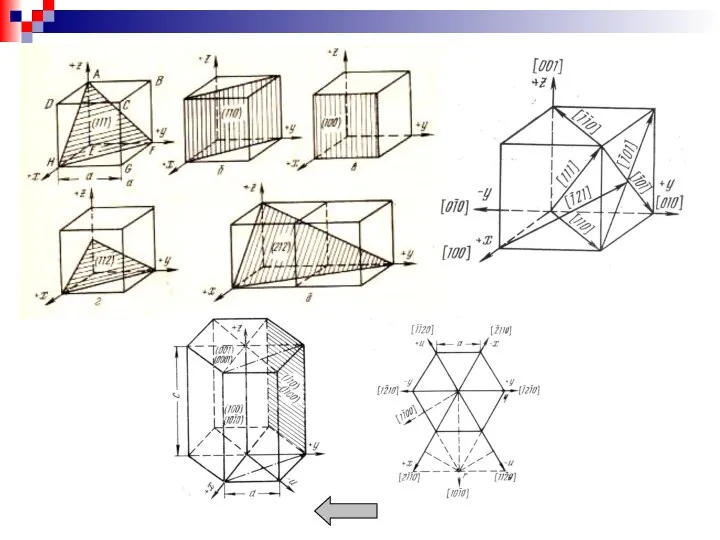
- 12. Для обозначения плоскостей пространственной решетки кристалла используют индексы Миллера. Порядок определения индексов для данной плоскости: 1.
- 13. Наиболее плотноупакованными плоскостями для ОЦК решетки является (110), для ГЦК (111) и для ГП решетки (0001).
- 14. Конец лекции
- 23. Скачать презентацию


![Дмитрий Константинович Чернов [20. 10(1.11). 1839, Петербург, - 2.1.1921, Ялта], русский](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396004/slide-3.jpg)







 Презентация по Химии "Виды газовых разрядов" - скачать смотреть
Презентация по Химии "Виды газовых разрядов" - скачать смотреть  Агрегатные состояния вещества. Водородная химическая связь
Агрегатные состояния вещества. Водородная химическая связь Типы ингибирования и их характерные черты
Типы ингибирования и их характерные черты Характеристика дефектов. Растворы влияющие на степень износа тканей
Характеристика дефектов. Растворы влияющие на степень износа тканей Художественное и технологическое
Художественное и технологическое Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Фепромарон. Химическое название
Фепромарон. Химическое название Решение задач Скорость химических реакций 11 класс
Решение задач Скорость химических реакций 11 класс  Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Нітрати – токсичні речовини
Нітрати – токсичні речовини Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс)
Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс) Производные пурина
Производные пурина Порцеляна. Фаянс
Порцеляна. Фаянс Классификация химических реакций
Классификация химических реакций «Уксусная кислота»
«Уксусная кислота»  Геохимия урана и тория в карбонатитовом процессе
Геохимия урана и тория в карбонатитовом процессе Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Презентация по Химии "Мило" - скачать смотреть бесплатно
Презентация по Химии "Мило" - скачать смотреть бесплатно Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть
Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть  Превращения веществ
Превращения веществ Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары
Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Алюминий
Алюминий Brass
Brass Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія
Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія  Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике