Содержание
- 2. § 5,6. Составить конспект по плану Где в периодической системе расположены металлы? Особенности строения атомов металлов.
- 3. Положение металлов в периодической системе химических элементов Д.И.Менделеева Из 114 химических элементов 92 относятся к металлам
- 4. Особенности строения атомов металлов 11 Na 20 Са 26 Fe 2е 8е 1е 2е 8е 8е
- 5. Изменение свойств в ПСХЭ Д.И. Менделеева Число электронов на внешнем слое не изменяется Радиус атома увеличивается
- 6. Изменение свойств в ПСХЭ Д.И. Менделеева В периоде: Заряды ядер увеличиваются Радиусы атомов уменьшаются Число электронов
- 7. Na+ Механизм образования металлической связи Na Na Na Na Na Na Na Na Na Na+ Na+
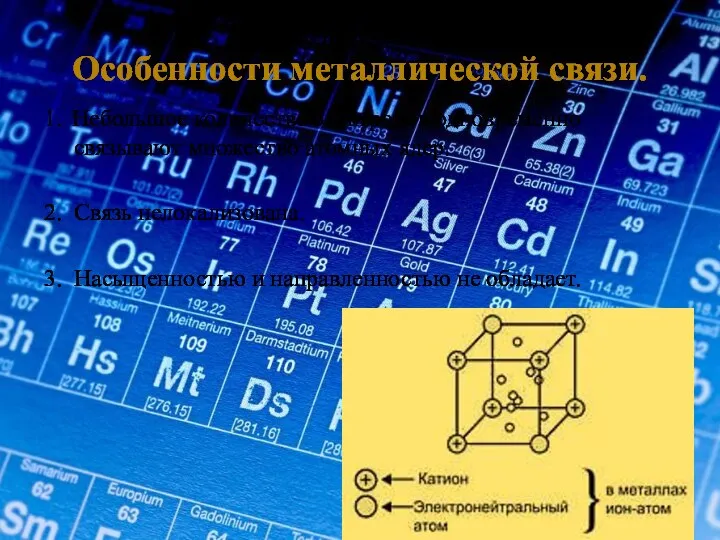
- 8. Особенности металлической связи. 1. Небольшое количество электронов одновременно связывают множество атомных ядер. 2. Связь нелокализована. 3.
- 9. Физические свойства металлов Физические свойства металлов определяются их строением. Металлический блеск Электро- и теплопроводность Пластичность Плотность
- 10. Металлический блеск (хорошо отражают световые лучи) Самые блестящие металлы – Hg, Ag, Pd.
- 11. Электро- и теплопроводность объясняются особым строением кристаллической решетки (свободные электроны – «электронный газ») Наибольшую электро- и
- 12. Пластичность - это свойство вещества менять форму под внешним воздействием и сохранять принятую форму после прекращения
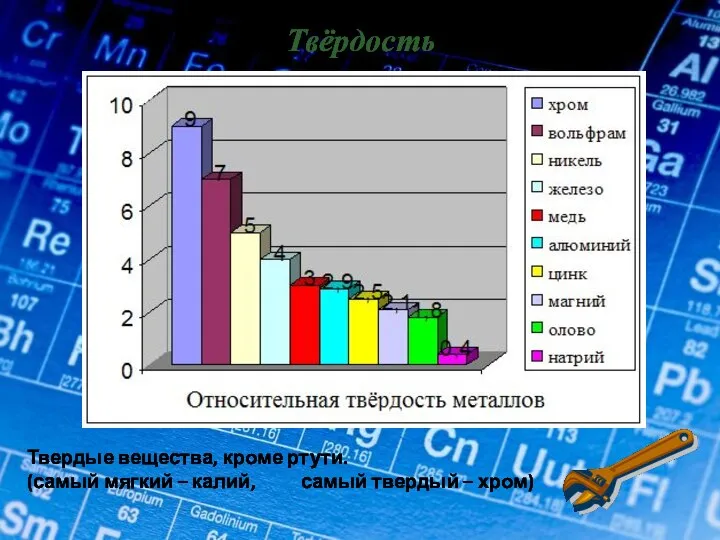
- 13. Твёрдость Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)
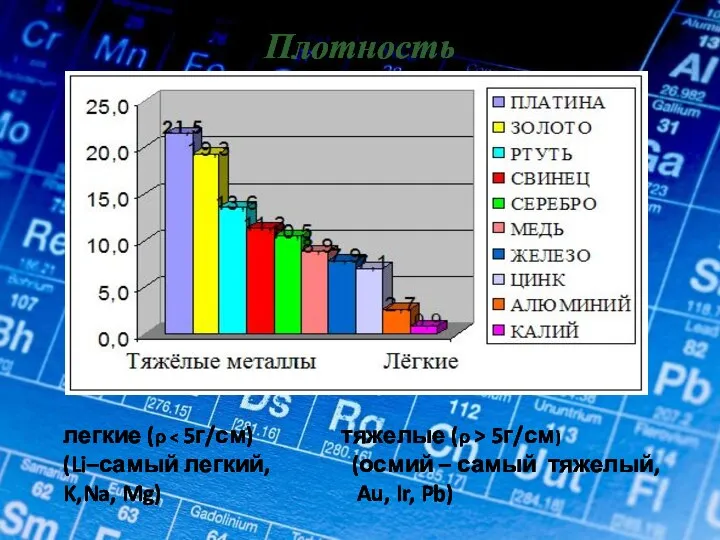
- 14. Плотность легкие (ρ 5г/см) (Li–самый легкий, (осмий – самый тяжелый, K,Na, Mg) Au, Ir, Pb)
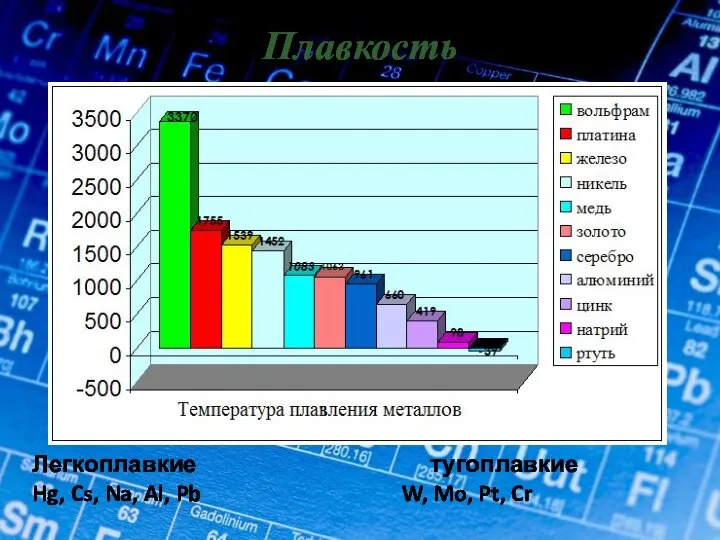
- 15. Плавкость Легкоплавкие тугоплавкие Hg, Cs, Na, Al, Pb W, Mo, Pt, Cr
- 16. Металлы – простые вещества. В атомах металлов на внешнем энергетическом уровне: Малое количество электронов. Очень большой
- 17. Химические свойства простых веществ - металлов Me0 + Вос-ль НеМе O2 H2O Me/O кислота соль Cоль
- 18. 4Al + 3O2 → 2Al2O3
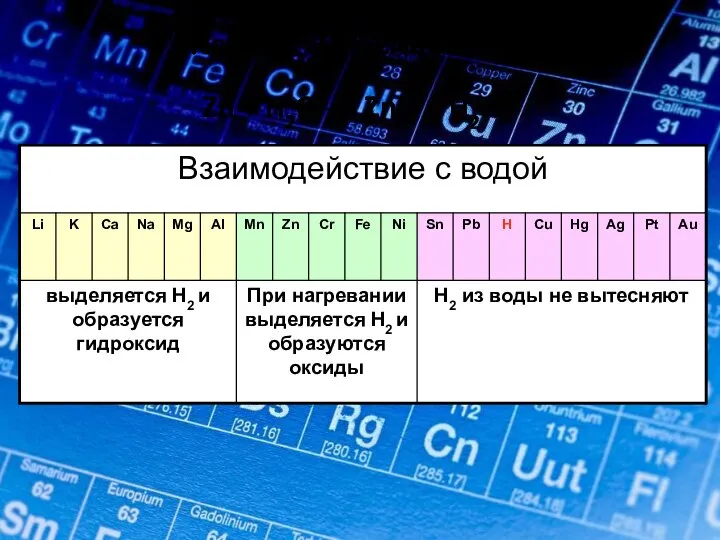
- 19. 2Na + 2H2O → 2NaOH + H2
- 20. CuSO4 + Fe → Cu + FeSO4
- 21. 2Al + 6HCl → 2AlCl3 + 3H2 Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
- 24. Скачать презентацию
















 Фтор (Fluorum), F
Фтор (Fluorum), F Введение. Основные понятия химии
Введение. Основные понятия химии Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій
Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій  Интеллектуальная викторина по химии для учащихся 8-9 классов
Интеллектуальная викторина по химии для учащихся 8-9 классов Хімічні явища в природі
Хімічні явища в природі Алканы
Алканы Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация Лекарства дома
Презентация Лекарства дома Липиды. Строение, свойства, функции. (Лекция 6)
Липиды. Строение, свойства, функции. (Лекция 6) Свойства живого вещества
Свойства живого вещества Применение нитратов
Применение нитратов  Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Исторические аспекты возникновения и развития. Теории химического строения
Исторические аспекты возникновения и развития. Теории химического строения Химия в косметике
Химия в косметике Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2)
Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2) “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Геологические условия формирования месторождений полезных ископаемых. (Лекция 3)
Геологические условия формирования месторождений полезных ископаемых. (Лекция 3) Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Геохимия техногенеза
Геохимия техногенеза Кристаллическая решетка
Кристаллическая решетка Сера
Сера Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Комбинированные задачи. 11 класс. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  ЕГЭ по химии Технология подготовки учащихся
ЕГЭ по химии Технология подготовки учащихся педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого
педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого Методы определения подлинности лекарственного растительного сырья
Методы определения подлинности лекарственного растительного сырья Алканы. Получение и применение алканов
Алканы. Получение и применение алканов Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Оксиды: получение, свойства, применение
Оксиды: получение, свойства, применение