Содержание
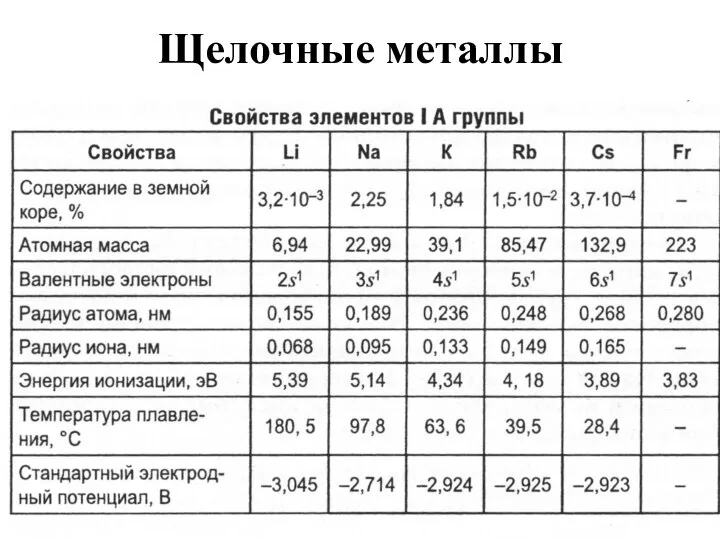
- 4. Щелочные металлы
- 5. Нахождение в природе Na2O·Al2O3·6SiO2 - натриевый полевой шпат, K2O·Al2O3·6SiO2 – калиевый полевой шпат, NaCl- галинит или
- 6. Получение щелочных металлов Кальцийтермия в вакууме c последующей отгонкой легкоплавких металлов: 2CsCl+Ca→tCaCl2+2Cs 2RbCl+Ca→tCaCl2+2Rb Электролиз расплавов: 1)
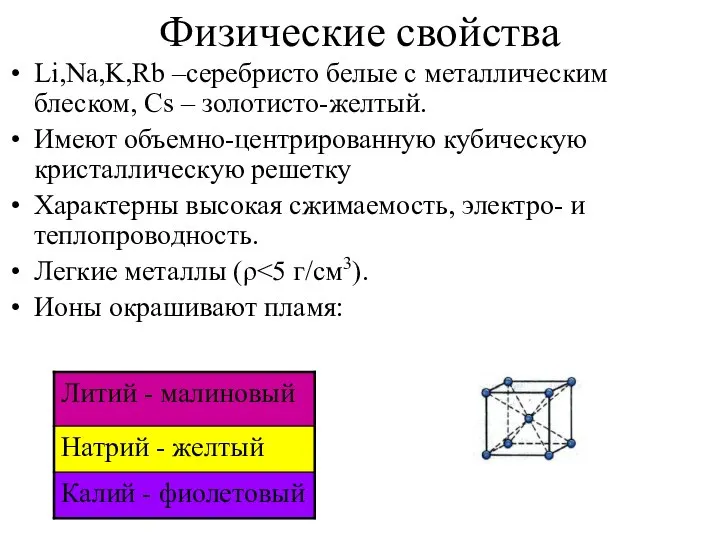
- 7. Физические свойства Li,Na,K,Rb –серебристо белые с металлическим блеском, Cs – золотисто-желтый. Имеют объемно-центрированную кубическую кристаллическую решетку
- 8. Химические свойства ЩМ + О2 → оксиды: 4Li+O2=2Li2O, пероксиды: 2Na+O2=Na2O2 надпереоксиды: Rb+O2=RbO2 Оксиды с H2O→гидроксиды: K2O+H2O=2KOH
- 9. Ме + Н2О → гидроксиды: 2Cs+2H2O=2CsOH+H2↑ (реакция со взрывом) + галогены (1), + халькогалогены (2), +
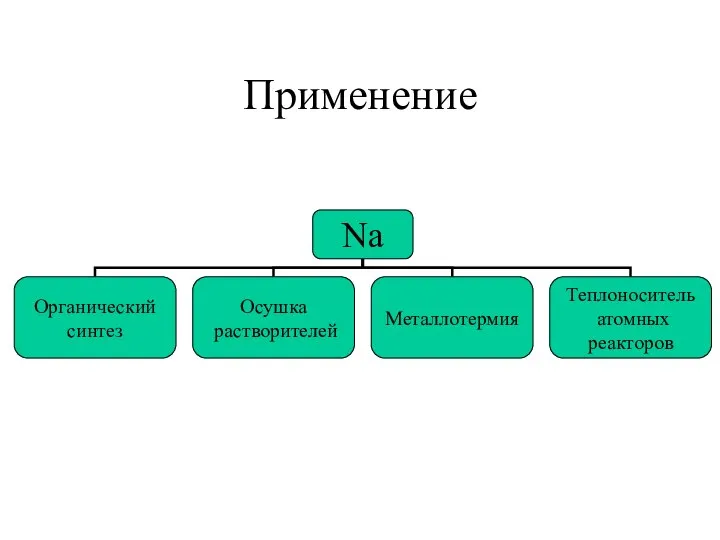
- 10. Применение
- 11. Применение Kалий 1.Металлотермия 2. Получение KO2 (используется для поглощения СО2 и регенерации кислорода в подлодках и
- 12. Применение соединений ЩМ NaCl – в пище, консервировании, производстве мыла, органических красителей. NaOH – в производстве
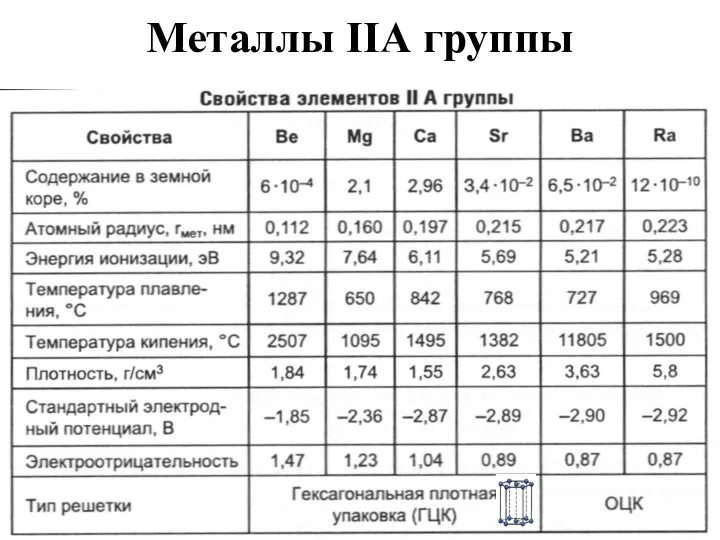
- 13. Металлы IIА группы
- 14. Нахождение в природе Be3Al2(SiO3)6 – берилл (изумруды, аквамарины). MgCO3 – магнезит. MgCO3·CaCO3 – доломит. 3MgO·4SiO2·H2O –
- 15. Получение Be – магнийтермией из фторидов: Mg+BeF2=MgF2+Be Mg и Ca – электролизом расплава смесей: MgCl2+KCl; CaCl2+KCl+CaF2.
- 16. Химические свойства металлов IIА группы Все - сильные восстановители. Ca(Ba,Sr)+H2=t CaH2 (BaH2,SrH2) Ca (Sr,Ba)+O2=CaO (BaO, SrO)(на
- 17. Химические свойства соединений Гидриды Be и Mg твердые в-ва, при слабом нагревании разлагаются: BeH2=tBe+H2. Получаются косвенным
- 18. Химические свойства оксидов Получение в лаборатории и промышленности: 1)CaCO3=t CaO+CO2, 2)Mg(OH)2=t MgO+H2O. BeO – амфотер: 1)
- 19. Получение и свойства пероксидов При нагревании оксидов с избытком О2 (1) или действием Н2О2 на гидроксиды
- 20. Свойства гидроксидов Be(OH)2 – амфотерное основание: Be(OH)2+2HNO3=Be(NO3)2+2H2O, Be(OH)2+2NaOH=Na2[Be(OH)4]. Mg(OH)2 – основание средней силы. Ca(OH)2,Ba(OH)2,Sr(OH)2– щелочи, проявляют
- 21. Получение и свойства солей Карбонаты MgCO3 и CaСО3 с CO2 и Н2О дают растворимые гидрокарбонаты: CaCO3+CO2+H2O=Ca(HCO3)2
- 22. Жесткость воды и ее устранение Жесткость воды обусловлена содержанием Ca2+, Mg2+. Временная: Ca(HCO3)2, Mg(HCO3)2 -разрушаются при
- 25. Скачать презентацию












![Свойства гидроксидов Be(OH)2 – амфотерное основание: Be(OH)2+2HNO3=Be(NO3)2+2H2O, Be(OH)2+2NaOH=Na2[Be(OH)4]. Mg(OH)2 – основание](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/670541/slide-19.jpg)



 Аттестационная работа. Музей минералов и горных пород
Аттестационная работа. Музей минералов и горных пород Классификация металлов
Классификация металлов Презентация по Химии "Разнообразие кристаллов и их выращивание" - скачать смотреть
Презентация по Химии "Разнообразие кристаллов и их выращивание" - скачать смотреть  Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Полимеры, пластмассы и изделия из них
Полимеры, пластмассы и изделия из них Адам мен жануар организміне бордың әсері
Адам мен жануар организміне бордың әсері Попова Ольга Викторовна учитель химии ГБОУ школа 634 города Санкт-Петербург «Мониторинг продуктов питания»
Попова Ольга Викторовна учитель химии ГБОУ школа 634 города Санкт-Петербург «Мониторинг продуктов питания» π-комплексы металлов. Природа связи металлуглерод в π-комплексах металлов. Отличия в свойствах от обычной σ-связи
π-комплексы металлов. Природа связи металлуглерод в π-комплексах металлов. Отличия в свойствах от обычной σ-связи Техника безопасности для учащихся в кабинете химии.
Техника безопасности для учащихся в кабинете химии.  Полиэтилентерефталат. Свойства. Получение
Полиэтилентерефталат. Свойства. Получение Химический элемент кремний
Химический элемент кремний Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Тема урока : Скорость химической реакции
Тема урока : Скорость химической реакции  Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер
Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер Вакуумная перегонка мазута
Вакуумная перегонка мазута Сера, сероводород, сульфиды
Сера, сероводород, сульфиды Способы перегонки
Способы перегонки Углеводороды. Структура и функции биолекул
Углеводороды. Структура и функции биолекул Перегонки (ректификация)
Перегонки (ректификация) Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Альтернативная бытовая химия
Альтернативная бытовая химия Аминокислоты. Белки
Аминокислоты. Белки Электролитическая диссоциация
Электролитическая диссоциация Водородная, ионная, донорно-акцепторная химические связи
Водородная, ионная, донорно-акцепторная химические связи Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Кто ты и откуда химия? Химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное. ...Не сомневаюсь, что най
Кто ты и откуда химия? Химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное. ...Не сомневаюсь, что най Функциональные наноматериалы. (Лекция 1)
Функциональные наноматериалы. (Лекция 1)