Содержание
- 2. 1. Проработайте теоретический материал параграфа № 87,88 совместно с презентацией. 2. Весь теоретический материал с примерами
- 3. https://www.youtube.com/watch?v=ufzUXo-plVU – окисление глицерина перманганатом калияhttps://www.youtube.com/watch?v=krfhGuSjWjY https://www.youtube.com/watch?v=krfhGuSjWjY – получение многоатомных https://www.youtube.com/watch?v=QNigBCMHG1E – свойства многоатомных https://www.youtube.com/watch?v=Wmj1LZ962vA –
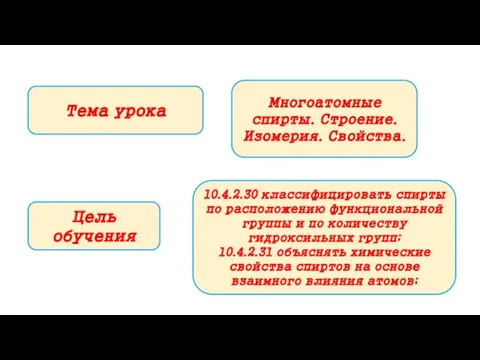
- 4. Тема урока Цель обучения 10.4.2.30 классифицировать спирты по расположению функциональной группы и по количеству гидроксильных групп;
- 5. Многоатомные спирты- содержат в составе более 1 гидроксогруппы
- 6. Виды изомерии: Положения гидроксогруппы Углеродного скелета
- 7. Номенклатура многоатомных спиртов Гептадиол – 2,4 Задание 1. Напишите структурные формулы трехатомного спирта, содержащего всего 8
- 8. Получение этиленгликоля и глицерина. Гидролизом ди – и – три галогенопроизводных алканов. Cl ─ CH2 ─
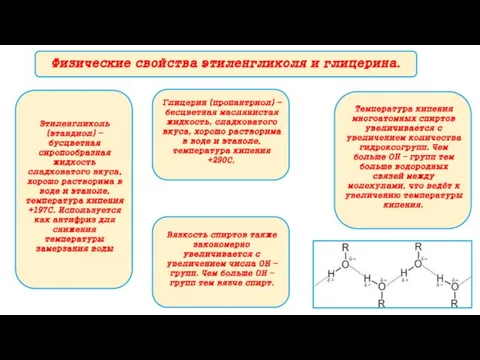
- 9. Физические свойства этиленгликоля и глицерина. Этиленгликоль (этандиол) – бусцветная сиропообразная жидкость сладковатого вкуса, хорошо растворима в
- 10. Химические свойства этиленгликоля и глицерина. Взаимодействуют с активными металлами Эти реакции доказывают кислотные свойства спиртов
- 11. Взаимодействуют с галогеноводородами В зависимости от количества галогеноводорода будут замещаться либо одна либо несколько гидроксогрупп на
- 12. Взаимодействуют с азотной кислотой СН2 ─ ОН СН2 ─ ОNO2 │ │ СН ─ ОН +
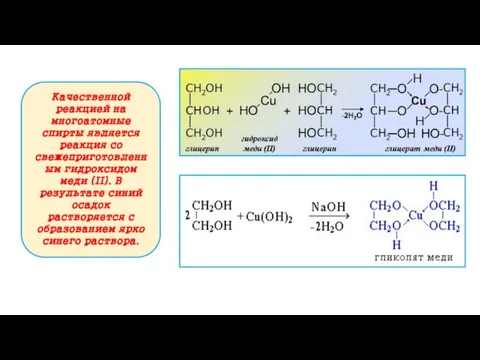
- 13. Качественной реакцией на многоатомные спирты является реакция со свежеприготовленным гидроксидом меди (II). В результате синий осадок
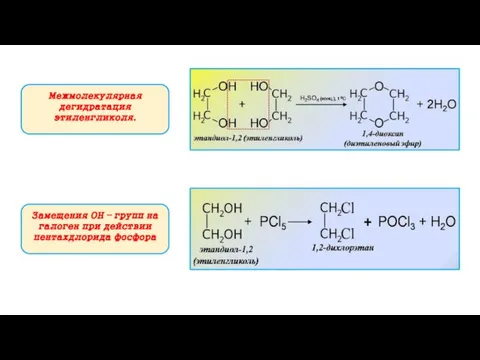
- 14. Межмолекулярная дегидратация этиленгликоля. Замещения ОН – групп на галоген при действии пентахдлорида фосфора
- 15. Реакция горения. Задание 2. Уравняйте методом электронного баланса. C3H5 (OH)3 + KMnO4 → CO2 + K2CO3
- 16. Задание 3. А) 46г глицерина полностью прореагировал с 23г натрия. Какой продукт образуется. Вычислите его массу
- 18. Скачать презентацию











 Презентация по Химии "Галогени" - скачать смотреть бесплатно
Презентация по Химии "Галогени" - скачать смотреть бесплатно Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман
Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман  Обучающий тест «Виды химической связи»
Обучающий тест «Виды химической связи» Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале Физические и химические свойства аренов
Физические и химические свойства аренов Угарный газ
Угарный газ Радиоактивность
Радиоактивность Классификация материалов
Классификация материалов Все о чае
Все о чае  Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно
Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно Увлекательная химия
Увлекательная химия Соединения галогенов
Соединения галогенов Общие способы получения металлов
Общие способы получения металлов Свойства серной кислоты и солей
Свойства серной кислоты и солей Оксиды, их свойства, получение
Оксиды, их свойства, получение Разгадай ребус
Разгадай ребус  Жевательная резинка польза или вред
Жевательная резинка польза или вред Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Урок повторения по химии за курс 8 класса
Урок повторения по химии за курс 8 класса Кислоты вокруг нас
Кислоты вокруг нас Углероды: их роль и значение в жизни человека
Углероды: их роль и значение в жизни человека Вольтамперометрия
Вольтамперометрия Краткий очерк истории развития химии
Краткий очерк истории развития химии Способы количественного определения белка
Способы количественного определения белка Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8)
Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8) Классификация высокомолекулярных соединений
Классификация высокомолекулярных соединений