Содержание
- 2. Восьмиклассник Костя зашел в магазин и попросил продавщицу продать ему 10 молей поваренной соли. Что ответила
- 3. Количество вещества. МОЛЬ. Молярная масса.
- 4. Расскажу сегодня, что ли, о зловредной роли моли. Моль съедает шерсть и мех – просто паника
- 5. Количество вещества – Физическая величина, характеризующая ещё одну сторону вещества. Измеряет число частиц, входящих в определённую
- 6. 1 моль – это такое количество любого вещества, которое содержит столько же структурных элементов, сколько атомов
- 7. Вещества количеством вещества 1 моль
- 8. Масса 1 моль вещества называется МОЛЯРНОЙ МАССОЙ – М (г/моль) = Mr
- 9. Количество вещества обозначается: «ню» или n – «эн»
- 10. Установим взаимосвязь основных величин
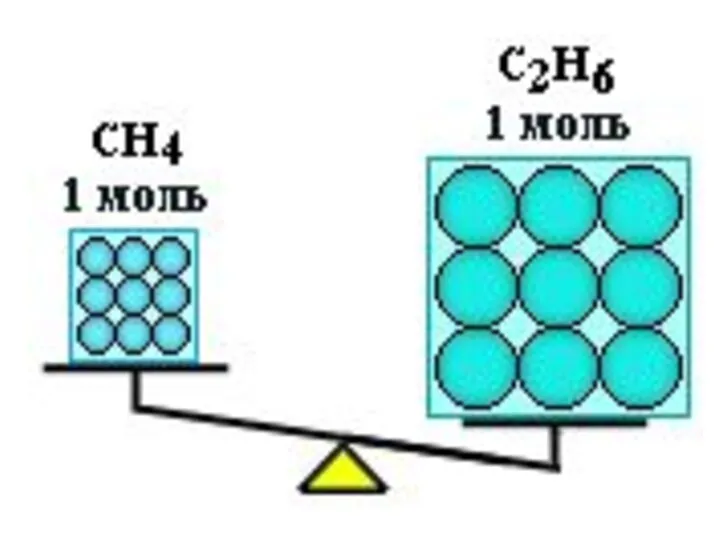
- 11. Пример Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
- 12. Попробуем ответить на вопрос, заданный вначале урока: если продавщица хорошо училась в восьмом классе, то она
- 13. Домашнее задание. §36, задания после параграфа
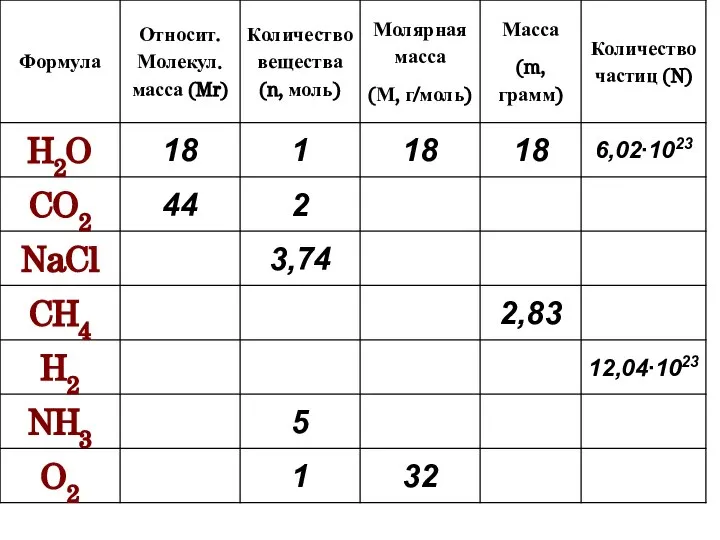
- 14. Задачи Определите массу кислорода количеством вещества 3,6 моль. Определите массу одной молекулы воды. m = M
- 16. Молярный объём газов Закон Авогадро
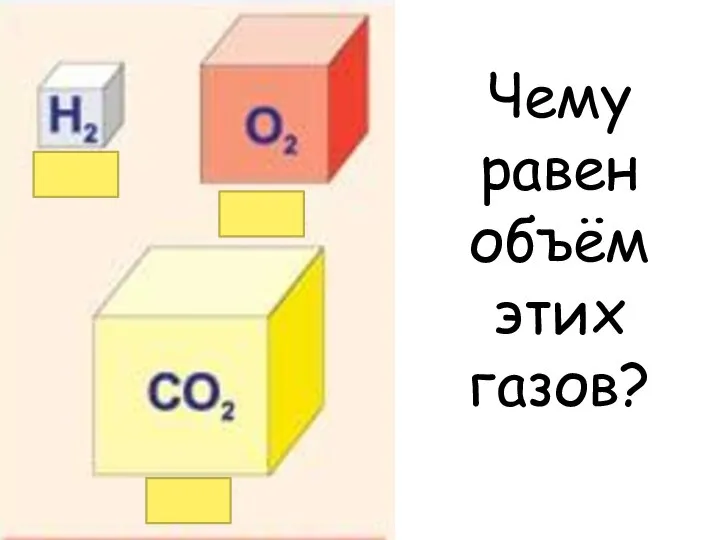
- 17. Чему равен объём этих газов?
- 19. Что такое «молярный объём»? Как обозначается? Что такое нормальные условия? Чему равен молярный объём при нормальных
- 20. Закон Авога́дро в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и
- 21. Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём. В
- 22. Количество вещества (моль)
- 23. ХЛОР Cl2 кислород O2
- 24. Закрепление N , n = ? А. 22,4 л. Б. 44,8 л. В. 112 л. Г.
- 25. Всегда 22,4 л/моль л/моль Vm Молярный объём Измеряется или рассчитывается: л, мл V Объём Расчет: моль
- 26. Решить задачи: Определить массу молекулы аммиака (NH3) Сколько молекул содержится в кислороде массой 0,16кг? Какой объём
- 28. Скачать презентацию








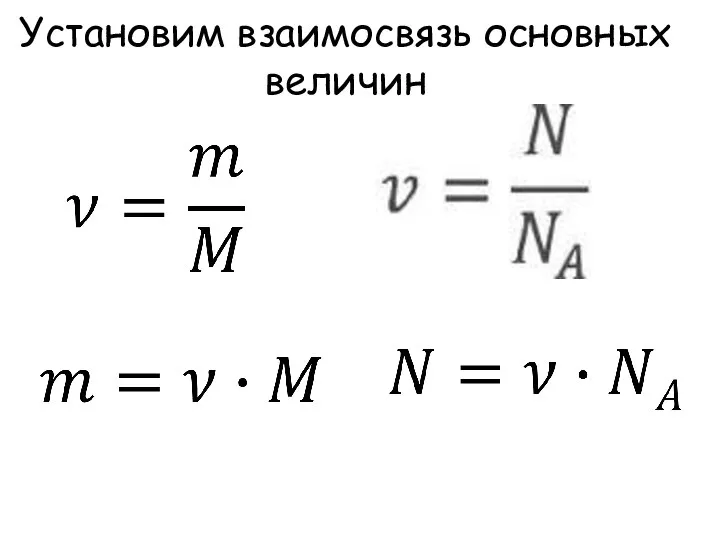








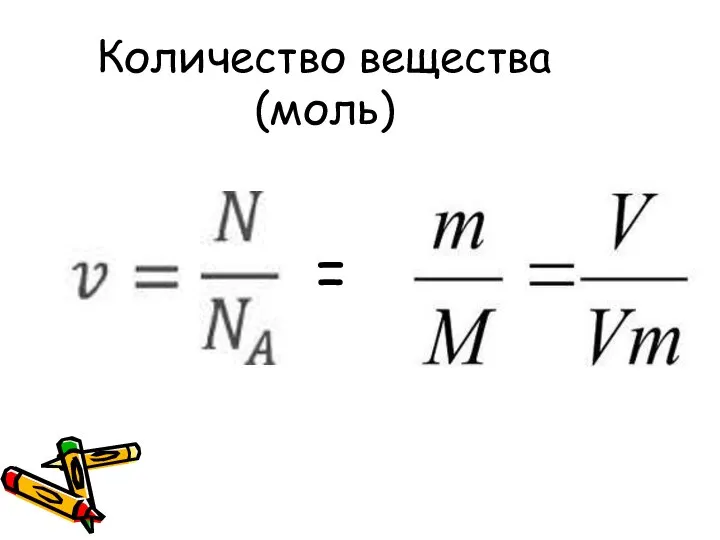




 Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Кислоты. Классификация кислот
Кислоты. Классификация кислот ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Методы защиты растений от вредителей
Методы защиты растений от вредителей Твердость минералов и их применение
Твердость минералов и их применение Современные представления о происхождении нефти и газа
Современные представления о происхождении нефти и газа Органические вещества 9 класс
Органические вещества 9 класс Элементы IV группы, побочной подгруппы периодической системы Менделеева
Элементы IV группы, побочной подгруппы периодической системы Менделеева Органические вещества
Органические вещества Молекулы. Свойства молекул
Молекулы. Свойства молекул Уравнения химической реакции 8 класс
Уравнения химической реакции 8 класс Оксид кремния
Оксид кремния Жуғыш заттар және жуғыш әсері. 1 Лекция
Жуғыш заттар және жуғыш әсері. 1 Лекция Чугуны. Структура и свойства. Классификация и применение
Чугуны. Структура и свойства. Классификация и применение Алканы. Хлороформ
Алканы. Хлороформ Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Минералы. Классификация
Минералы. Классификация Строение атома кремния
Строение атома кремния Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим
Презентация урока химии: «Металлы и их соединения» 9 класс. Учитель хим Занимательные опыты по химии
Занимательные опыты по химии Enantioselective Total Synthesis
Enantioselective Total Synthesis Углерод. 9 класс
Углерод. 9 класс Спирты
Спирты Биополимеры: естественные и искусственные
Биополимеры: естественные и искусственные Коллигативные свойства растворов
Коллигативные свойства растворов Производство аммиака
Производство аммиака