Содержание
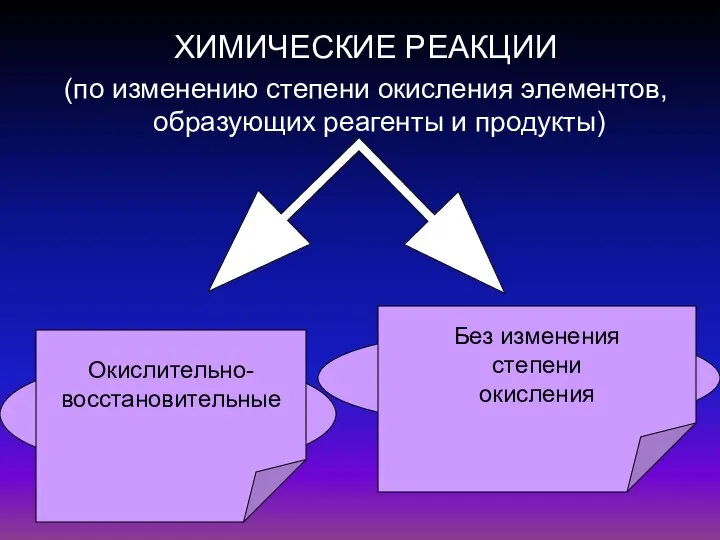
- 2. ХИМИЧЕСКИЕ РЕАКЦИИ (по изменению степени окисления элементов, образующих реагенты и продукты) +1 +5 -2 +1-1 +1
- 3. ХИМИЧЕСКИЕ РЕАКЦИИ, В РЕЗУЛЬТАТЕ КОТОРЫХ ПРОИСХОДИТ ИЗМЕНЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ ИЛИ ИОНОВ, ОБРАЗУЮЩИХ РЕАГИРУЮЩИЕ
- 4. Восстановление – процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается Cl0 +
- 5. Cl0 + 1e → Cl-1 атом хлора ион хлора Cu+2 + 2e → Cu0 ион меди
- 6. Окисление- процесс отдачи электронов атомами, ионами или молекулами. Степень окисления при этом повышается Na0 – 1e
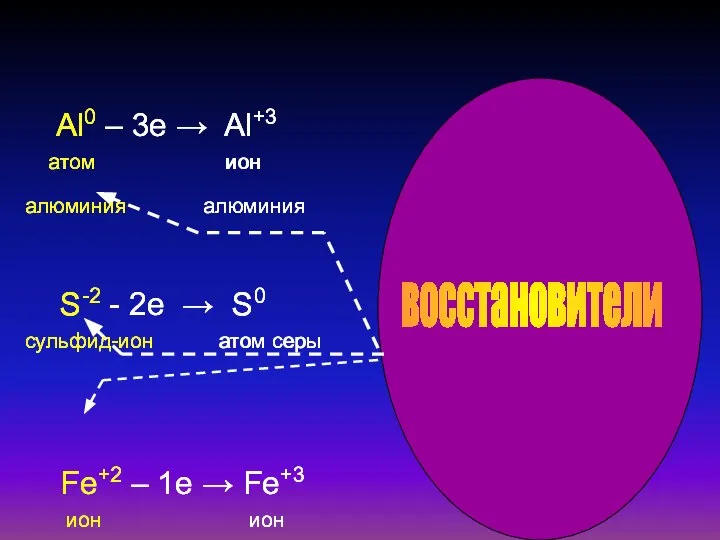
- 7. Al0 – 3e → Al+3 атом ион алюминия алюминия S-2 - 2e → S0 сульфид-ион атом
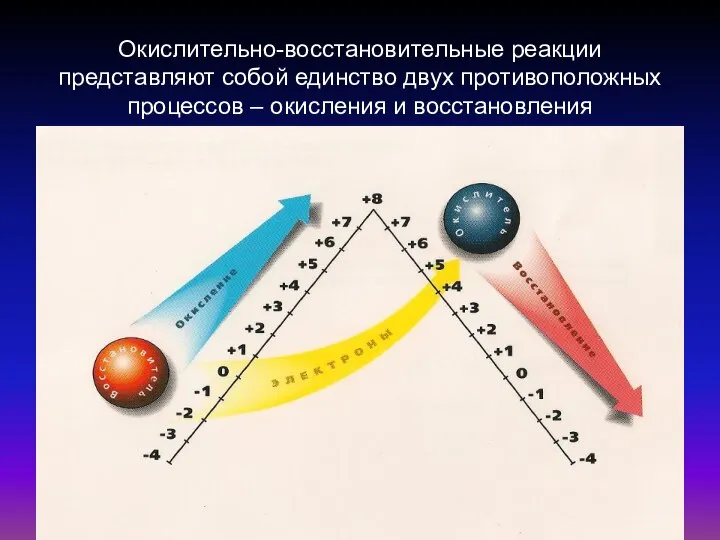
- 8. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления
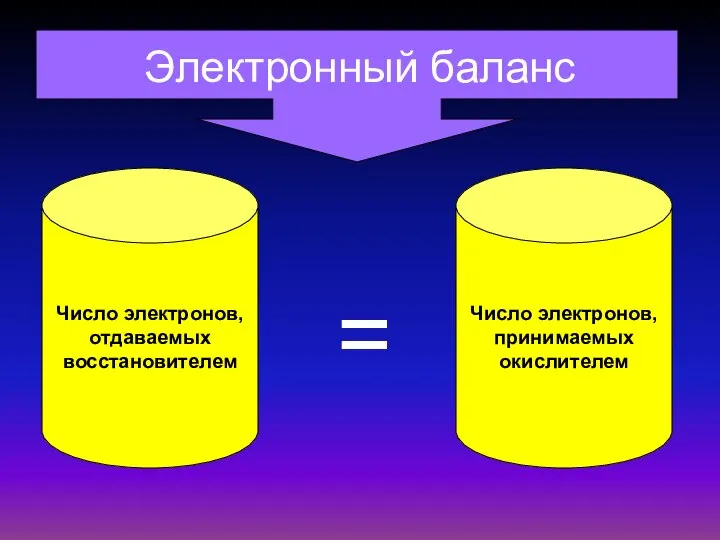
- 9. Электронный баланс = Число электронов, отдаваемых восстановителем Число электронов, принимаемых окислителем
- 10. Метод электронного баланса 1. Над символом каждого элемента напишите его степень окисления (СО) 0 -1 +5
- 11. 0 -1 +5 -2 -1 +6 -2 +4 -2 +1 -2 S + HNO3 → H2SO4
- 12. 4. Сравните число отданных и принятых электронов. Если они не равны, подберите множители к схемам процессов
- 14. Скачать презентацию







 Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно
Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно Товары бытовой химии
Товары бытовой химии Многоатомные спирты. Фенол.
Многоатомные спирты. Фенол. Биохимия печени. (Лекция 31)
Биохимия печени. (Лекция 31) Химические и физико-химические методы анализа. Сущность и методы качественного анализа
Химические и физико-химические методы анализа. Сущность и методы качественного анализа Основы химической термодинамики
Основы химической термодинамики Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, к
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, к Химический состав свежих плодов и овощей
Химический состав свежих плодов и овощей Информационные технологии в обучении химии
Информационные технологии в обучении химии Алканы и их свойства
Алканы и их свойства Коррозия металлов. Сущность процесса коррозии
Коррозия металлов. Сущность процесса коррозии Молочная кислота
Молочная кислота Драгоценный металл золото
Драгоценный металл золото Открытия в области химии во время Великой Отечественной войны
Открытия в области химии во время Великой Отечественной войны Глюкоза. Будова глюкози та її властивості
Глюкоза. Будова глюкози та її властивості Алюминий и его соединения
Алюминий и его соединения Виникнення процесу горіння. Самоспалахування. Фактори, що впливають на температуру самоспалахування. (Розділ 2.4.5)
Виникнення процесу горіння. Самоспалахування. Фактори, що впливають на температуру самоспалахування. (Розділ 2.4.5) Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть
Презентация по Химии "Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон" - скачать смотреть  Алканы. Циклоалканы
Алканы. Циклоалканы Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Про шкідливість побутової хімії
Про шкідливість побутової хімії  Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Контрольный тест
Контрольный тест Сплавы металлов
Сплавы металлов Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики