ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.
Содержание
- 2. Цели и задачи: Закрепить умения учащихся применять понятие «степень окисления» на практике. Обобщать и дополнять знания
- 3. Цели и задачи: Познакомить учащихся с сущностью метода полуреакций. Сформировать умение выражать сущность окислительно-восстановительных реакций, протекающих
- 4. Окислитель и восстановитель Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. Восстановителем называют реагент,
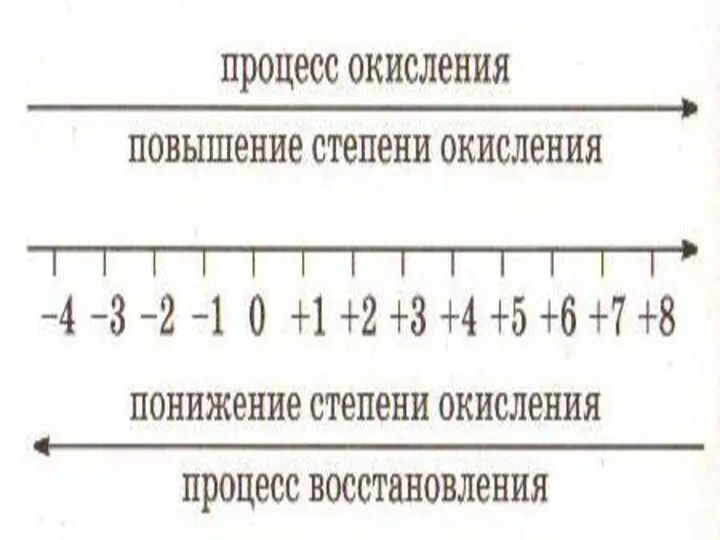
- 5. ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением
- 7. Правила определения функции соединения в окислительно-восстановительных реакциях. 1. Если элемент проявляет в соединении высшую степень окисления,
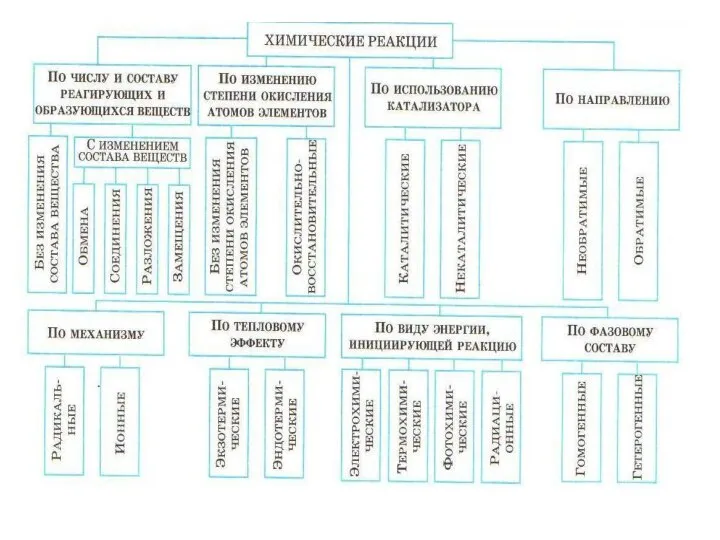
- 8. Химические реакии
- 9. Химические реакции По изменению степени окисления атомов элементов Окислительно-восстановительные Без изменения степени окисления атомов элементов К
- 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
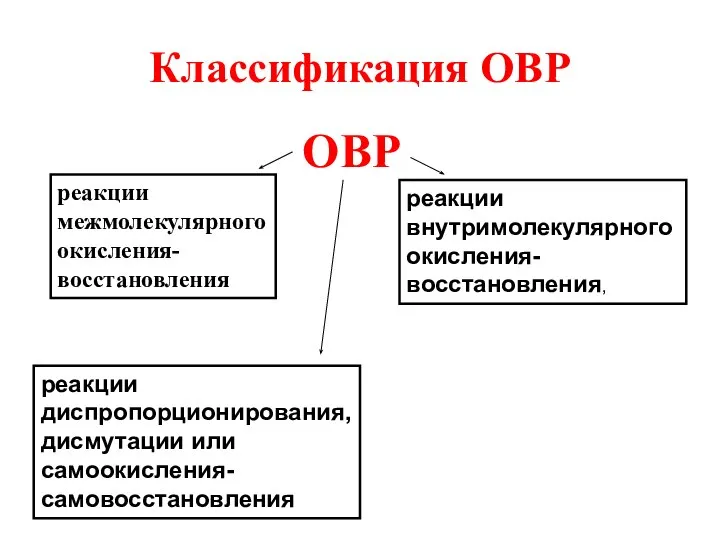
- 11. Классификация ОВР ОВР реакции межмолекулярного окисления-восстановления реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования, дисмутации или самоокисления-самовосстановления
- 12. Межмолекулярные реакции: Частицы- доноры электронов (восстановители) – и частицы- акцепторы электронов (окислители) – находятся в разных
- 13. Внутримолекулярные реакции Донор электронов - восстановитель- и акцептор электронов – окислитель – находятся в одном и
- 14. Реакции дисмутации, или диспропорционирования, или самоокисления-самовосстановления Атомы одного и того же элемента в веществе выполняют одновременно
- 15. Составление окислительно-восстановительных реакций Для составления окислительно-восстановительных реакций используют: 1) метод электронного баланса 2) Составление уравнений окислительно-восстановительных
- 16. Составление окислительно-восстановительных реакций методом электронного баланса Метод основан на сравнении степеней окисления атомов в исходных веществах
- 17. Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций методом электронного баланса 1.Составить схему реакции. 2. Определить степени
- 18. Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций методом электронного баланса 5. Определить, какой элемент окисляется (его
- 19. Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций методом электронного баланса 8. Сбалансировать число электронов между окислителем
- 20. Составление уравнений окислительно-восстановительных реакций методом полуреакций, или ионно-электронным методом Метод основан на составлении ионно-электронных уравнений для
- 21. Основные этапы составления уравнений окислительно-восстановительных реакций ионно-электронным методом (на примере взаимодействия цинка с концентрированной азотной кислотой)
- 24. Скачать презентацию


















 Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть  Своя игра по химии
Своя игра по химии Методы химического анализа. Классификации методов анализа
Методы химического анализа. Классификации методов анализа МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М.
МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М. Диаграммы бинарных систем, образующих твердые растворы
Диаграммы бинарных систем, образующих твердые растворы Средства бытовой химии. Польза и вред. (Бролиш Рита и Матренина Наташа)
Средства бытовой химии. Польза и вред. (Бролиш Рита и Матренина Наташа) Сульфаниламидные препараты. Хинолоны
Сульфаниламидные препараты. Хинолоны Способы выращивания кристаллов (лекция 3)
Способы выращивания кристаллов (лекция 3) Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Проблема содержания нитратов в пищевых продуктах
Проблема содержания нитратов в пищевых продуктах Технология адсорбционной осушки газа
Технология адсорбционной осушки газа Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии
Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии  Роль ферментов в формировании потребительских свойств продовольственных товаров
Роль ферментов в формировании потребительских свойств продовольственных товаров Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Кремний в природе
Кремний в природе СПЛАВЫ МЕТАЛЛОВ
СПЛАВЫ МЕТАЛЛОВ Массообменные процессы
Массообменные процессы Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Блеск и сила здоровых волос
Блеск и сила здоровых волос Презентация Изомерия
Презентация Изомерия  Термические превращения алкенов
Термические превращения алкенов Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1 Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2)
Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2) «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Химический состав яблока
Химический состав яблока Нуклеиновые кислоты: структура и функции
Нуклеиновые кислоты: структура и функции Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Харчові добавки, Е-числа і їх вплив на організм людини
Харчові добавки, Е-числа і їх вплив на організм людини