Содержание
- 2. Алгоритм решения задач Прочитать внимательно условие задачи. Записать «Дано» 2.Определить тип задачи Если в условии задачи
- 3. Задачи на составление химических реакций. . 5. Переводим данные задачи в количество вещества Если в условии
- 4. 8.Переведём найденные количества вещества в массу или объем (что требуется найти в задаче?) О,2 МОЛЬ Х
- 5. Домашняя работа Задача 1. Найдите массу гидроксида кальция, который может быть получен при взаимодействии с водой
- 7. Скачать презентацию
Алгоритм решения задач
Прочитать внимательно условие задачи. Записать «Дано»
2.Определить тип задачи
Если в
Алгоритм решения задач
Прочитать внимательно условие задачи. Записать «Дано»
2.Определить тип задачи
Если в
Если в условии задачи присутствуют несколько веществ = >
Задачи на смеси или растворы
Задача на составление химической реакции
3. Используя формулы, определяем искомый компонент.
3. По условию задачи составляем уравнение химической реакции. (Обращаем внимание на правильность составления формулы веществ и на последовательность расставления коэффициентов)
4. Подчеркиваем вещество с известными данными одной чертой в уравнении хим. реакции. И под веществом указываем известные данные
5. Подчеркиваем вещество с неизвестными данными двумя чертами в уравнении хим. реакции. И под веществом указать искомый компонент.
Задачи на составление химических реакций.
.
5. Переводим данные задачи в количество вещества
Если
Задачи на составление химических реакций.
.
5. Переводим данные задачи в количество вещества
Если
Если по условию задачи имеются примеси, то мы также находим количество чистого вещества и обозначаем его над формулой в хим. реакции.
w (чист.в-ва) = 100 % - прим%
Или если перевести в доли,
То w (чист.в-ва) = 1- доля прим.
Если в условии задачи имеются данные по двум исходным соединениям, то мы находим их количество вещества и пишем значения над формулами данных веществ.
Задачи на чистое вещество
Задачи на избыток и недостаток
6. Над соответствующей формулой в уравнении запишем найденное количество вещества, а количества над формулами искомых веществ обозначим через х и у.
8.Переведём найденные количества вещества в массу или объем (что требуется найти
8.Переведём найденные количества вещества в массу или объем (что требуется найти
О,2 МОЛЬ Х МОЛЬ
НАПРИМЕР : 4AL + 3O2 = 2Al203
Задачи на чистое вещество
n (AL): n (AL20 3) = 4 : 2
=> 4: 2 = 0,2 : х
Х = 0.2 : 2 = 0.1 (моль)
n ( AL203) = 0,1 моль
Найдём количество искомых веществ, зная, что количественные отношения между веществами
Соответствуют коэффициентам перед их формулами в уравнении реакции.
9. Оформим ответ
Задачи на избыток и недостаток
О,2 МОЛЬ 0,01 моль Х МОЛЬ
НАПРИМЕР : 4AL + 3O2 = 2Al203
n (AL): n (AL20 3) = 3 : 2
0,2 > 0.01
=> 3: 2 = 0,01 : х
Х = 0,01 : 1,5 = 0,07(моль)
n ( AL203) = 0,07 моль
СМОТРИМ,
КАКОЕ ВЕЩЕСТВО В НЕДОСТАТКЕ!
Домашняя работа
Задача 1. Найдите массу гидроксида кальция, который может быть получен
Домашняя работа
Задача 1. Найдите массу гидроксида кальция, который может быть получен
Дано:
m (cмеси оксида кальция с примесью) = 254,4
w(прим) = 12 % = 0,12
Найти :
m(гидроксида кальция ) - ?
Решение:
Задача 2. Рассчитайте объем углекислого газа (н.у.), выделяющегося при добавлении 25 г. Карбоната кальция в 200 г. 1.825 %ного раствора соляной кислоты. (В качестве исходных веществ выступают карбонат кальция и соляная кислота. В продуктах реакции находится вода, углекислый газ и хлорид кальция)
Дано:
m (карбонат кальция) = 25 г.
m раствора(соляная к-та)= 200 г
w() = 1, 825 % = 0,01825
Найти :
V(углекислого газа ) - ?




 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы
Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы Классификация органических соединений. (10 класс)
Классификация органических соединений. (10 класс) Оксиды, их применение
Оксиды, их применение Презентация Коррозия
Презентация Коррозия Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Вещества и материалы. Классификация веществ. Индикаторы. 6 класс
Вещества и материалы. Классификация веществ. Индикаторы. 6 класс Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Нуклеиновые кислоты
Нуклеиновые кислоты Пластмаса
Пластмаса  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Строение вещества
Строение вещества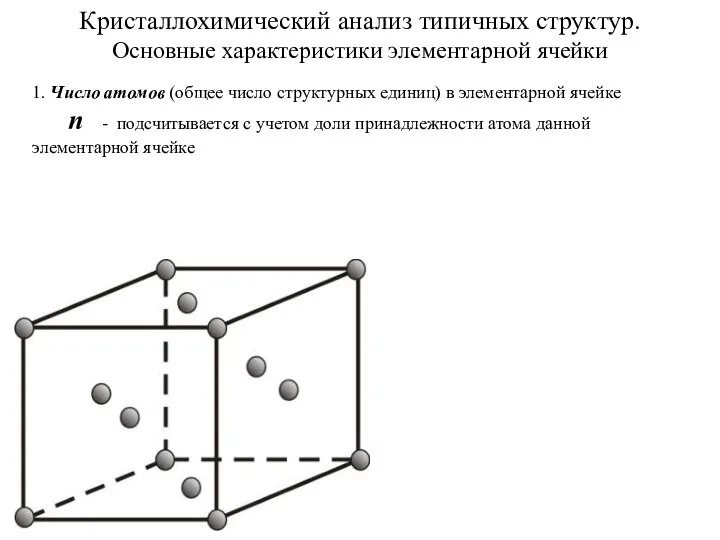 Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки
Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники Общие электронные конфигурации элементов главных подгрупп
Общие электронные конфигурации элементов главных подгрупп Электролитическая диссоциация
Электролитическая диссоциация Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Cинтетичні миючі засоби і їхній вплив на людину
Cинтетичні миючі засоби і їхній вплив на людину  Алюминий и его соединения
Алюминий и его соединения Химические свойства и применение кислорода
Химические свойства и применение кислорода Лактоза
Лактоза Алканы (структурная изомерия и систематическая номенклатура)
Алканы (структурная изомерия и систематическая номенклатура)
 Полисульфидные каучуки
Полисульфидные каучуки Третья группа ПС
Третья группа ПС