Содержание
- 2. Дополнительно... Тема проекта: Галогены Автор проекта: учащиеся 9 класса Дата выполнения:2009г. Дополнительно...
- 3. галогены Главная подгруппа VII группа Фтор F, хлор Cl, бром Br, йод I, астат At –
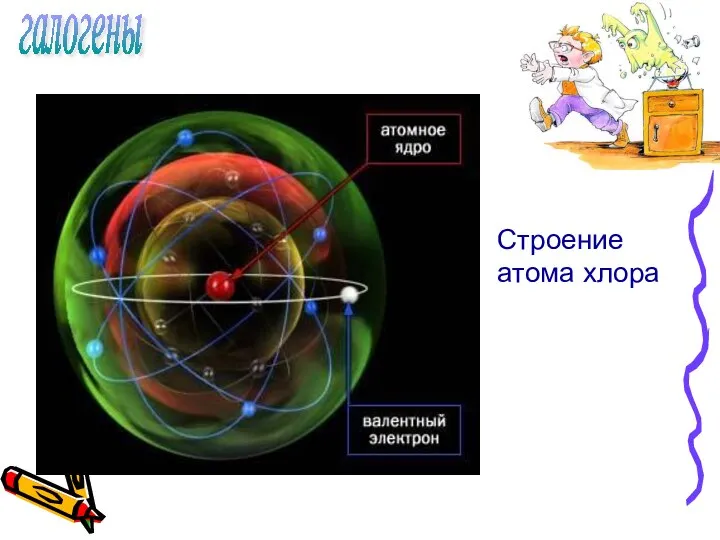
- 4. галогены Строение атома хлора
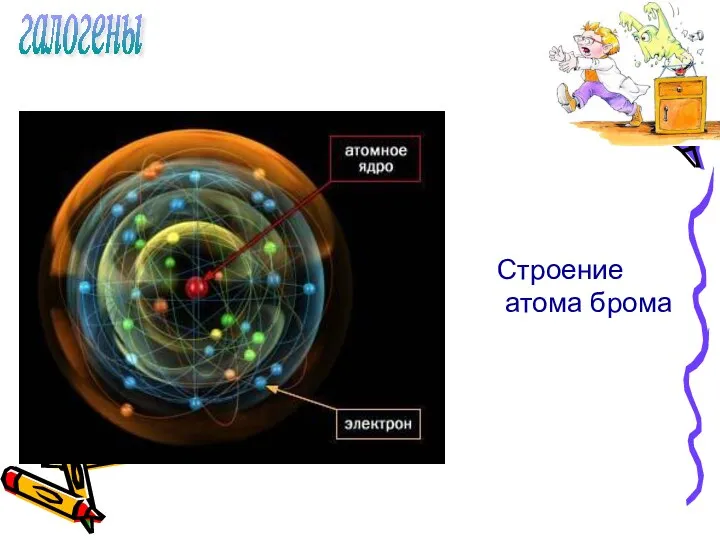
- 5. галогены Строение атома брома
- 6. галогены Каким образом изменяются окислительные свойства галогенов? Почему?
- 7. галогены Окислительные свойства уменьшаются от фтора к йоду: с увеличением порядкового номера с увеличением радиуса атома
- 8. галогены Фтор только окислитель степень окисления -1
- 9. галогены Проявляют окислительные свойства в соединениях с металлами, водородом, менее электроотрицательными элементами (степень окисления -1) Проявляют
- 10. галогены Радиоактивный элемент. Наиболее устойчивый его изотоп At210 имеет период полураспада 8,3 часа («астат» означает «неустойчивый»)
- 11. галогены Молекулы двухатомные Ковалентная неполярная связь Молекулярная кристаллическая решетка F2,Cl2 – газы Br2 – жидкость I2
- 12. галогены Фтор – светло-желтый газ, с резким раздражающим запахом. Не сжижается при обычной температуре. Tпл. =
- 13. галогены Хлор – желто-зеленый газ, с резким удушливым запахом. Сжижается при обычной температуре под давлением. Tпл.
- 14. галогены Бром – буровато-коричневая жидкость с резким, зловонным запахом Tпл. = -7°С, Tкип. = +58°С Растворяется
- 15. галогены Йод – черно-фиолетовое твердое вещество с металлическим блеском Запах резкий Tпл. = +114°С, Tкип. =
- 16. галогены галогены галогены галогены Получение
- 17. галогены 2КMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O Получение хлора в лаборатории
- 18. галогены Химическая активность галогенов как неметаллов от фтора к йоду ослабевает галогены галогены галогены
- 19. галогены галогены галогены галогены Кристаллики сурьмы в колбе с хлором, красиво вспыхивают и сгорают, образуя смесь
- 20. галогены галогены галогены галогены Кристаллики сурьмы в колбе с хлором, красиво вспыхивают и сгорают, образуя смесь
- 21. галогены В парах хлора сгорает раскаленная медная проволока, образуя хлорид меди (II)
- 22. галогены В парах хлора сгорает раскаленная медная проволока, образуя хлорид меди (II) Cu + Cl2 =
- 23. галогены Горение красного фосфора в хлоре
- 24. галогены Горение красного фосфора в хлоре 2P + 5Cl2 =2PCl5
- 25. галогены Горение парафиновой свечи в хлоре
- 26. галогены Поглощение брома активированным углем
- 27. галогены Хлор реагирует с водой на холоде с образованием соляной и хлорноватистой кислот. Cl2 + Н2О
- 28. галогены Вода горит в струе фтора
- 29. галогены Вода горит в струе фтора 2Н2О + 2F2 = 4HF + О2
- 30. галогены Фтор – Энергично реагирует со всеми простыми веществами (за исключением О2, N2, Не, Ne, Ar)
- 31. галогены Хлор – Непосредственно реагирует с металлами и неметаллами в основном при нагревании: 2Na + Cl2
- 32. галогены Бром – Непосредственно реагирует со многими элементами, наиболее энергично – с алюминием: 2Аl + 3Вr2=
- 33. галогены Йод – С крахмалом йод дает соединение ярко синего цвета, его образование является качественной реакцией
- 35. Скачать презентацию






























 Алканы. Предельные углеводороды
Алканы. Предельные углеводороды Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ
Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть  Знаходження в періодичній системі і основні характеристики Меркурія
Знаходження в періодичній системі і основні характеристики Меркурія Постулаты Онзагера
Постулаты Онзагера Органические вещества
Органические вещества Повышение эксплуатационных свойств дизельных топлив в условиях предприятий АПК
Повышение эксплуатационных свойств дизельных топлив в условиях предприятий АПК Круговорот веществ Лекции по экологии Каф.ХиЭ ТТИ ЮФУ Доц.,к.х.н. Е.В.Воробьев
Круговорот веществ Лекции по экологии Каф.ХиЭ ТТИ ЮФУ Доц.,к.х.н. Е.В.Воробьев Тема урока: Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия.
Тема урока: Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия. ЕГЭ по химии, решение заданий части 3
ЕГЭ по химии, решение заданий части 3 Природні джерела вуглеводнів Виконала Учениця 11-А класу Кузнєцова Анастасія
Природні джерела вуглеводнів Виконала Учениця 11-А класу Кузнєцова Анастасія  Силикаты. Пироксены. Амфиболы. Полевые шпаты
Силикаты. Пироксены. Амфиболы. Полевые шпаты Презентация Классификация кислот
Презентация Классификация кислот  Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод)
Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод) Применение элетролиза в промышленности
Применение элетролиза в промышленности ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ Підготувала: учениця 10 класу Сало Альона
ВЛАСТИВОСТІ ГАЗІВ, РІДИН, ТВЕРДИХ ТІЛ Підготувала: учениця 10 класу Сало Альона  Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Химические волокна
Химические волокна Природні і супутні нафтові гази
Природні і супутні нафтові гази  Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Пена. Типы пены. Сферические пены
Пена. Типы пены. Сферические пены Открытая школа по химии
Открытая школа по химии Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Подготовка к ГИА. А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы
Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы Семь интересных фактов о метиловом спирте
Семь интересных фактов о метиловом спирте