Содержание
- 2. Органическая химия – химия соединений углерода. В состав большинства органических молекул, кроме С, входят атомы 5
- 3. В основе представлений о строении органических веществ лежит теория А.М.Бутлерова. По значимости эта теория занимает в
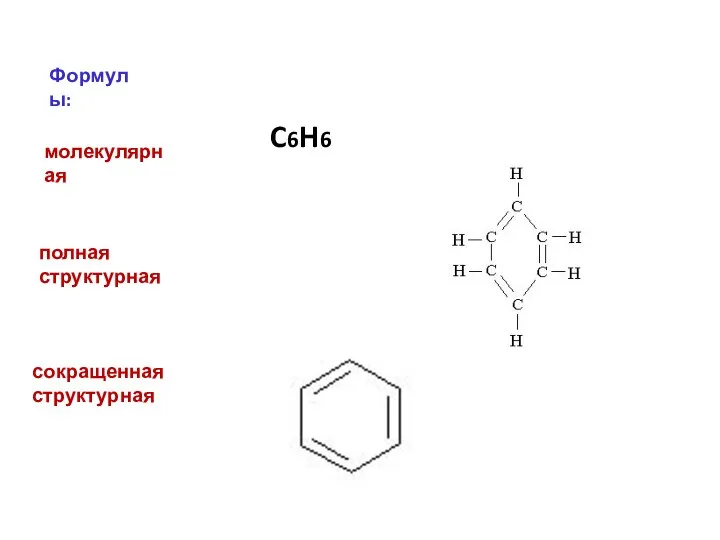
- 4. Формулы: молекулярная C6H6 полная структурная сокращенная структурная
- 6. Степень окисления атома С лежит в диапазоне (-4) ÷ (+4) C-4H4, C3 -8/3H8, HC0HO, HC+2OOH, C+4Cl4
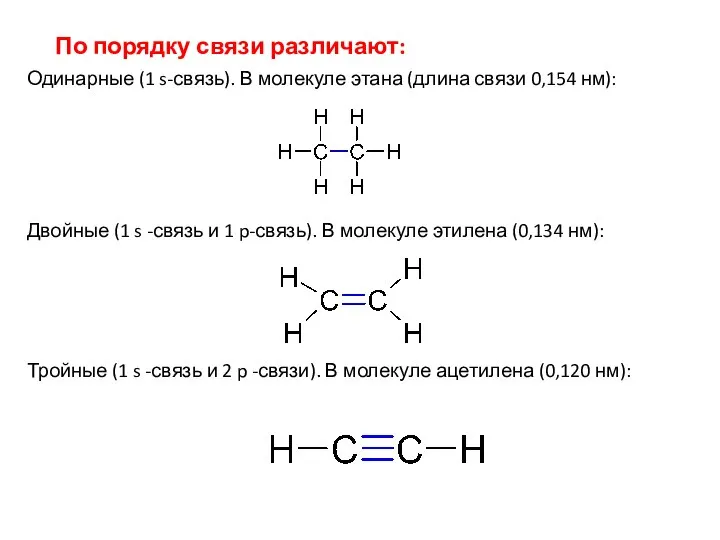
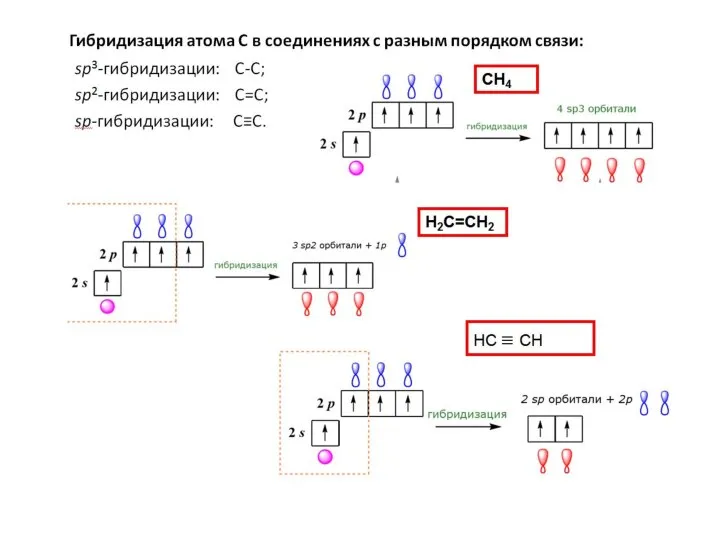
- 7. По порядку связи различают: Одинарные (1 s-связь). В молекуле этана (длина связи 0,154 нм): Двойные (1
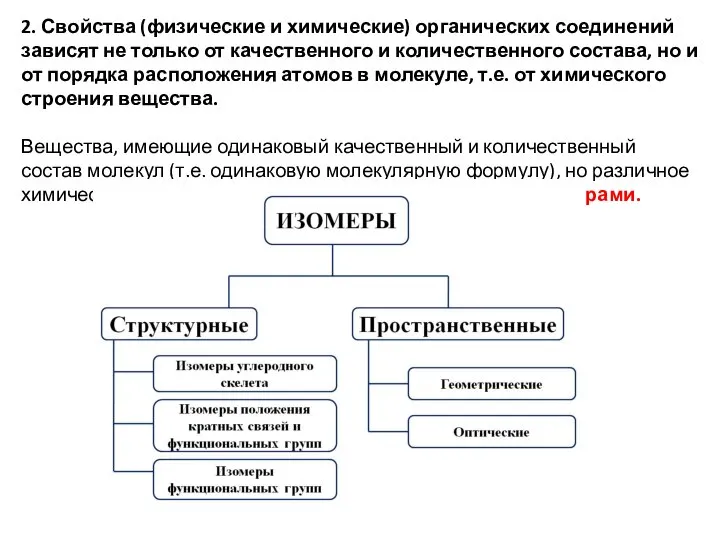
- 9. 2. Свойства (физические и химические) органических соединений зависят не только от качественного и количественного состава, но
- 10. 3. Так как в конкретных химических реакциях изменяются лишь некоторые части молекулы, то исследование строения продукта
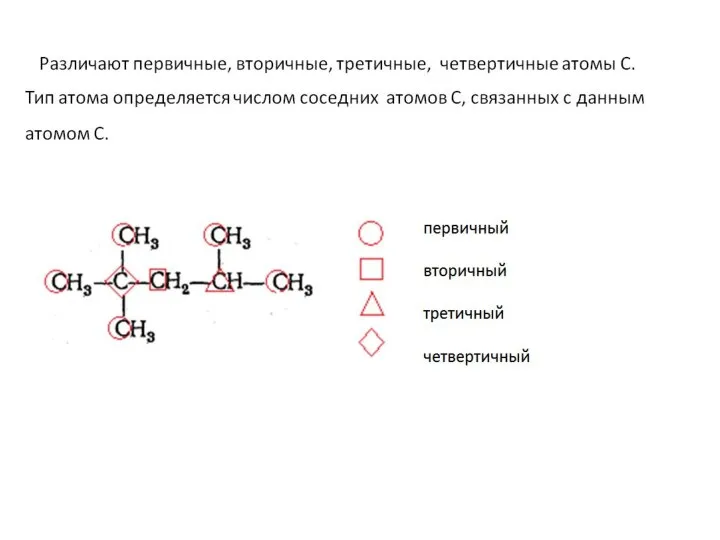
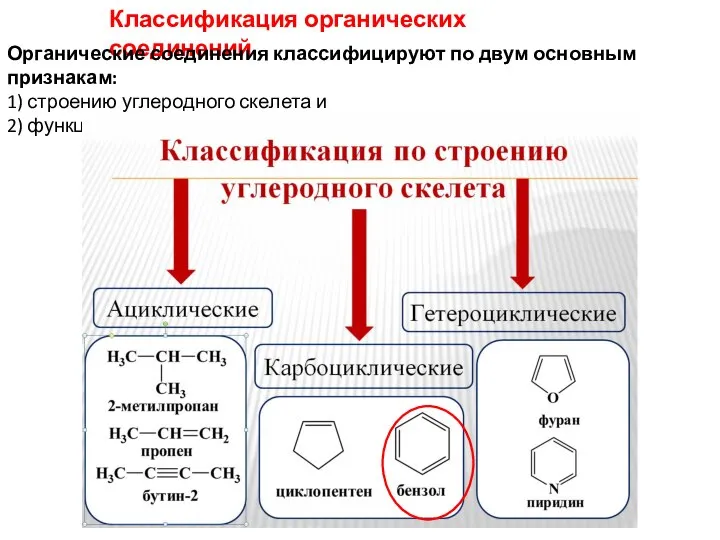
- 11. Классификация органических соединений Органические соединения классифицируют по двум основным признакам: 1) строению углеродного скелета и 2)
- 12. К карбоциклическим (алициклическим) относятся ароматические соединения. Ароматические- содержат одно или несколько бензольных колец. Критерии ароматичности: наличие
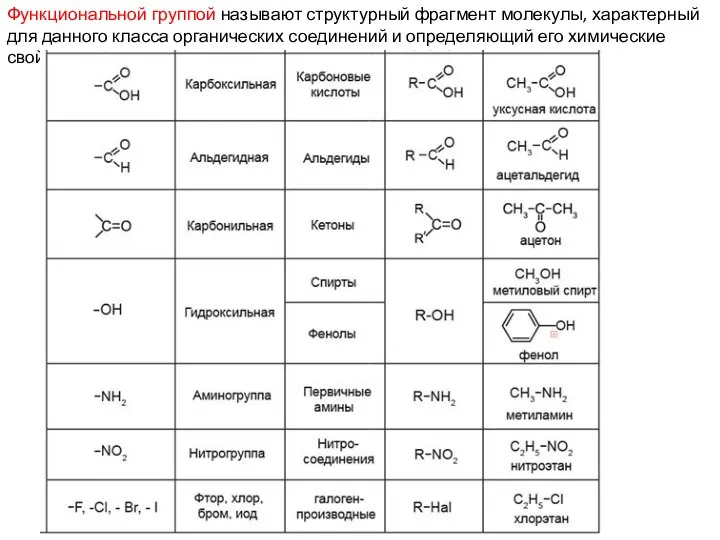
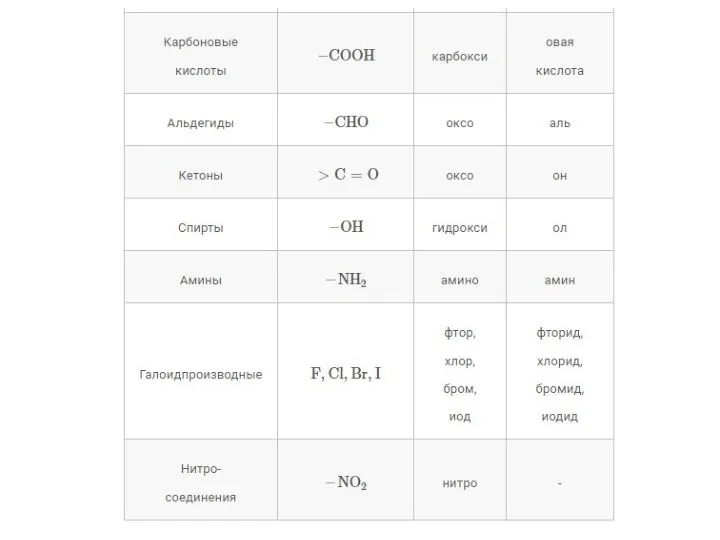
- 13. Функциональной группой называют структурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические
- 14. Вещества аналогичного строения, отличающиеся по составу на целое число групп (-СН2), называются гомологами. Гомологи – соединения
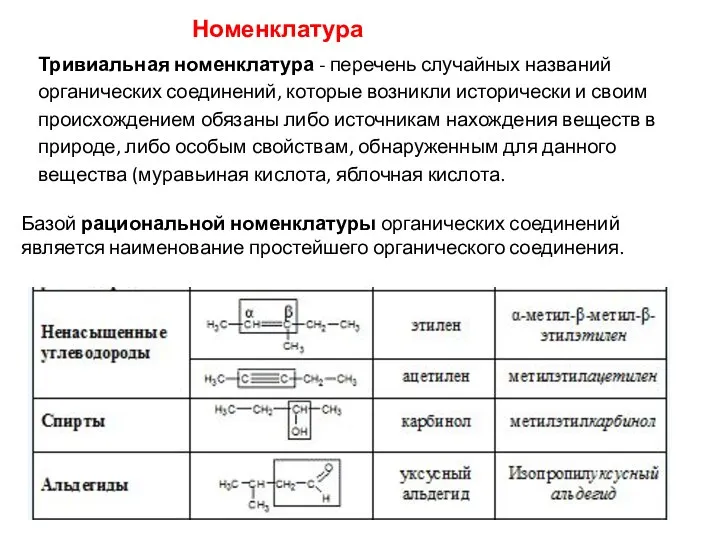
- 15. Номенклатура Тривиальная номенклатура - перечень случайных названий органических соединений, которые возникли исторически и своим происхождением обязаны
- 16. Систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии). Выбирают наиболее длинную углеродную цепь,
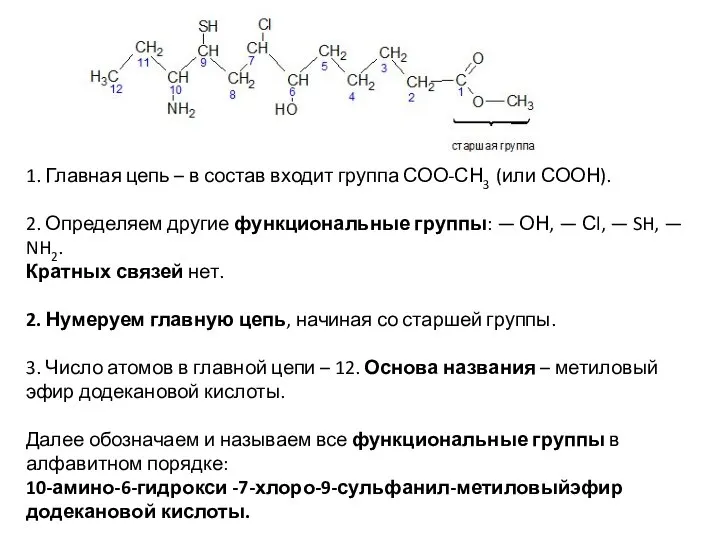
- 18. 1. Главная цепь – в состав входит группа СОО-СН3 (или СООН). 2. Определяем другие функциональные группы:
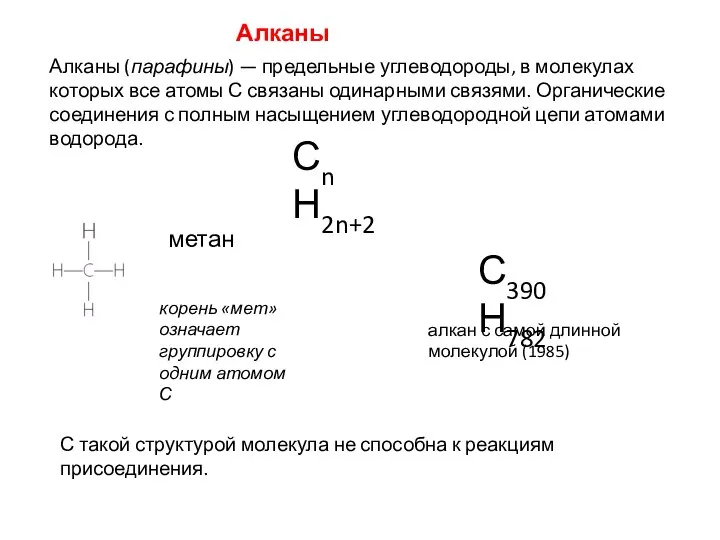
- 19. Алканы Алканы (парафины) — предельные углеводороды, в молекулах которых все атомы С связаны одинарными связями. Органические
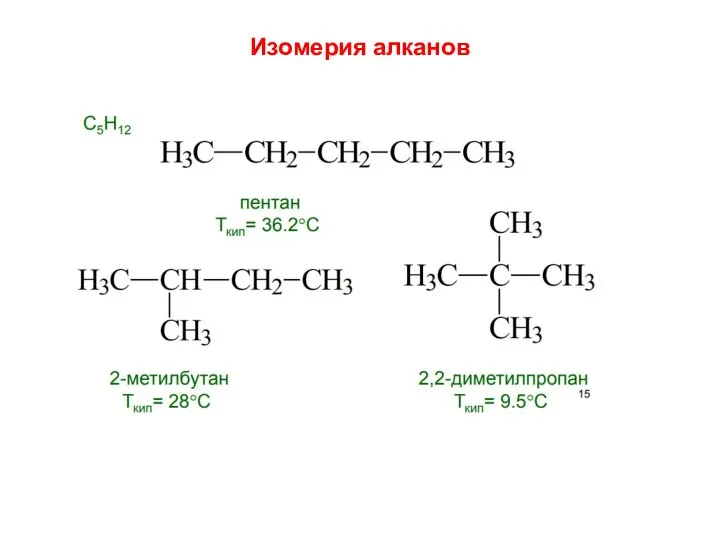
- 20. Изомерия алканов
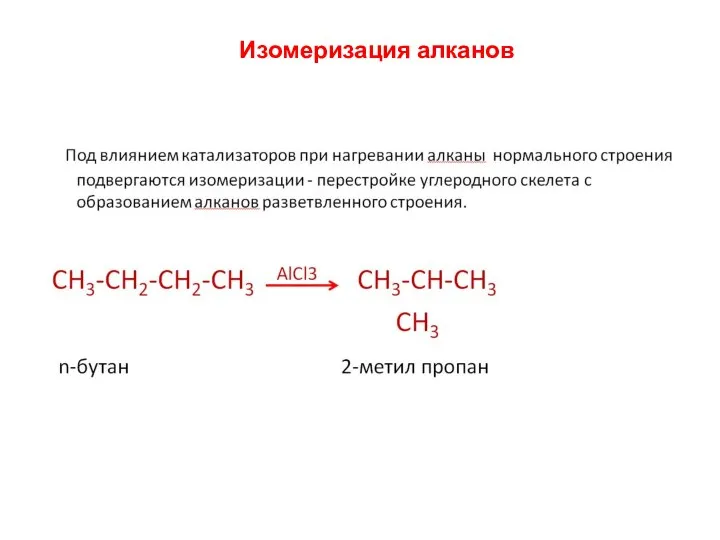
- 21. Изомеризация алканов
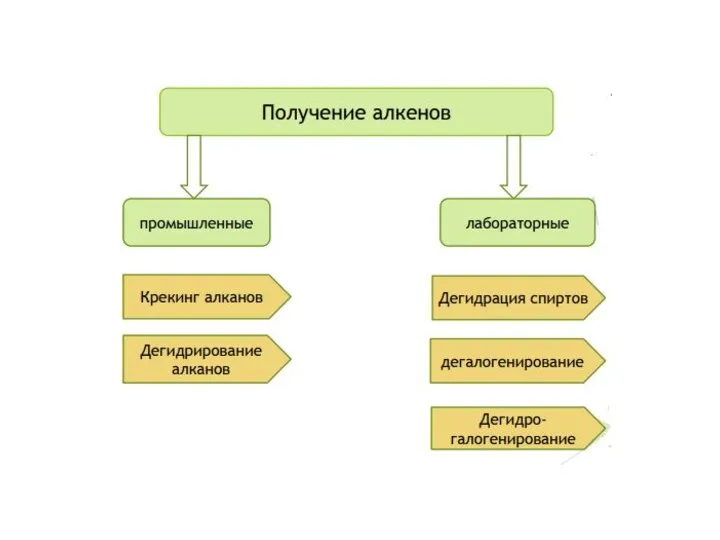
- 22. Получение алканов Из ненасыщенных углеводородов (гидрирование): катализаторы - Pt,Ni ; CnH2n + H2 → CnH2n+2 2.
- 23. Алканы — химически наименее активные органические соединения. Коновалов: «Алканы – химические мертвецы» Реакции алканов: замещения разложения
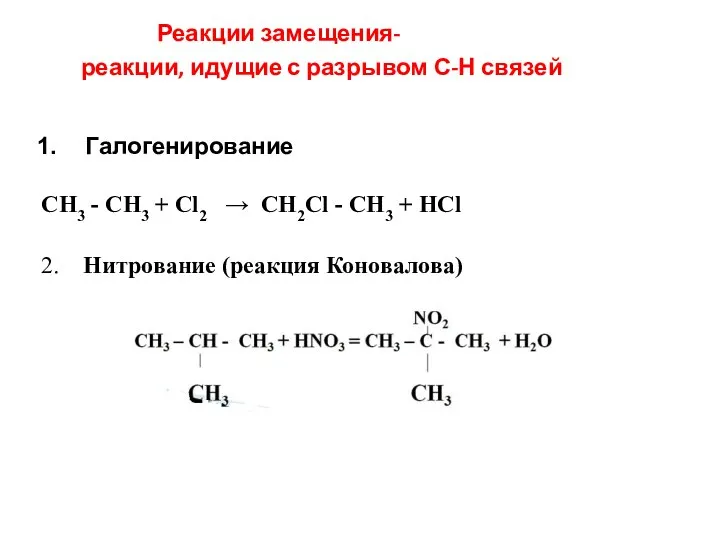
- 24. Реакции замещения- реакции, идущие с разрывом С-Н связей Галогенирование СН3 - СН3 + Сl2 → CH2Cl
- 25. Реакции разложения при температуре В отличие от пиролиза крекинг протекает при более низких температурах, и разрушения
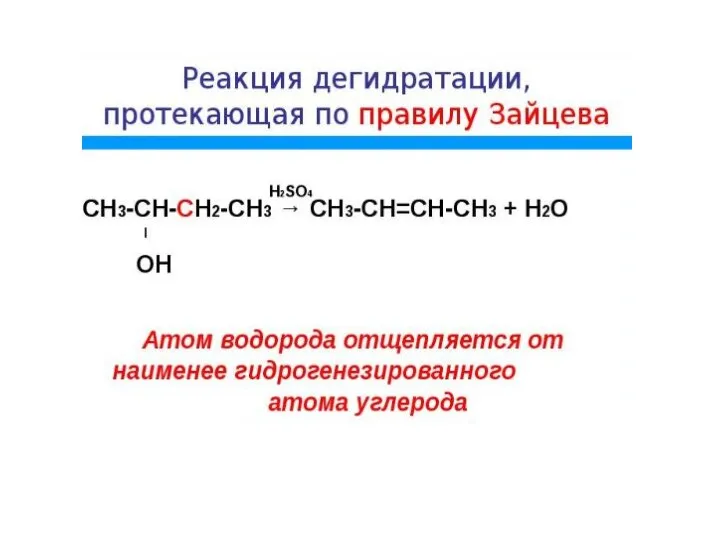
- 26. При дегидрировании алканов образуются алкены и другие непредельные углеводороды. Например, дегидрирование пентана с образованием пентена: С5Н12
- 27. Реакции окисления Горение 2. Не обесцвечивают перманганат калия и бромную воду. СН4 + 2О2 = СО2
- 28. Физические свойства алканов Алканы - бесцветные вещества, легче воды, плохо растворяются в воде. С ростом молекулярной
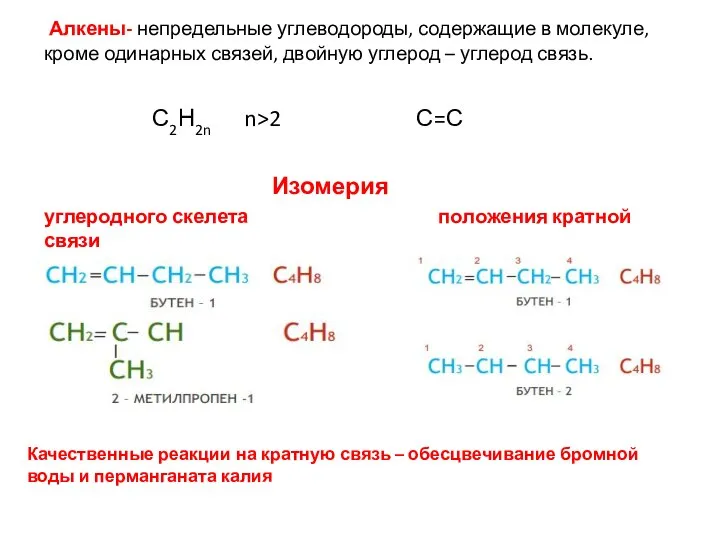
- 29. Алкены- непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, двойную углерод – углерод связь. С2Н2n n>2
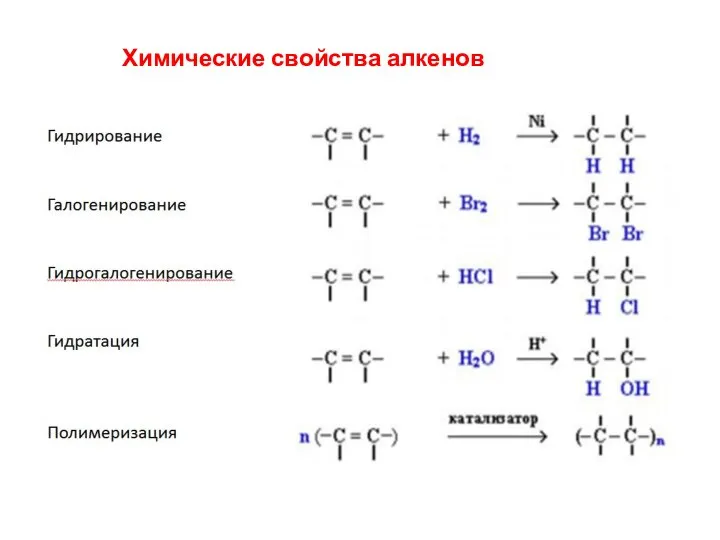
- 32. Химические свойства алкенов
- 34. Скачать презентацию













 Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС
Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС Презентация Химическая связь
Презентация Химическая связь  Углеводы. Классификация, общая характеристика
Углеводы. Классификация, общая характеристика Ферросплавы. Феррохром
Ферросплавы. Феррохром Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно
Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно Фазовые равновесия раствор-пар в двухкомпонентных системах из двух летучих жидкостей
Фазовые равновесия раствор-пар в двухкомпонентных системах из двух летучих жидкостей Чадний газ Підготувала Іванова Ірина учениця 10 класу
Чадний газ Підготувала Іванова Ірина учениця 10 класу  Информационно – исследовательский проект Кристаллы вокруг нас.
Информационно – исследовательский проект Кристаллы вокруг нас. Правила оформления лабораторных работ
Правила оформления лабораторных работ Классный час День Земли ,Воды и Чистого воздуха Автор: учитель химии МБОУ «СОШ №3» г. Касимова Рязанской области С.В.Толмачева
Классный час День Земли ,Воды и Чистого воздуха Автор: учитель химии МБОУ «СОШ №3» г. Касимова Рязанской области С.В.Толмачева  ГАЛОГЕНЫ И ЗДОРОВЬЕ ЧЕЛОВЕКА Это полезно знать (к уроку по теме «Галогены», 9 класс) <Белова В.Ф.учитель химии МОУ СОШ№39г.Хабаро
ГАЛОГЕНЫ И ЗДОРОВЬЕ ЧЕЛОВЕКА Это полезно знать (к уроку по теме «Галогены», 9 класс) <Белова В.Ф.учитель химии МОУ СОШ№39г.Хабаро Свинец. Полезный металл, яд и глобальный загрязнитель
Свинец. Полезный металл, яд и глобальный загрязнитель Техника безопасности и методы работы в лаборатории органического синтеза
Техника безопасности и методы работы в лаборатории органического синтеза студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А
Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А  Презентация по Химии "Тема. Короткі відомості з історії хімії" - скачать смотреть бесплатно
Презентация по Химии "Тема. Короткі відомості з історії хімії" - скачать смотреть бесплатно Коррозия металлов. Причины
Коррозия металлов. Причины Фотометрический анализ III курс, д/о Лекция№1 Преподаватель Ельчищева Ю.Б.
Фотометрический анализ III курс, д/о Лекция№1 Преподаватель Ельчищева Ю.Б.  Технологічні і біохімічні властивості м‘яса та м‘ясопродуктів. Будова тканин живих організмів
Технологічні і біохімічні властивості м‘яса та м‘ясопродуктів. Будова тканин живих організмів Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Алюминиевые сплавы
Алюминиевые сплавы Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть
Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть