Содержание
- 2. НАХОЖДЕНИЕ В ТАБЛИЦЕ МЕНДЕЛЕЕВА Углерод Carbogenium - 6ой элемент в таблице Менделеева. Он располагается в главной
- 3. НАХОЖДЕНИЕ В ПРИРОДЕ В настоящее время известно более миллиона соединений углерода с другими элементами. Их изучение
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ Углерод занимает 17-е место по распространенности в земной коре – 0,048%. Но несмотря
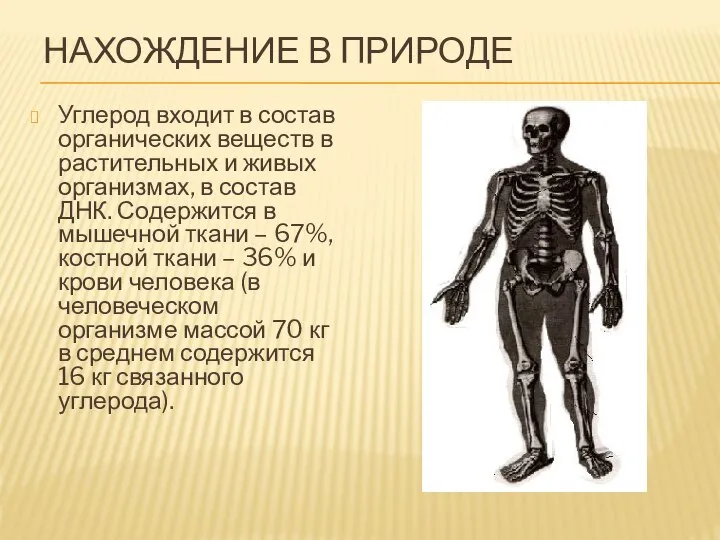
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ Углерод входит в состав органических веществ в растительных и живых организмах, в состав
- 6. СВОБОДНЫЙ УГЛЕРОД В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 7. АЛМАЗ
- 8. ГРАФИТ
- 9. МОДЕЛЬ ФУЛЛЕРЕНА С60
- 10. АЛМАЗ Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ,
- 11. АЛМАЗ Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из графита при p >
- 12. АЛМАЗ Непрерывная трехмерная сетка ковалентных связей, которая характеризуется большой прочностью, определяет многие свойства алмаза, так то
- 13. ГРАФИТ Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
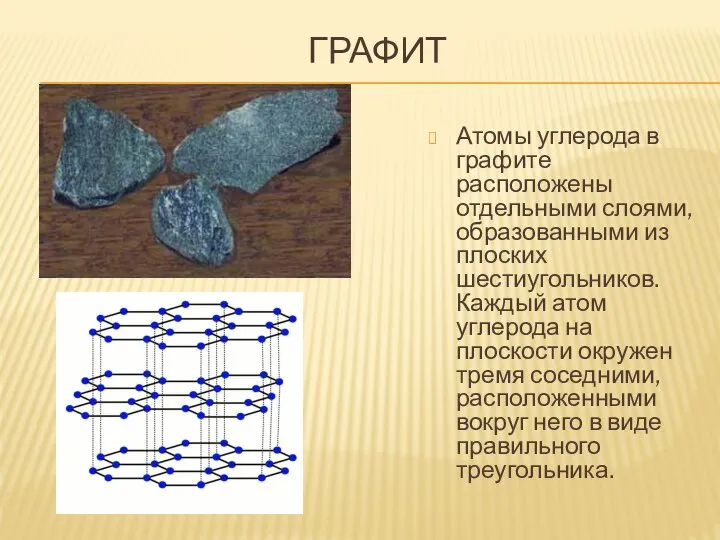
- 14. ГРАФИТ Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников. Каждый атом углерода на
- 15. ГРАФИТ Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки
- 16. КАРБИН Карбин был получен в начале 60-х годов В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым.
- 17. КАРБИН Он имеет вид черного мелкокристаллическ-ого порошка, однако может существовать в виде белого вещества с промежуточной
- 18. КАРБИН За счет существования различных типов связи и разных способов укладки цепей из углеродных атомов в
- 19. КАРБИН Карбин уже нашел применение в электронике, космонавтике, авиации и медицине. Перспективно его применение в оптике,
- 20. ДРУГИЕ ФОРМЫ УГЛЕРОДА Известны и другие формы углерода, такие как уголь, кокс и сажа. Но все
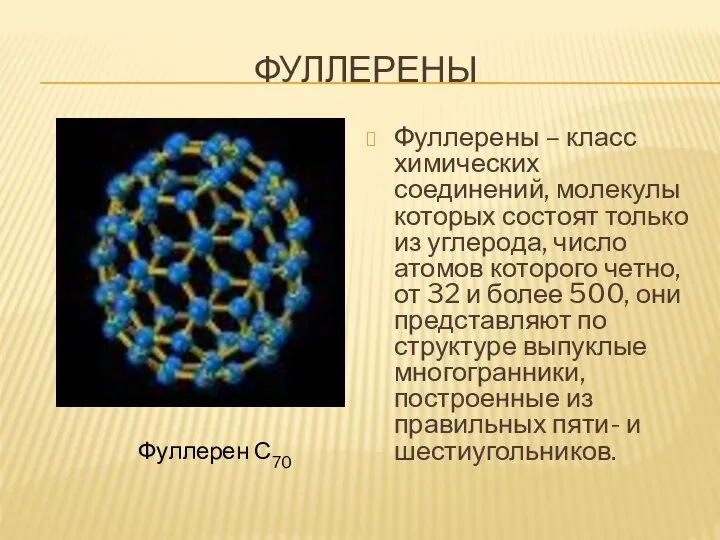
- 21. ФУЛЛЕРЕНЫ Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 22. ФУЛЛЕРЕНЫ Происхождение термина "фуллерен" связано с именем американского архитектора Ричарда Букминстера Фуллера, конструировавшего полусферические архитектурные конструкции,
- 23. ФУЛЛЕРЕНЫ В противоположность первым двум, графиту и алмазу, структура которых представляет собой периодическую решетку атомов, третья
- 24. ФУЛЛЕРЕНЫ Молекулы фуллеренов, в которых атомы углерода связаны между собой как одинарными, так и двойными связями,
- 26. Скачать презентацию




















 Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна
ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна  Жидкие кристаллы и их свойства
Жидкие кристаллы и их свойства Пептиды. Тема 3
Пептиды. Тема 3 Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599
Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599 Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Введение в биохимию. Строение и функции белков (часть 2)
Введение в биохимию. Строение и функции белков (часть 2) Липиды. Классификация, физические и химические свойства
Липиды. Классификация, физические и химические свойства Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Азот. История открытия азота
Азот. История открытия азота Периодический закон. Периодическая система химических элементов
Периодический закон. Периодическая система химических элементов 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Wybrane sybstancje chemiczne i ich działanie
Wybrane sybstancje chemiczne i ich działanie Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Аморфные тела
Аморфные тела Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.
Алкины Физические и химические свойства. Получения. Реакции. Использование человеком. Тесты, Задачи, Вопросы.  Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Организация е-транспортной цепи
Организация е-транспортной цепи Общая фармакология
Общая фармакология Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Классификация химических реакций
Классификация химических реакций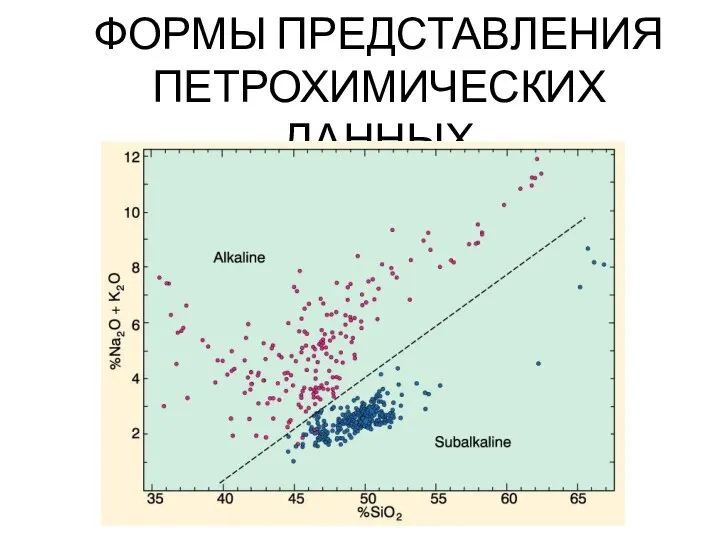 Формы представления петрохимических данных
Формы представления петрохимических данных Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно
Презентация по Химии "Химические элементы металлы и здоровье человека" - скачать смотреть бесплатно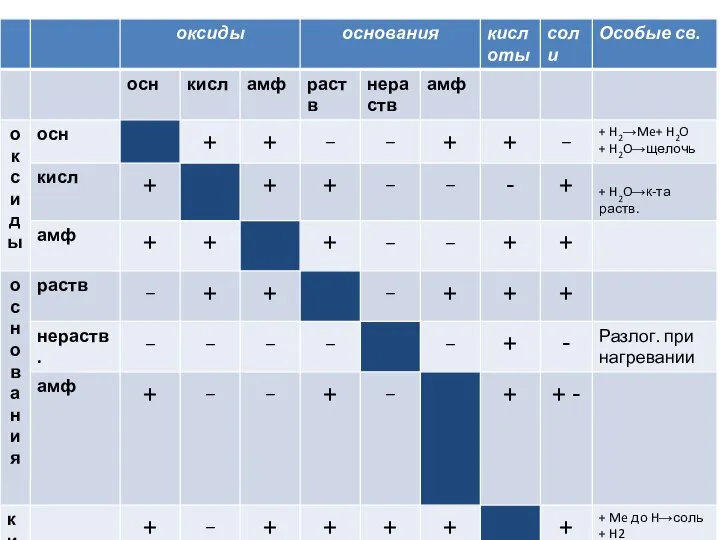 Оксиды, основания, кислоты
Оксиды, основания, кислоты Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией
Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов