Содержание
- 2. Вода При разложении воды электрическим током образуются газы: водород (Н2) и кислород (О2). Образуется 2л водорода,
- 3. Вода Химические свойства воды. Вода вступает в реакцию со многими сложными и простыми веществами. С активными
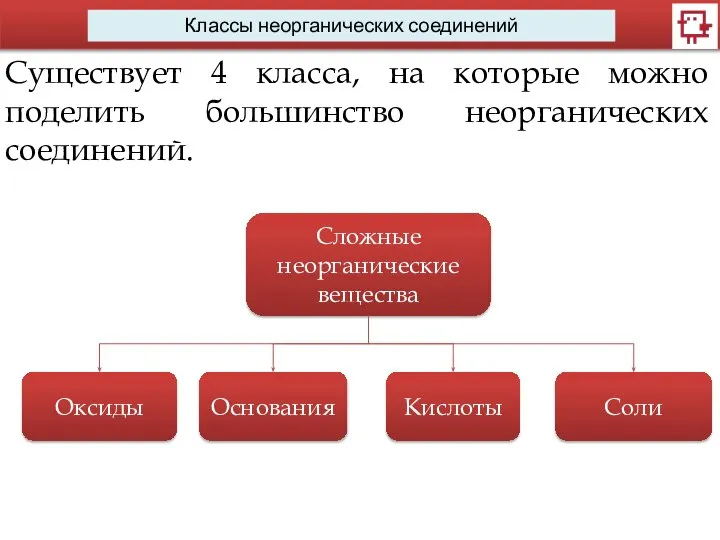
- 4. Классы неорганических соединений Существует 4 класса, на которые можно поделить большинство неорганических соединений. Сложные неорганические вещества
- 5. Классы неорганических соединений Оксиды Оксиды – это сложные вещества, которые состоят из двух элементов, одним из
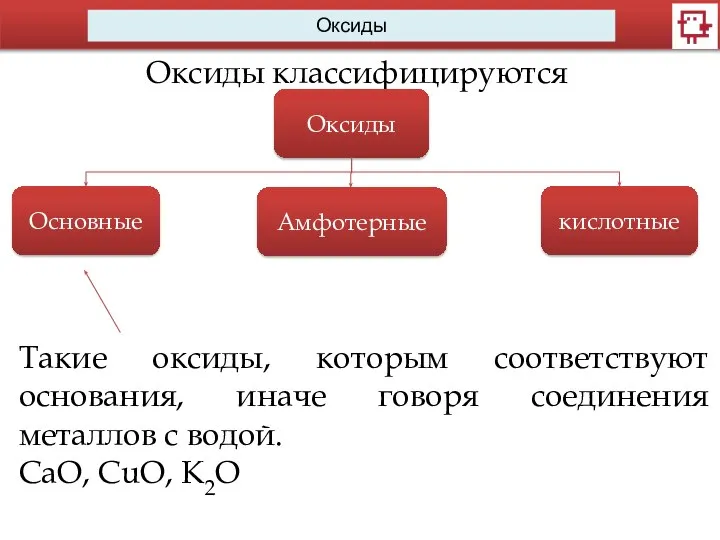
- 6. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют основания, иначе говоря соединения металлов
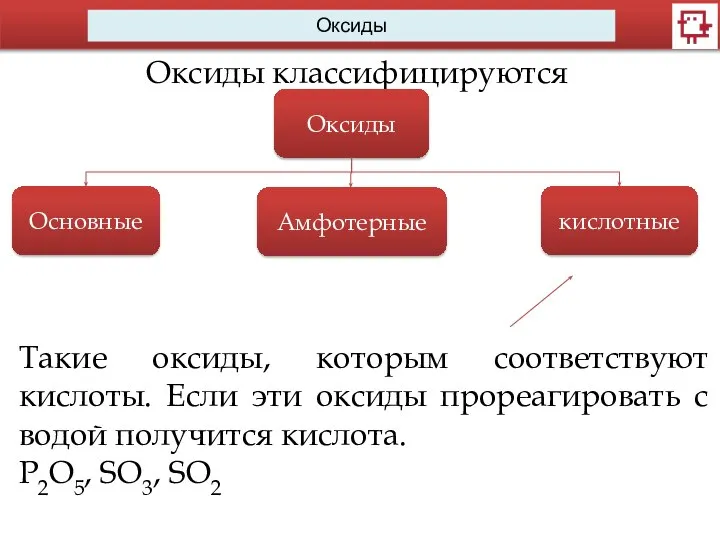
- 7. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют кислоты. Если эти оксиды прореагировать
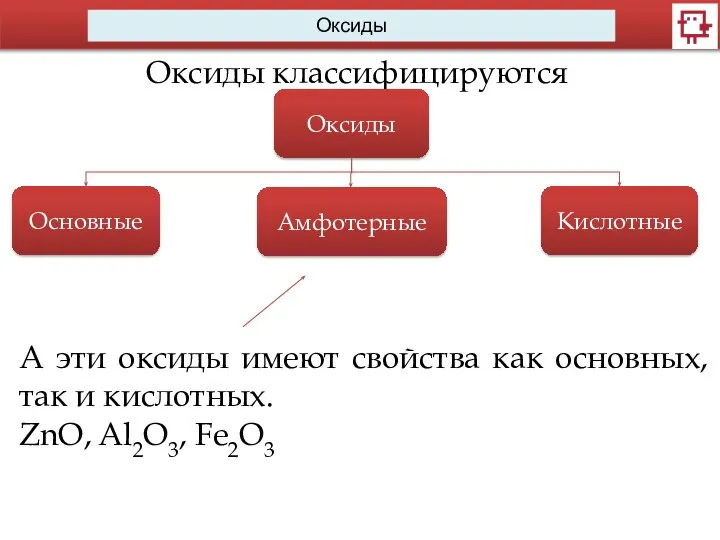
- 8. Оксиды Оксиды классифицируются Оксиды Основные Амфотерные Кислотные А эти оксиды имеют свойства как основных, так и
- 9. Оксиды Оксиды, которым соответствуют основания, называются основными. Na2O + H2O =2NaOH Как правило, основные оксиды образуют
- 10. Оксиды Названия оксидов. Если, это оксид, в который входит элементы с постоянной валентностью, о ней дополнительно
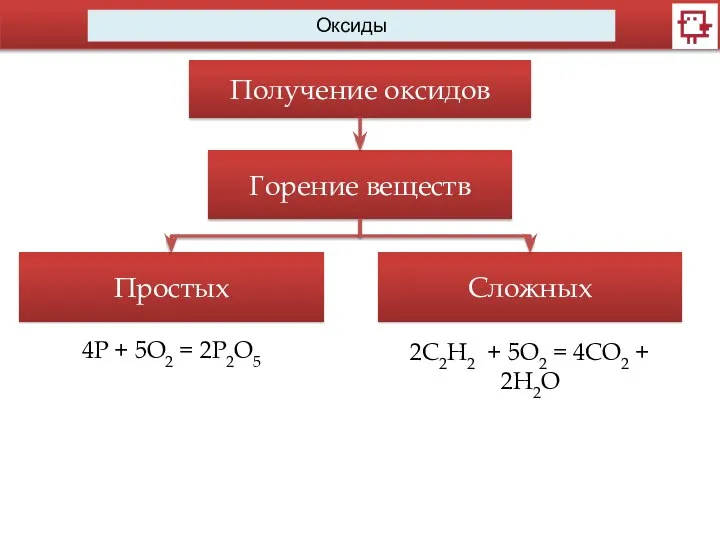
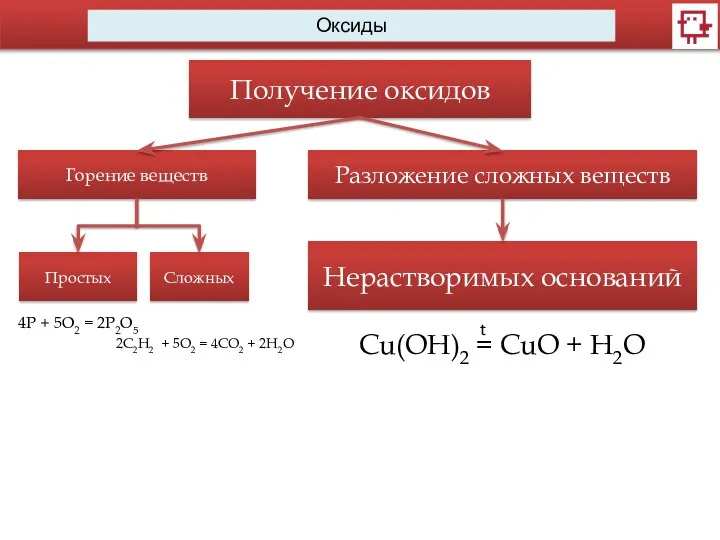
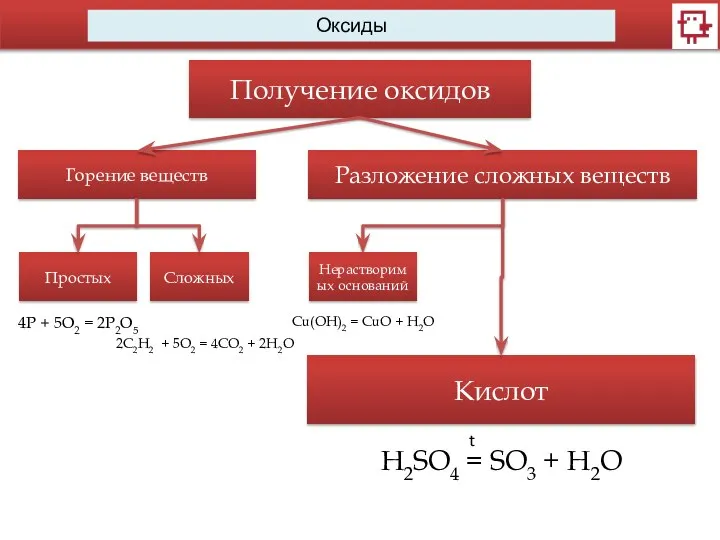
- 11. Оксиды Получение оксидов Горение веществ Простых Сложных 4Р + 5O2 = 2P2O5 2C2H2 + 5O2 =
- 12. Оксиды Получение оксидов Горение веществ Простых Сложных 2C2H2 + 5O2 = 4CO2 + 2H2O 4Р +
- 13. Оксиды Получение оксидов Горение веществ Простых Сложных 2C2H2 + 5O2 = 4CO2 + 2H2O 4Р +
- 15. Скачать презентацию





 «Пластмаси» Тема проекту:
«Пластмаси» Тема проекту:  Современные проблемы химии. Межфакультетский курс для студентов
Современные проблемы химии. Межфакультетский курс для студентов Физико - химические основы получения лекарственных препаратов (лекция 3)
Физико - химические основы получения лекарственных препаратов (лекция 3) Чистые вещества и смеси
Чистые вещества и смеси Химия в профессиях
Химия в профессиях Азотная кислота и ее свойства
Азотная кислота и ее свойства алгоритм
алгоритм Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городищ
Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городищ Применение центрифугирования
Применение центрифугирования Практикум по химической термодинамике и кинетике
Практикум по химической термодинамике и кинетике Көміртек
Көміртек Домашний эксперимент № 7 по химии Цветные опыты - на стыке двух наук
Домашний эксперимент № 7 по химии Цветные опыты - на стыке двух наук Алюминий
Алюминий Реакции Фаворского
Реакции Фаворского Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна
Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна От монументов до безделушек
От монументов до безделушек Нефть Состав, свойства, переработка
Нефть Состав, свойства, переработка  Химический элементы в нашей жизни
Химический элементы в нашей жизни Юные химики
Юные химики Основные сведения о композитах. Понятие о композитах
Основные сведения о композитах. Понятие о композитах Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Презентация по Химии "Лекарства дома" - скачать смотреть
Презентация по Химии "Лекарства дома" - скачать смотреть  Информационно-поисковый исследовательский проект: «Влияние пищевых добавок на здоровье человека».
Информационно-поисковый исследовательский проект: «Влияние пищевых добавок на здоровье человека». Дисахариды Ширяева София ХБ-4 г.Липецк 2012
Дисахариды Ширяева София ХБ-4 г.Липецк 2012 Кислородные соединения азота
Кислородные соединения азота Токсины в быту. Классификация товаров бытовой химии
Токсины в быту. Классификация товаров бытовой химии Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Минеральные вещества
Минеральные вещества