Содержание
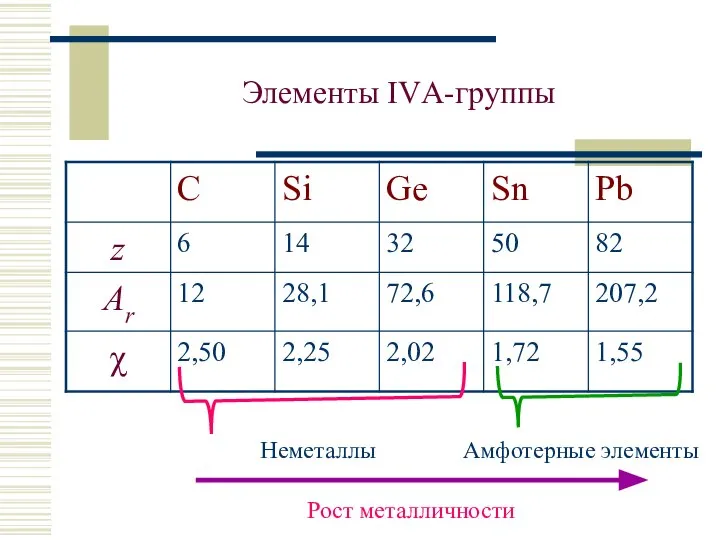
- 2. Элементы IVА-группы Неметаллы Амфотерные элементы
- 3. Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Si, Ge, Sn,
- 4. Оксиды элементов IVА-группы +IV CO2(г) уст. SiO2(т) уст. GeO2(т) уст. SnO2(т) уст. PbO2(т) с.окисл. +II CO
- 5. Водородные соединения элементов IVА-группы СH4 SiH4 GeH4 SnH4 PbH4 неуст. Склонность к катенации (образование цепей состава
- 6. Простые вещества Аллотропия Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Олово «белое» и «серое». Структура
- 7. Химические свойства При комн. темп. С, Si, Ge + H2O ≠ С, Si, Ge + H3O+
- 8. Химические свойства С(т) + KOH ≠ Si + 4NaOH = Na4SiO4 + 2H2↑ Si + 8OH–
- 9. Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]– +
- 10. Распространение в природе и важнейшие минералы 2. Si 25,80% (27,72% в литосфере) 13. C 0,087% (0,032%
- 11. Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты
- 12. Германий, олово и свинец
- 13. Шкала степеней окисления углерода CO2, CO32−, H2CO3, Na2CO3, CS2, CF4, CCl2O, C(NH2)2O CO, HCN, C2F4 C
- 14. Графит Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль
- 15. Алмаз Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация).
- 16. Карбин и фуллерен Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300
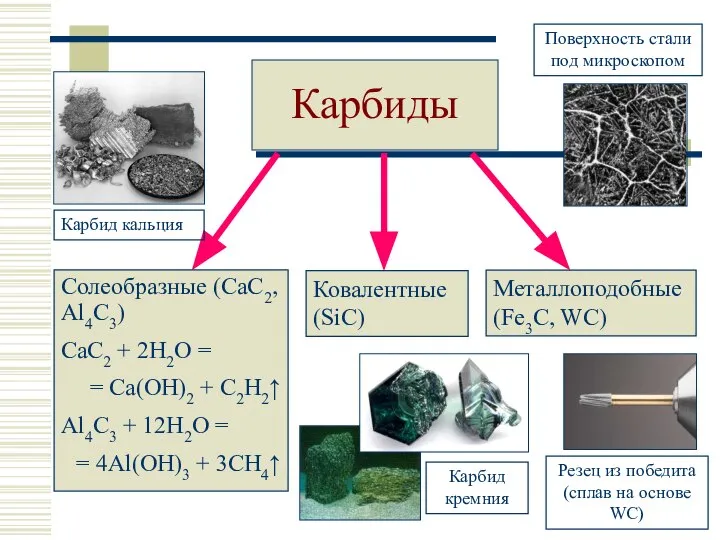
- 17. Карбиды
- 18. Водородные соединения. Метан CH4 СН4 – газ без цвета и запаха, горюч, главная сост. часть природного
- 19. Монооксид углерода CO – несолеобразующий оксид Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип.
- 20. Монооксид углерода CO Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. : C ::: O Обнаружение:
- 21. Диоксид углерода CO2 (кислотный оксид) Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при
- 22. Моногидрат CO2 . H2O и угольная кислота H2CO3 В водном растворе: CO2 (г) + H2O ⮀
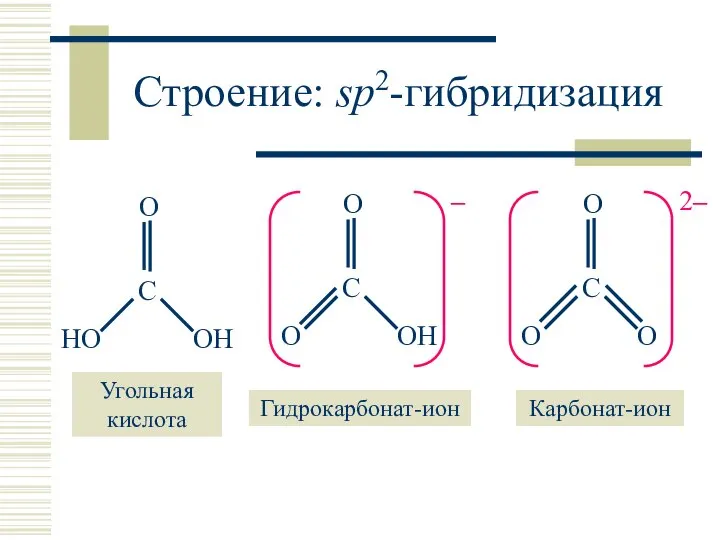
- 23. Строение: sp2-гибридизация
- 24. Карбамид и цианамид Синтез карбамида: NH4NCO ⮀ (NH2)2CO (+t) (Фридрих Вёлер, 1828 г.) Цианамид NH2CN и
- 25. Псевдогалогениды Циановодород HCN – бесцв.ж., т. пл. –13,3 °С, т.кип. +25,6°С). В водн. р-ре – слабая
- 26. Псевдогалогениды Тиоцианат водорода HNCS («родановодород») не ядовит. В водном растворе HNCS - сильная к-та Ион NCS−
- 27. Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO↑ + 8H2O Si +
- 28. Водородные соединения SinH2n+2 (силаны) Моносилан SiH4: SiH4 + 2O2 = SiO2 + 2H2O Получение силанов: SiO2
- 29. Кислородные соединения Полиморфизм диоксида кремния: кварц тридимит кристобалит SiO2(ж) (расплав) SiO2 GeO2 + H2O ≠ SiO2
- 30. Травление стекла SiO2 + 4HF = SiF4↑ + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] +
- 32. Скачать презентацию
![Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257188/slide-2.jpg)















![Монооксид углерода CO Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257188/slide-19.jpg)





![Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257188/slide-26.jpg)



 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы
Ученица 10 «А» класса Ахметгалеева Алина МБОУ «Гимназия» Сабинского района п.г.т. Б.Сабы Классификация органических соединений. (10 класс)
Классификация органических соединений. (10 класс) Оксиды, их применение
Оксиды, их применение Презентация Коррозия
Презентация Коррозия Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Вещества и материалы. Классификация веществ. Индикаторы. 6 класс
Вещества и материалы. Классификация веществ. Индикаторы. 6 класс Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Нуклеиновые кислоты
Нуклеиновые кислоты Пластмаса
Пластмаса  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Строение вещества
Строение вещества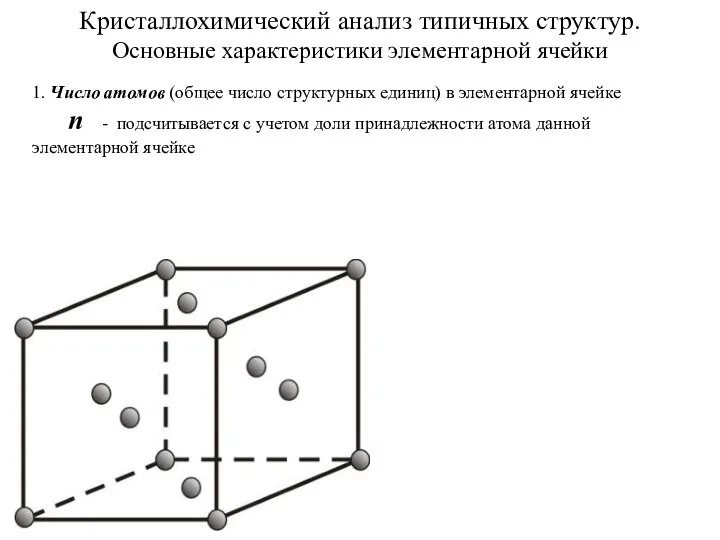 Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки
Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники Общие электронные конфигурации элементов главных подгрупп
Общие электронные конфигурации элементов главных подгрупп Электролитическая диссоциация
Электролитическая диссоциация Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Cинтетичні миючі засоби і їхній вплив на людину
Cинтетичні миючі засоби і їхній вплив на людину  Алюминий и его соединения
Алюминий и его соединения Химические свойства и применение кислорода
Химические свойства и применение кислорода Лактоза
Лактоза Алканы (структурная изомерия и систематическая номенклатура)
Алканы (структурная изомерия и систематическая номенклатура)
 Полисульфидные каучуки
Полисульфидные каучуки Третья группа ПС
Третья группа ПС