Содержание
- 2. Тема урока: Закон Авогадро. Молярный объем газов
- 4. Открытие и формулировка закона Итальянский ученый Амедео Авогадро обратил внимание на то, что все газы одинаково
- 5. Закон Авогадро Амедео Авогадро (1776 – 1856) В равных объёмах различных газов при одинаковых условиях содержится
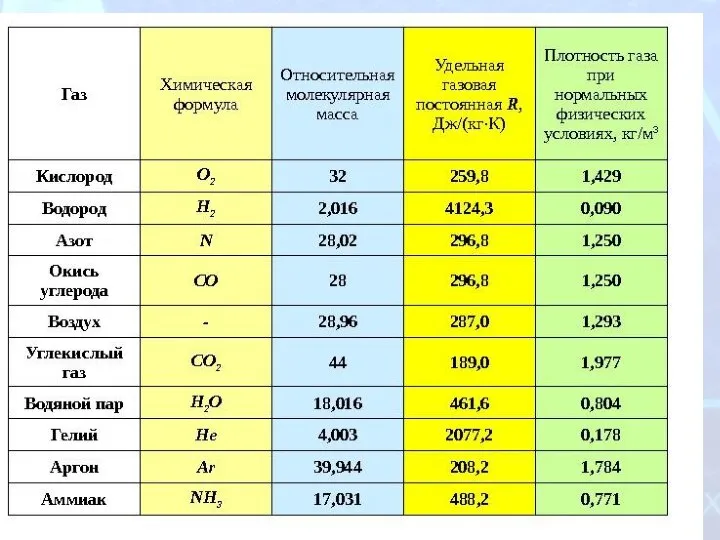
- 6. Объяснение закона Авогадро 1 следствие При н.у. 1 моль любого газа занимает объем, равный 22,4 л
- 7. Закрепление изученного материала Решите задачи: Какой объем занимает 0,2 моль N2 при н.у.? Дано: Решение: Vm
- 8. Закрепление изученного материала Решите задачи: Какое количество вещества содержит водород объемом 33,6 л при н.у.? Дано:
- 10. Скачать презентацию






 Обобщение по теме неметаллы
Обобщение по теме неметаллы Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул Презентация по Химии "Аммиак" - скачать смотреть
Презентация по Химии "Аммиак" - скачать смотреть  Легированные конструкционные стали. Инструментальные легированные стали
Легированные конструкционные стали. Инструментальные легированные стали Органика.
Органика. Презентация по Химии "Свойства комплексных соединений" - скачать смотреть
Презентация по Химии "Свойства комплексных соединений" - скачать смотреть  Уголь активированный
Уголь активированный Свойства аммиачной селитры
Свойства аммиачной селитры Кристаллы в нашей жизни
Кристаллы в нашей жизни Эрбий. Жалпы сипаттамасы
Эрбий. Жалпы сипаттамасы Реакция хлорметилирования
Реакция хлорметилирования Решаем задачи «Домашняя аптечка» Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск
Решаем задачи «Домашняя аптечка» Карпухина Ирина Степановна Учитель химии МБОУ СОШ № 32 Город Новосибирск СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Встановлення просторової будови, відносної конфігурації
Встановлення просторової будови, відносної конфігурації Элементы побочной подгруппы IV
Элементы побочной подгруппы IV Презентация по Химии "Щелочные металлы" - скачать смотреть _
Презентация по Химии "Щелочные металлы" - скачать смотреть _ Силикатная промышленность
Силикатная промышленность Молекулярно-кинетические свойства дисперсных систем. Лекция 09
Молекулярно-кинетические свойства дисперсных систем. Лекция 09 Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона
Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона Основания. Физические и химические свойства оснований
Основания. Физические и химические свойства оснований Металлы. Особенности строения атомов металлов и их положения в ПСХЭ. Физические свойства
Металлы. Особенности строения атомов металлов и их положения в ПСХЭ. Физические свойства Технология гидролизных производств
Технология гидролизных производств Значение химии в повседневной жизни
Значение химии в повседневной жизни Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву
Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву Щелочные металлы
Щелочные металлы Предупреждение некоторых видов коррозии
Предупреждение некоторых видов коррозии Фазовые равновесия и учение о растворах
Фазовые равновесия и учение о растворах