Содержание
- 2. горение
- 3. сгорание топлива
- 4. Получение металлов
- 5. коррозия металлов и сплавов
- 6. Брожение Гниение
- 7. фотосинтез это единственно важный первичный источник энергии для всего живого 6CO2 + 6H2O -> C6H12O6 +
- 8. ОВР- это такие реакции, при которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих
- 9. Cуть ОВР- переход электронов от одних атомов, молекул или ионов к другим.
- 10. ОКИСЛЕНИЕ – ОТДАЧА ЭЛЕКТРОНОВ (повышение с.о.) ВОССТАНОВЛЕНИЕ-ВЗЯТИЕ ЭЛЕКТРОНОВ (понижение с.о.)
- 11. Восстановители (отдающие электроны): металлы, водород, уголь, СO,сероводород, аммиак. Окислители(принимающие электроны): O2 ,галогены, азотная и серная кислоты,KMnO4
- 12. Внимание!!! Самостоятельная работа...
- 13. Лабораторные опыты:
- 14. ЛАБОРАТОРНЫЙ ОПЫТ №1 Zn + HCl = КУСОЧЕК ЦИНКА ОПУСТИТЕ В ПРОБИРКУ С РАСТВОРОМ СОЛЯНОЙ КИСЛОТЫ
- 15. Zn + 2HCl = ZnCl2 + H 2
- 16. ЛАБОРАТОРНЫЙ ОПЫТ №2 Железный гвоздик опустите в раствор сульфата меди (II) Fe + CuSO4 =
- 17. Fe + CuSO4 = Cu + FeSO4
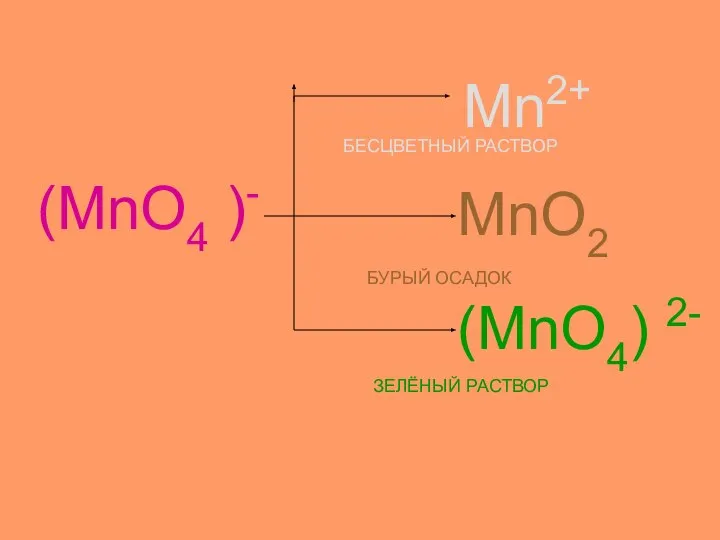
- 18. Демонстрационный опыт Раствор KMnO4 (малиновый) H2SO4 Среда кислая бесцветный Н2О Среда нейтральная бурый КOH Среда щелочная
- 19. (MnO4 )- Mn2+ MnO2 (MnO4) 2- БЕСЦВЕТНЫЙ РАСТВОР БУРЫЙ ОСАДОК ЗЕЛЁНЫЙ РАСТВОР
- 20. СОСТАВЬТЕ УРАВНЕНИЯ овр МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА: I вариант KMnO4 + K2SO3 +H2SO4 = II вариант KMnO4
- 21. выводы: 4)среда оказывает влияние на процесс. 1)овр чрезвычайно распространены; 2)суть овр-переход электронов от одних атомов,молекул или
- 23. Скачать презентацию



















 “Це потрібно не мертвим- це потрібно живим” Дослідницький проект групи “Пошук” Керівник:Задорожнюк Л.Л
“Це потрібно не мертвим- це потрібно живим” Дослідницький проект групи “Пошук” Керівник:Задорожнюк Л.Л  Самый популярный овощ
Самый популярный овощ Растения – производители. («Окружающий мир» А.А.Вахрушев и др., 3 класс) Составила: М.А.Абрамова, учитель начальных классов, 1 ква
Растения – производители. («Окружающий мир» А.А.Вахрушев и др., 3 класс) Составила: М.А.Абрамова, учитель начальных классов, 1 ква Детство. Новейшая история
Детство. Новейшая история История самолётостроения в России
История самолётостроения в России Тестовые задания 4 класс - презентация к уроку Окружающий мир_
Тестовые задания 4 класс - презентация к уроку Окружающий мир_ Моральная оценка личности
Моральная оценка личности Люди вокруг нас
Люди вокруг нас Озеркинская организация пенсионеров: Пенсио
Озеркинская организация пенсионеров: Пенсио Урок в 7 классе Холодный батик (солевая техника) Автор: учитель ИЗО и черчения Высшей Категории МОУ Гимназии № 23 г. Челябинска Ог
Урок в 7 классе Холодный батик (солевая техника) Автор: учитель ИЗО и черчения Высшей Категории МОУ Гимназии № 23 г. Челябинска Ог Конвенция о правах ребенка Принята резолюцией 44/25 Генеральной Ассамблеи от 20 ноября 1989 года. Вступила в силу 2 сентября 1990 года.
Конвенция о правах ребенка Принята резолюцией 44/25 Генеральной Ассамблеи от 20 ноября 1989 года. Вступила в силу 2 сентября 1990 года. Семья. Семейные традиции
Семья. Семейные традиции Эвакуация из населенного пункта
Эвакуация из населенного пункта  Презентация на тему "Какие знания должны быть сформированы у будущих первоклассников" скачать
Презентация на тему "Какие знания должны быть сформированы у будущих первоклассников" скачать  Герои Социалистического труда Большого Театра
Герои Социалистического труда Большого Театра Самопознание
Самопознание  Понятие об обществе
Понятие об обществе Кто нас защищает? Подготовил Мащенко М.А. Ученик 3 класса Б Школы №544
Кто нас защищает? Подготовил Мащенко М.А. Ученик 3 класса Б Школы №544 Студенттік Парламентінің есебі
Студенттік Парламентінің есебі Библейские мотивы в творчестве Б.Пастернака «Я понял, что, к примеру, Библия есть не столько книга с твердым текстом, сколько запис
Библейские мотивы в творчестве Б.Пастернака «Я понял, что, к примеру, Библия есть не столько книга с твердым текстом, сколько запис Презентация на тему "Чайный этикет как основа английской чайной традиции" скачать
Презентация на тему "Чайный этикет как основа английской чайной традиции" скачать  Название проекта:
Название проекта:  Автор: Ким Н. В. Учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год.
Автор: Ким Н. В. Учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год. «Мода ПЛЮС» Автор: Чешева Ирина Ивановна, педагог дополнительного образования детей МОУДОД «Центр детского творчества» п.Грибан
«Мода ПЛЮС» Автор: Чешева Ирина Ивановна, педагог дополнительного образования детей МОУДОД «Центр детского творчества» п.Грибан Презентация на тему "8 марта" скачать
Презентация на тему "8 марта" скачать  Методы социологического исследования
Методы социологического исследования « КЕМ БЫТЬ?» КЛАССНЫЙ ЧАС в 11 КЛАССЕ
« КЕМ БЫТЬ?» КЛАССНЫЙ ЧАС в 11 КЛАССЕ Жизнь со знаком +. Профилактика наркомании, токсикомании, алкоголизма и иных химических зависимостей
Жизнь со знаком +. Профилактика наркомании, токсикомании, алкоголизма и иных химических зависимостей