Содержание
- 2. Регенеративной, т. е. с извлечением вещества из адсорбента и его утилизацией. Деструктивной, при которой извлеченные из
- 3. В общем случае процесс адсорбции складывается из трех стадий: 1) переноса вещества из сточной воды к
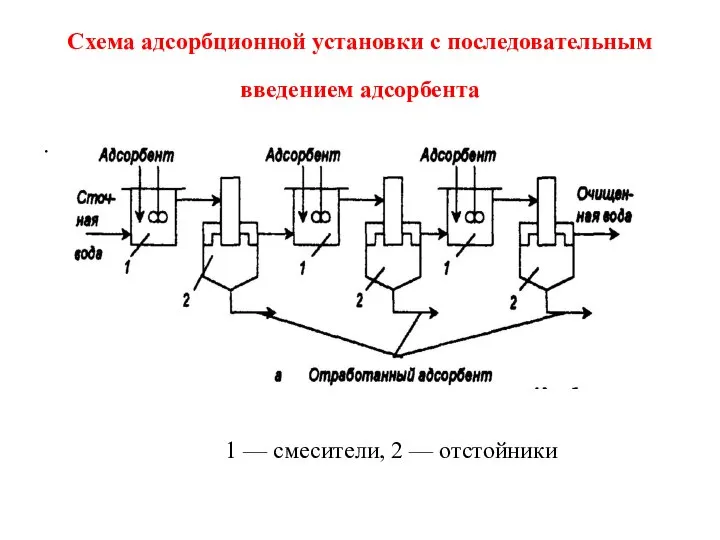
- 4. Схема адсорбционной установки с последовательным введением адсорбента . 1 — смесители, 2 — отстойники
- 5. Расход адсорбента для одноступенчатого процесса определяют из уравнения материального баланса: где m — расход адсорбента; Q
- 6. где - Ср равновесная концентрация вещества Регенерация адсорбента. Адсорбированные вещества из угля извлекают десорбцией насыщенным или
- 7. Ионный обмен. Ионообменная очистка применяется для извлечения из сточных вод металлов (цинка, меди, хрома, никеля, свинца,
- 8. Сущность ионного обмена. Ионный обмен представляет собой процесс взаимодействия раствора с твердой фазой, обладающей свойствами обменивать
- 9. Поглотительная способность ионитов характеризуется обменной емкостью, которая определяется числом эквивалентов ионов, поглощаемых единицей массы или объема
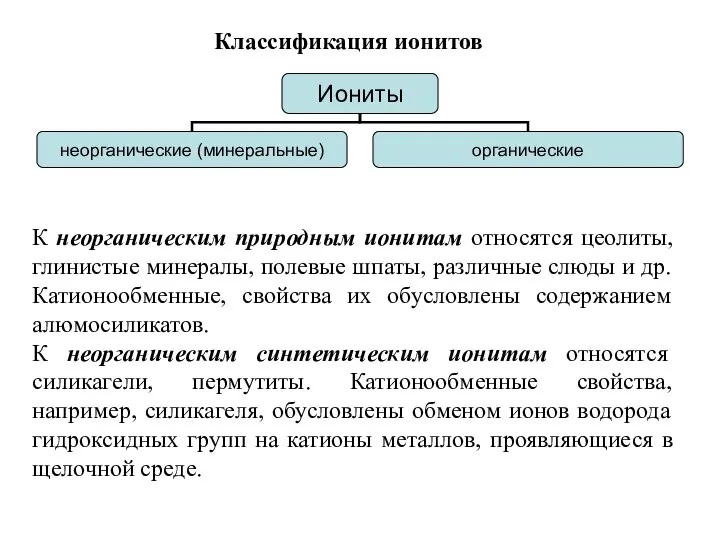
- 10. Классификация ионитов К неорганическим природным ионитам относятся цеолиты, глинистые минералы, полевые шпаты, различные слюды и др.
- 11. Органические природные иониты — это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. К органическим
- 12. При сокращенном написании ионита матрицу обозначают в общем виде (R), а активную группу указывают полностью. Например,
- 13. Реакция ионного обмена протекает следующим образом: а) при контакте с катионитом RS03H+NaСI= RS03Na + HСI б)
- 14. Процесс переноса вещества может быть представлен в виде нескольких стадий: 1) перенос ионов А из ядра
- 15. Регенерация ионитов. Катиониты регенерируют 2-8% растворами кислот. При этом они переходят в Н-форму. Регенерационные растворы —
- 17. Скачать презентацию












 Мечников Илья Ильич Составитель Большаков С. В.
Мечников Илья Ильич Составитель Большаков С. В. ПРЕЗЕНТАЦИЯ К ВНЕКЛАССНОМУ МЕРОПРИЯТИЮ « Ток-шоу со старшеклассниками « Профессия – Учитель» Подготовила учитель Краснова Окса
ПРЕЗЕНТАЦИЯ К ВНЕКЛАССНОМУ МЕРОПРИЯТИЮ « Ток-шоу со старшеклассниками « Профессия – Учитель» Подготовила учитель Краснова Окса Презентация на тему "Путешествие в страну "Бизнеса"" скачать
Презентация на тему "Путешествие в страну "Бизнеса"" скачать  закономірності та принципи навчання. Лекція 9
закономірності та принципи навчання. Лекція 9 СВЯТОЙ ПРЕПОДОБНЫЙ СЕРГИЙ РАДОНЕЖСКИЙ
СВЯТОЙ ПРЕПОДОБНЫЙ СЕРГИЙ РАДОНЕЖСКИЙ Поставщики социальных услуг
Поставщики социальных услуг Дети-детям. Региональный конкурс детских социальных проектов и инициатив
Дети-детям. Региональный конкурс детских социальных проектов и инициатив Отчет о проделанной работе Объединения молодых педагогов г. Алчевска. Проект Цифровые волонтеры
Отчет о проделанной работе Объединения молодых педагогов г. Алчевска. Проект Цифровые волонтеры Презентация "Огонь - наш друг и враг" - скачать презентации по ОБЖ
Презентация "Огонь - наш друг и враг" - скачать презентации по ОБЖ Структура населения по брачному и семейному состоянию
Структура населения по брачному и семейному состоянию Управление консигнационным запасом в розничной торговле SAP Best Practices
Управление консигнационным запасом в розничной торговле SAP Best Practices  Конституционное право Р.Ф. как наука и отрасль права.
Конституционное право Р.Ф. как наука и отрасль права. Гром и молния Загадки природы
Гром и молния Загадки природы  Субъекты гражданского права Абдрашитова Ю.В., учитель истории и обществознания МОУ СОШ № 17 г. Твери
Субъекты гражданского права Абдрашитова Ю.В., учитель истории и обществознания МОУ СОШ № 17 г. Твери ИССЛЕДОВАНИЕ СЛОВА КОТ
ИССЛЕДОВАНИЕ СЛОВА КОТ Мониторинг внедрения национальной социальной инициативы в Самарской области
Мониторинг внедрения национальной социальной инициативы в Самарской области Презентация на тему "О Матери" скачать
Презентация на тему "О Матери" скачать  ДЕЛОВОЕ ОБЩЕНИЕ - презентация к уроку Окружающий мир
ДЕЛОВОЕ ОБЩЕНИЕ - презентация к уроку Окружающий мир Презентация на тему "деньги и их функции" скачать
Презентация на тему "деньги и их функции" скачать  Школа социологии
Школа социологии Миссия Челябинской Школы Общественного Здоровья - презентация к уроку Окружающий мир
Миссия Челябинской Школы Общественного Здоровья - презентация к уроку Окружающий мир Корпоративные ценности. Служба занятости населения Удмуртии
Корпоративные ценности. Служба занятости населения Удмуртии Лидер XXI века
Лидер XXI века  Комплексный центр социальной адаптации инвалидов
Комплексный центр социальной адаптации инвалидов Социальная структура личности
Социальная структура личности Сушникова Елена
Сушникова Елена  Презентация "Последствия гидродинамических аварий" - скачать презентации по ОБЖ
Презентация "Последствия гидродинамических аварий" - скачать презентации по ОБЖ НАРКОМАНИЯ
НАРКОМАНИЯ