Содержание
- 2. Опасное химическое вещество (ОХВ) – химическое вещество, прямое или косвенное воздействие которого на человека может вызвать
- 3. Предприятия, относящиеся к химически опасным объектам. Химическая Целлюлозно-бумажная Оборонная Нефтеперерабатывающая Нефтехимическая Пищевая Текстильная
- 4. Предприятия – потребители АХОВ. Чёрная и цветная металлургия Целлюлозно-бумажная промышленность Машиностроение и оборонная промышленность Коммунально-бытовое хозяйство
- 5. По степени воздействия на организм человека вредные вещества подразделяются на четыре класса опасности: 1 класс –
- 6. Классификация АХОВ: 1. По степени воздействия на организм АХОВ: 1 класс – чрезвычайно опасные: фтористый водород,
- 7. Классификация АХОВ: 2. По стойкости воздействия : Стойкие: соляная кислота нитробензол серная кислота и др. 2.
- 8. Классификация АХОВ: 3. По токсическому проявлению: 1. Удушающего действия (хлор, хлорпикрин) 2. Удушающего и общеядовитого действия
- 9. Классификация АХОВ: 4. По агрегатному состоянию : 1. Газы (сжиженные и сжатые) 2. Жидкости 3. Твердые
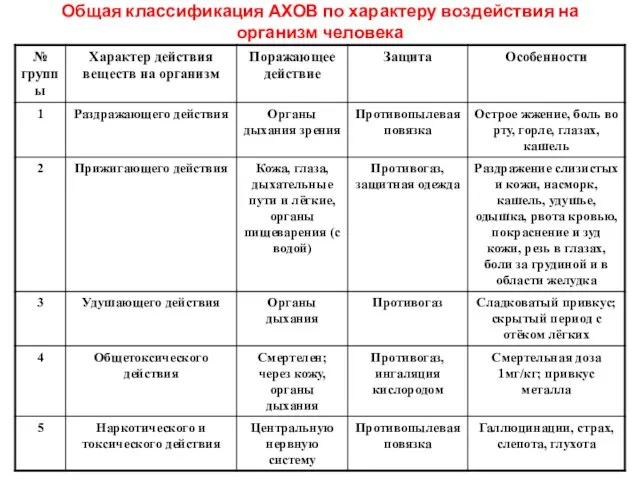
- 10. Общая классификация АХОВ по характеру воздействия на организм человека
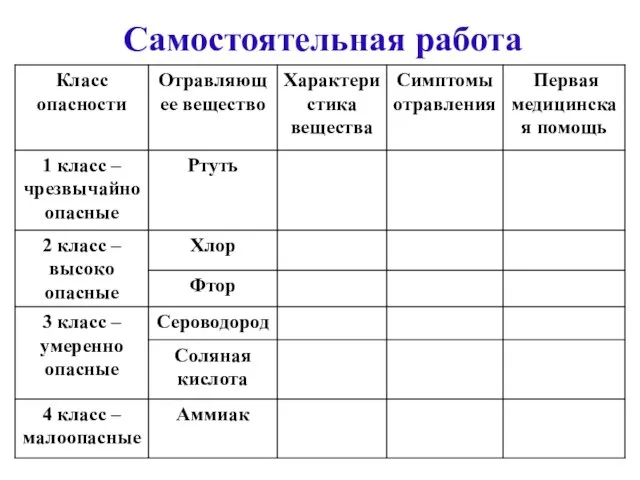
- 11. Самостоятельная работа
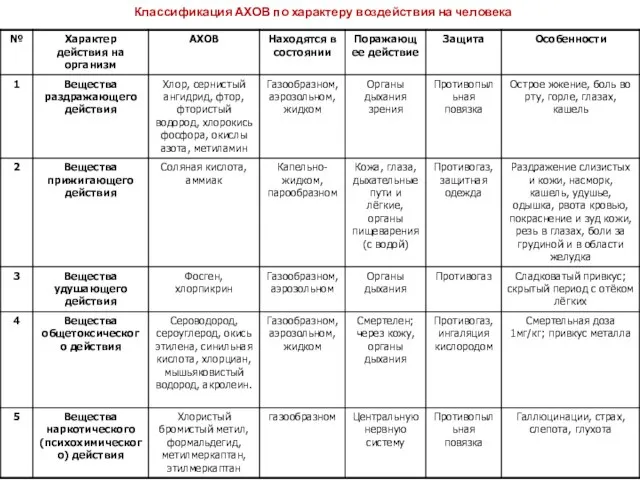
- 12. Классификация АХОВ по характеру воздействия на человека
- 13. Степени опасности АХОВ Первый класс ЧРЕЗВЫЧАЙНО ОПАСНЫЕ
- 14. Свинец Свинец — металл синевато-серого Плотность 11,3415 кг/дм3, температура плавления 327,50°C кипения 1715°C. Свинец мягок, легко
- 15. Второй класс ВЫСОКООПАСНЫЕ
- 16. ХЛОР Хлор – это ядовитый газ желтовато-зеленого цвета, входящий в группу галогенов, с характерным удушливым запахом,
- 17. Хлор Хлор — ядовитый удушливый газ, при попадании в легкие вызывает ожог легочной ткани, удушье. Раздражающее
- 18. Хранится и перевозится в жидком состоянии в специальных "танках" или стальных баллонах защитного цвета с зеленой
- 19. - Запах хлора в воздухе ощущается при концентрации 2-3 мг\м3, - в концентрации 0,01 г/м3 хлор
- 20. В мирное время легкие формы отравления хлором возможны при частом посещении бассейна, при отбеливании белья или
- 21. Симптомы отравления и тяжесть состояния пострадавших зависят от концентрации хлора в воздухе или воде и продолжительности
- 22. Первая помощь при отравлении хлором промывание глаз, носа, ротовой полости и желудка большим количеством воды или
- 23. Фтор Фтор — газ (плотность 1,693 кг/м3) с резким запахом. Температура кипения –188,14°C. Бледно-желтый газ с
- 24. Физические свойства фтора Фтор – ядовитый газ. В обычных условиях фтор – газ бледно-желтого цвета, с
- 25. Отравление фтором и его соединениями Острые отравления фтором в производственных условиях наблюдаются крайне редко, лишь при
- 26. Мышьяк Мышьяк — серое с металлическим блеском хрупкое вещество Мышьяк и все его соединения ядовиты. При
- 27. Бром Химический элемент, красно-бурая дымящаяся на воздухе едкая жидкость, употребляется в химии, а также в медицине,
- 28. Ртуть Ртуть — серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Ртуть и
- 29. Третий класс УМЕРЕННО ОПАСНЫЕ
- 30. Ожоги серной кислотой
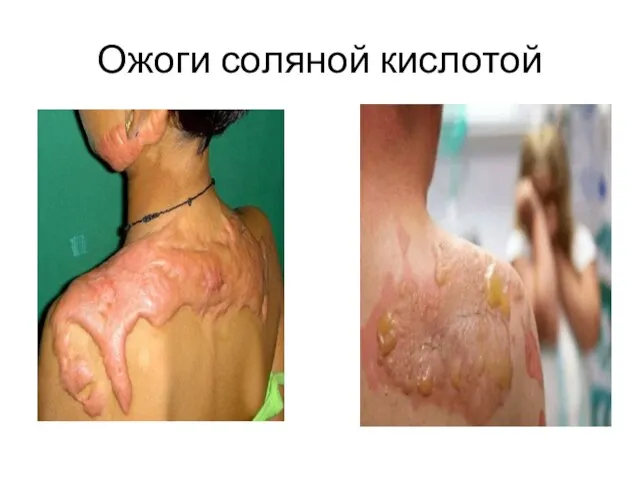
- 31. Ожоги соляной кислотой
- 32. Серная кислота СЕРНАЯ КИСЛОТА, сильная двухосновная кислота. Безводная серная кислота — бесцветная маслянистая жидкость, плотность 1,9203
- 33. Соляная кислота СОЛЯНАЯ КИСЛОТА (хлористоводородная кислота), раствор хлористого водорода в воде; сильная кислота. Бесцветная, «дымящая» на
- 34. Азотная кислота АЗОТНАЯ КИСЛОТА, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см3, tпл —41,59 °C,
- 35. Уксусная кислота УКСУСНАЯ КИСЛОТА, бесцветная с резким запахом жидкость. Для безводной, т. н. «ледяной», кислоты tпл
- 36. Четвертый класс Малоопасные
- 37. Аммиак Аммиак - назв. нашатыря, который получали в оазисе Аммониум в Ливийской пустыне. Это бесцветный газ
- 38. Соединения фосфора Физиологическое действие фосфора Соединения фосфора токсичны. Смертельная доза белого фосфора — 50-150 мг. Попадая
- 39. Бомбардировка белым фосфором
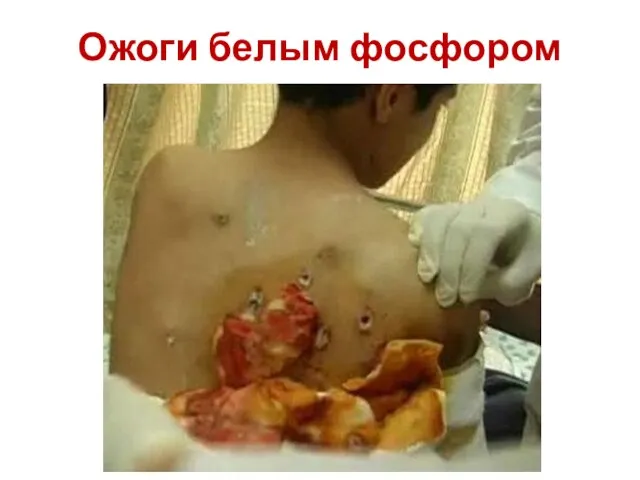
- 40. Ожоги белым фосфором
- 41. Фосген ФОСГЕН, бесцветный газ с запахом прелого сена, tкип 8,2 °С. Сырье в производстве красителей, мочевины,
- 43. Скачать презентацию



































 Огнестрельные ранения. Хирургическая обработка огнестрельных ран
Огнестрельные ранения. Хирургическая обработка огнестрельных ран Ликвидация чрезвычайных ситуаций. Основы организации аварийно-спасательных и других неотложных работ
Ликвидация чрезвычайных ситуаций. Основы организации аварийно-спасательных и других неотложных работ Первая помощь при обмороке
Первая помощь при обмороке Негативний вплив наркотиків
Негативний вплив наркотиків Алкоголизм. Причины, симптомы, описание и решение проблемы
Алкоголизм. Причины, симптомы, описание и решение проблемы Оповещение населения об опасностях, возникающих в ЧС мирного и военного времени
Оповещение населения об опасностях, возникающих в ЧС мирного и военного времени Химическая разведка и контроль
Химическая разведка и контроль Производственная безопасность. Часть 3. Требования промышленной безопасности
Производственная безопасность. Часть 3. Требования промышленной безопасности Бережи здоров`я
Бережи здоров`я Алкоголь.Что такое «Зависимость»?
Алкоголь.Что такое «Зависимость»? Структура Федерального закона «О пожарной безопасности»
Структура Федерального закона «О пожарной безопасности» Соблюдение правил дорожного движения. Ремень безопасности
Соблюдение правил дорожного движения. Ремень безопасности Пешеходное движение
Пешеходное движение Здоровое питание, здоровый образ жизни
Здоровое питание, здоровый образ жизни Правила поведения при нападении собак
Правила поведения при нападении собак Правила поведения во время осенних каникул
Правила поведения во время осенних каникул Классификация чрезвычайных ситуаций
Классификация чрезвычайных ситуаций Правила безопасного поведения и защита населения при радиационных авариях
Правила безопасного поведения и защита населения при радиационных авариях Окружающая среда и здоровье человека
Окружающая среда и здоровье человека Требования к сосудам под давлением в РФ
Требования к сосудам под давлением в РФ Огонь, друг и враг человека
Огонь, друг и враг человека Анализ опасностей и принятие решений в области обеспечения БЖД
Анализ опасностей и принятие решений в области обеспечения БЖД Как правильно буксировать автомобиль и за что можно получить штраф
Как правильно буксировать автомобиль и за что можно получить штраф Безопасность. Отдел обучения Ishida Europe
Безопасность. Отдел обучения Ishida Europe Медицина катастроф
Медицина катастроф Курение как фактор риска здоровью
Курение как фактор риска здоровью Формирование понятия пожарная безопасность. Овладение знаниями и умениями при действиях в чрезвычайных ситуациях
Формирование понятия пожарная безопасность. Овладение знаниями и умениями при действиях в чрезвычайных ситуациях Наркотики и их влияние на развитие полноценной личности
Наркотики и их влияние на развитие полноценной личности