Содержание
- 2. Состав атмосферы
- 3. Основные загрязнители атмосферы: пыль, SO2, NOx, CO, CO2, CnHm, аэрозоли тяжелых металлов и др.
- 4. Источники диоксида серы: природные - вулканы и лесные пожары, антропогенные - сжигание ископаемого топлива и обжиг
- 5. Источники оксидов азота NO и N02: природные - электрические разряды, при которых образуется NO, который впоследствии
- 6. СМОГ - аэрозоль, состоящий из дыма, тумана и пыли. Английское слово «smog» — производное от «smoke»
- 7. Лондонский (влажный) смог - сочетание газообразных и твердых примесей с туманом, как результат сжигания большого количества
- 8. Фотохимический смог: разновидность вторичного загрязнения атмосферы, когда из первичных загрязнителей образуются гораздо более высокотоксичные соединения; автомобильные
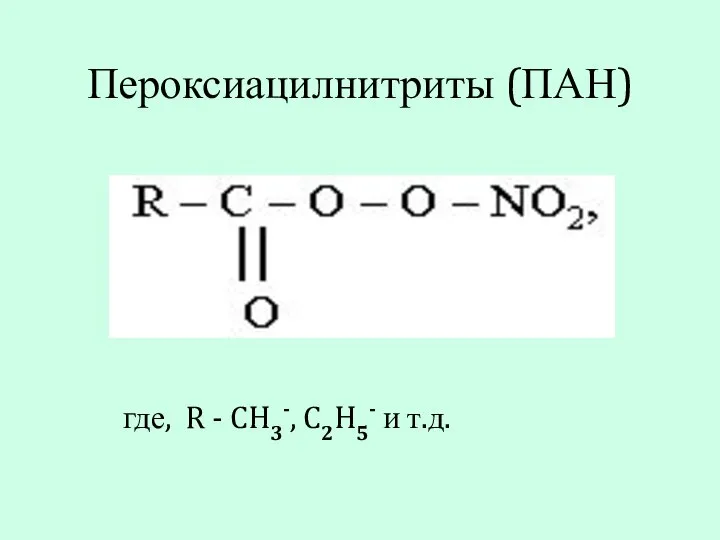
- 9. Пероксиацилнитриты (ПАН) где, R - CH3-, C2H5- и т.д.
- 10. Изменение концентраций компонентов фотохимического смога в разное время суток
- 11. Основные загрязнители атмосферы и источники их поступления Оксид углерода (СО) : дымовые газы любой установки сжигания
- 12. Основные загрязнители атмосферы и источники их поступления Углеводороды (CnHm ): дымовые газы теплоэнергетических установок, из хранилищ
- 13. Основные загрязнители атмосферы и источники их поступления Аэрозоли, тяжелые металлы: результат сжигания топлива, отходящие газы промышленных
- 14. Наиболее сложная экологическая обстановка складывается в регионах, где сосредоточены объекты тяжелой промышленности, нефтегазовой и горнорудной отраслей,
- 15. Особо опасные вещества, искусственно созданные человеком - ксенобиотики, экотоксиканты КСЕНОБИОТИКИ – любое чужеродное для данного организма
- 16. Особо опасные вещества, искусственно созданные человеком - ксенобиотики, экотоксиканты: диоксины-гетероциклические полихлорированные соединения, ДДТ –хлоорганические пестициды, в
- 17. Торговое название: ДДТ. Назначение: против комаров, вредителей хлопка, соевых бобов, арахиса . Химическое название - 1,1,1-Трихлор-2,2-бис
- 18. Диоксины .
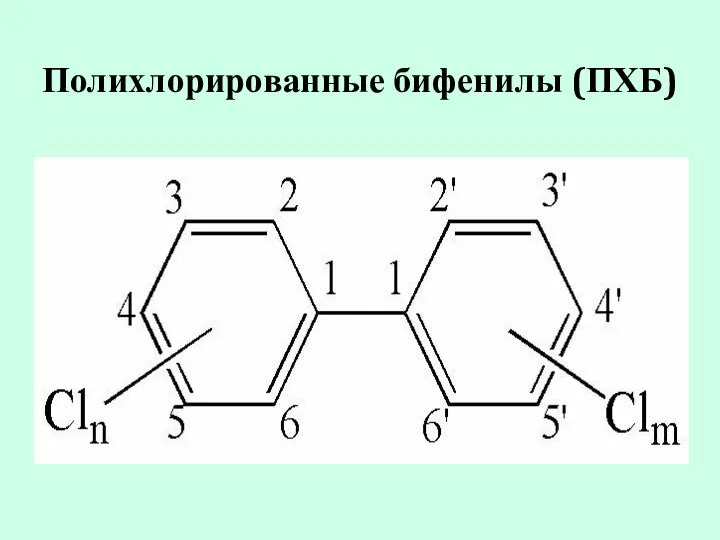
- 19. Полихлорированные бифенилы (ПХБ)
- 21. Парниковый эффект Парниковым может считаться любой газ, поглощающий в ИК-области и содержащийся в сколь угодно малых
- 22. Вклад парниковых газов в изменение радиационного баланса (2000 г.)
- 23. Кислотные осадки
- 24. Кислотность атмосферных осадков в России в 2002 г.
- 25. В естественных условиях атмосферные осадки обычно имеют нейтральную или слабо кислую реакцию, то есть показатель их
- 26. Кислотные осадки бывают двух типов: сухие, обычно выпадающие невдалеке от источника их поступления в атмосферу, влажные
- 28. Основные компоненты кислотных осадков: аэрозоли оксидов серы и азота (SOх и NОx), которые при взаимодействии с
- 29. Основные природные источники : извержения вулканов, лесные пожары, эрозия почв и др.
- 30. - процессы сжигания горючих ископаемых, главным образом угля, в тепловых электростанциях, в котельных, в металлургии, нефтехимической
- 31. Кислотные осадки
- 34. Основные пути снижения эмиссии оксидов азота и серы: понижение температуры сжигания угля, извлечение серы из отходящих
- 35. Виды ущерба от кислых осадков: деградация водных систем, гибель лесов, возрастание заболеваемость людей, ущерб зданиям, сооружениям
- 36. Исторические памятники Греции и Рима, простояв тысячелетия, в последние годы разрушаются прямо на глазах.
- 37. Такая же судьба грозит и Тадж-Махалу — шедевру индийской архитектуры периода Великих Моголов, в Лондоне —
- 38. На соборе Св. Павла в Риме слой портлендского известняка разъеден на 2,5 см. В Голландии статуи
- 39. Рациональное использование воздуха (газоочистка) «Всё, что попадает в воздух, рано или поздно возвращается на землю, чтобы
- 40. Ниже представлен вклад (%) в загрязнение атмосферного воздуха основных отраслей промышленности:
- 41. Зависимость эффективности улавливания от фракционного состава твёрдых частиц и аэрозолей в газовом потоке для различных типов
- 46. Очистка топочных газов от диоксида серы Известковый и известняковый методы Основные химические реакции, протекающие при взаимодействии
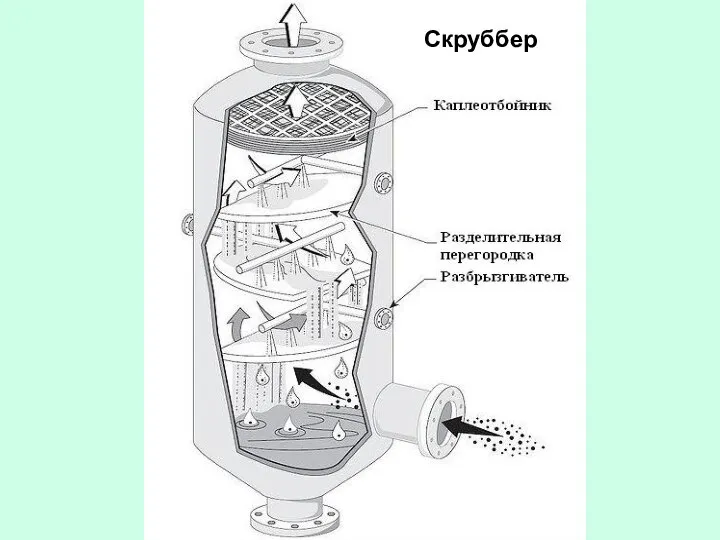
- 47. Скруббер
- 48. Абсорберы: а – форсуночный абсорбер, б – абсорбер с шаровой насадкой, в – пенный абсорбер.
- 49. Магнезитовый метод Сущность метода состоит во взаимодействии SO2 с суспензией Мg(ОН)2 по реакции: Мg(ОН)2 + SO2
- 50. Достоинствами магнезитового метода являются его цикличность, высокая эффективность (степень очистки 90-92%), возможность утилизации SO2 Основной недостаток
- 51. Очистка отходящих газов от оксидов азота Адсорбционные методы В случае небольших объемов газов нашли применение адсорбционные
- 52. Каталитическое восстановление Одним из основных, хорошо освоенных промышленных методов очистки отходящих газов от оксидов азота является
- 53. Наиболее широкое распространение получило селективное каталитическое восстановление оксидов азота аммиаком: 6 NO + 4NH3 ? 5
- 54. Карбамидный метод В РХТУ им. Д.И. Менделеева разработан Карбамидный метод, позволяющий очищать дымовые газы от оксидов
- 55. Рис…Схема установки для очистки дымовых газов от оксидов азота и серы с получением гипса: 1 –
- 56. Снижение выбросов оксидов азота в атмосферу путем регулирования процесса горения Наряду с установкой газоочистного оборудования в
- 57. Очистка отходящих газов от фтор- и хлорсодержащих соединений Очистка от фторсодержащих газов подробно описана в главе
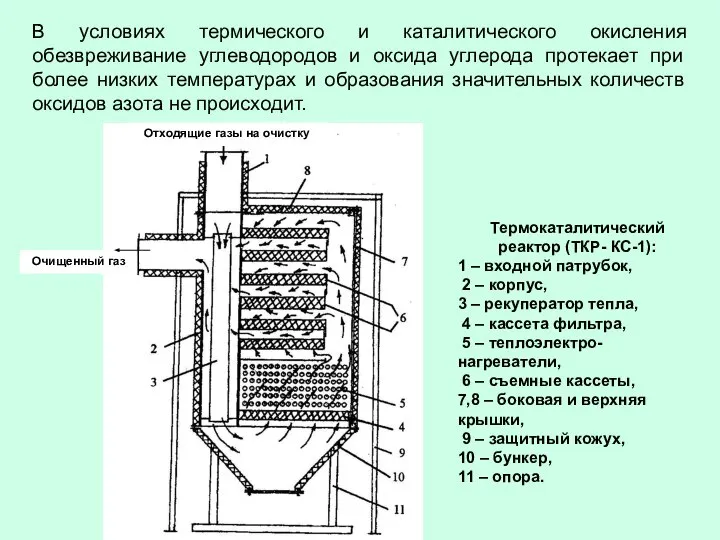
- 58. В условиях термического и каталитического окисления обезвреживание углеводородов и оксида углерода протекает при более низких температурах
- 59. Содержание загрязняющих веществ в дымовых газах при мусоросжигании
- 60. Рис.6.7. Мусоросжигательный завод № 2: – приемное отделение; 2 – приемный бункер ТБО; 3 – котлоагрегат;
- 62. Скачать презентацию























































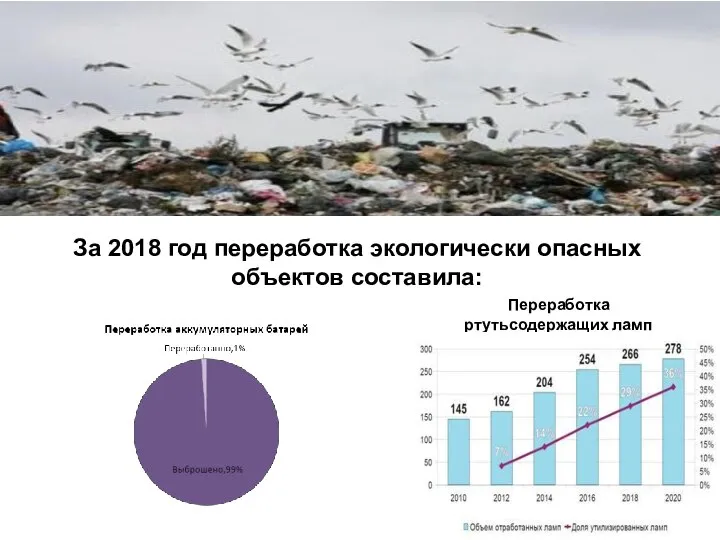 Переработка ртутьсодержащих ламп
Переработка ртутьсодержащих ламп Механічне забруднення
Механічне забруднення Литосфера. Экологические проблемы
Литосфера. Экологические проблемы Химия окружающей среды
Химия окружающей среды Табиғи ресурстар және табиғатты қолдану-тұрақты дамудың бір аспектісі
Табиғи ресурстар және табиғатты қолдану-тұрақты дамудың бір аспектісі Динамика экосистем
Динамика экосистем Проблемы загрязнения атмосферы и пути её решения
Проблемы загрязнения атмосферы и пути её решения Geohelminths eggs contamination of sandpits in Vladivostok, Russia
Geohelminths eggs contamination of sandpits in Vladivostok, Russia Аттестационная работа. Методическая разработка по выполнению индивидуального проекта “Забота об экологии окружающей среды”
Аттестационная работа. Методическая разработка по выполнению индивидуального проекта “Забота об экологии окружающей среды” Процесс утилизации на площадке ЗАО «Петромакс»
Процесс утилизации на площадке ЗАО «Петромакс» Тектұрмас күмбезі
Тектұрмас күмбезі Зеленая революция: сегодня и завтра
Зеленая революция: сегодня и завтра Влияние человека на окружающую среду
Влияние человека на окружающую среду Посадили мы цветы. Долгосрочный проект
Посадили мы цветы. Долгосрочный проект Экологическая ситуация в Богдановском лесопарке
Экологическая ситуация в Богдановском лесопарке Очистка сточных вод. Основные способы. Очистка сточных вод от твердых веществ и эмульсий
Очистка сточных вод. Основные способы. Очистка сточных вод от твердых веществ и эмульсий Популяция динамикасы. Экологиялық стратегиялар
Популяция динамикасы. Экологиялық стратегиялар Экологический критерий вида. Экологические закономерности, связанные с питанием животных
Экологический критерий вида. Экологические закономерности, связанные с питанием животных Реализация федерального закона о внесении изменений в федеральный закон об отходах производства и потребления
Реализация федерального закона о внесении изменений в федеральный закон об отходах производства и потребления Вы слыхали о воде?
Вы слыхали о воде? Экологические аспекты утилизации медицинских отходов в лечебно-профилактических учреждениях
Экологические аспекты утилизации медицинских отходов в лечебно-профилактических учреждениях Экологически грамотный потребитель
Экологически грамотный потребитель Окружающая среда
Окружающая среда Юные помощники природы
Юные помощники природы Определение запыленности воздуха по снегу
Определение запыленности воздуха по снегу Красная книга Челябинской области
Красная книга Челябинской области Екологічна етика
Екологічна етика Методы оценки запасов дикорастущих лекарственных растений. Правила сбора растений. Рациональное использование запасов
Методы оценки запасов дикорастущих лекарственных растений. Правила сбора растений. Рациональное использование запасов