Содержание
- 7. Проблемы возникающие при использовании ферментов в биотехнологических процессах: Повышенные температуры Экстремальные значения pH Высокие концентрации органических
- 8. Основные подходы для стабилизации ферментов : Добавление стабилизирующих веществ в среду, в которой хранится фермент или
- 9. Стабилизация ферментов с помощью: Субстратов или их аналогов: Фермент-субстратный комплекс часто более устойчив, чем свободный фермент.
- 10. Стабилизация ферментов с помощью: 2. Органических растворителей: Многоатомные спирты стабилизируют некоторые ферменты за счет повышения устойчивости
- 11. Стабилизация ферментов с помощью: 3. Солей: При низких концентрациях солей ( Са2+ способен стабилизировать третичную структуру
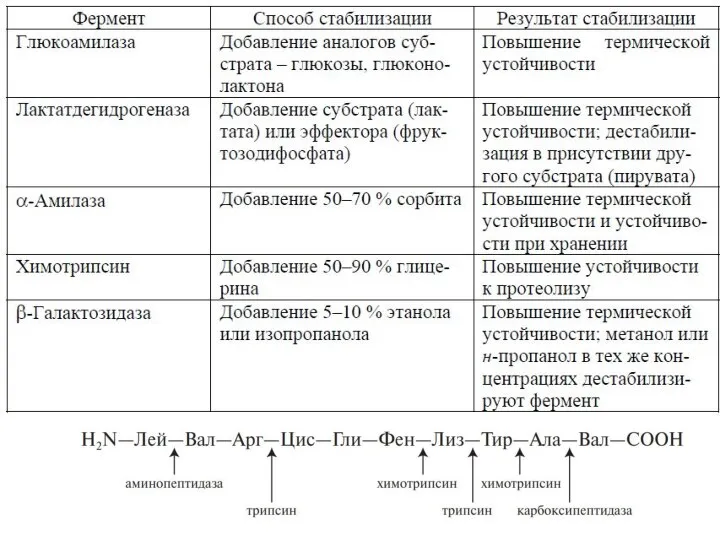
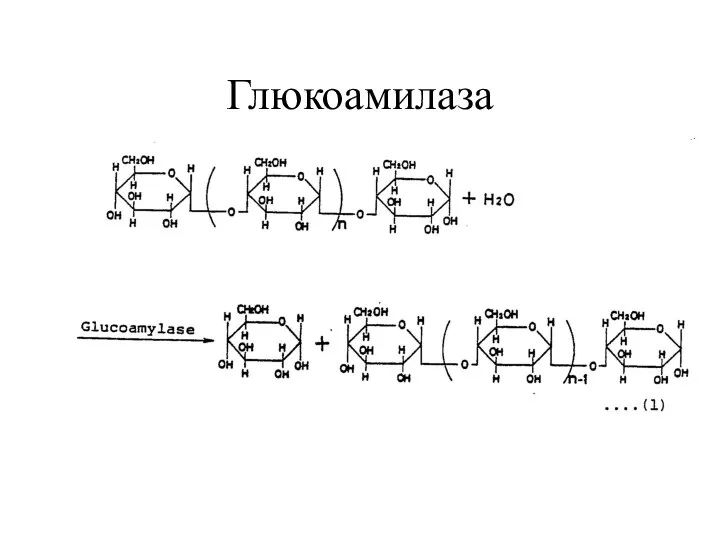
- 13. Глюкоамилаза
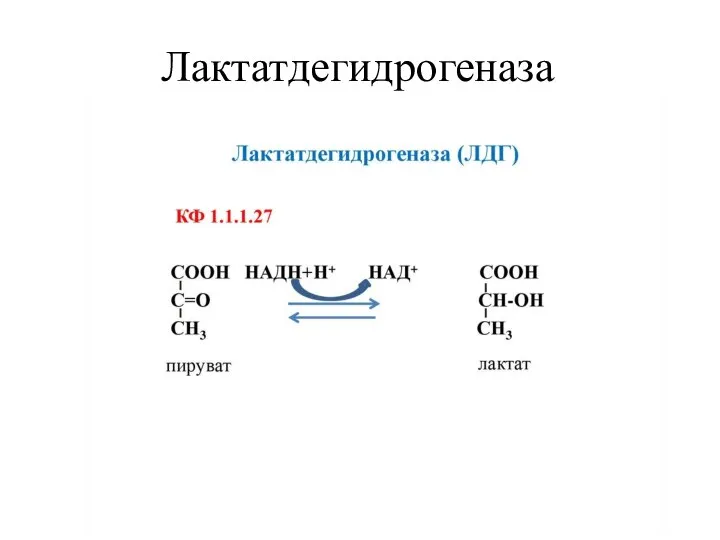
- 14. Лактатдегидрогеназа
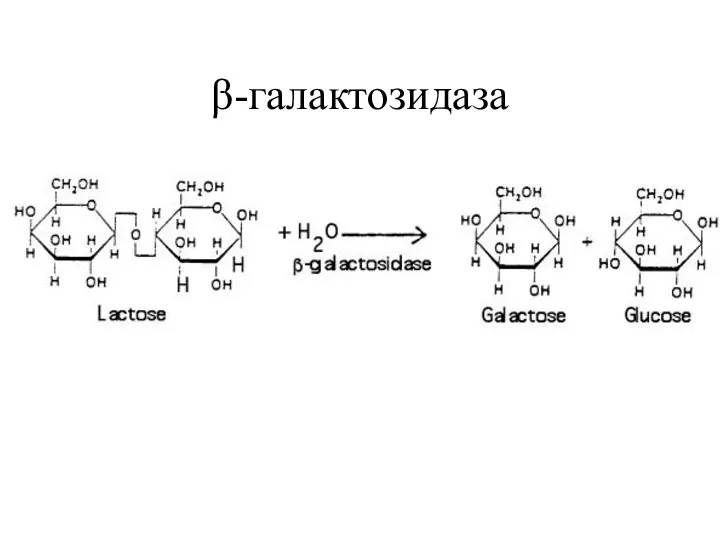
- 15. β-галактозидаза
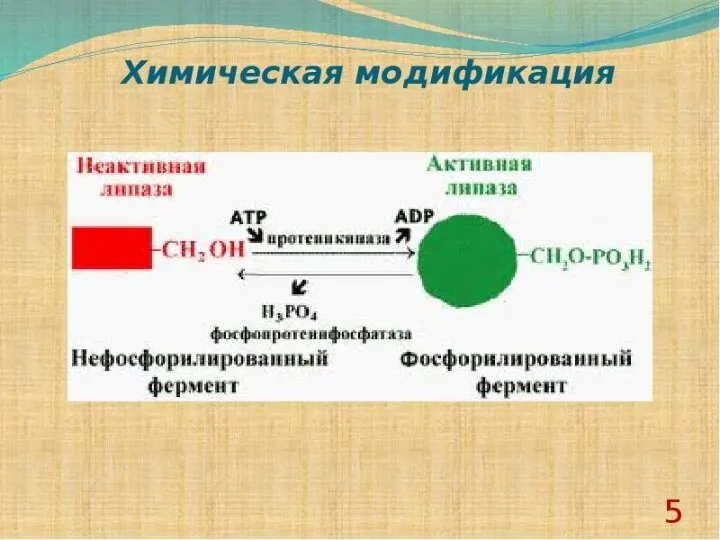
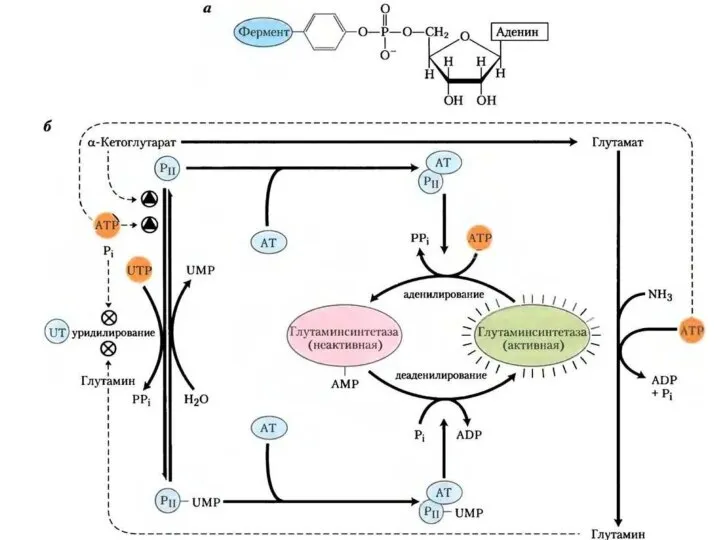
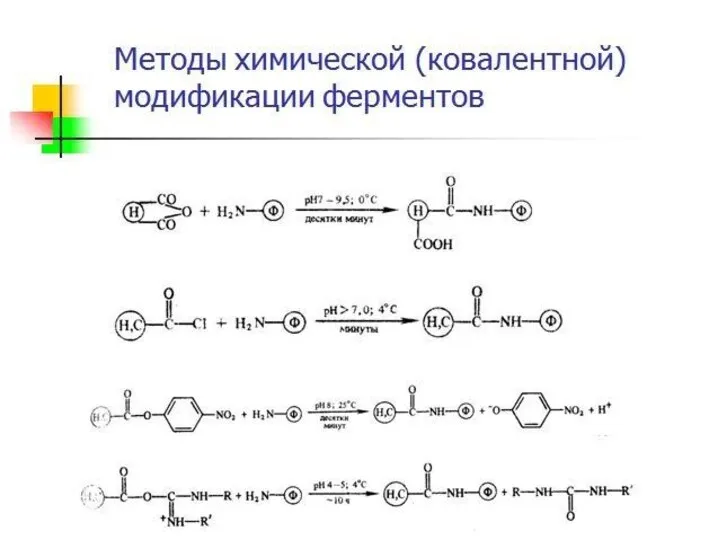
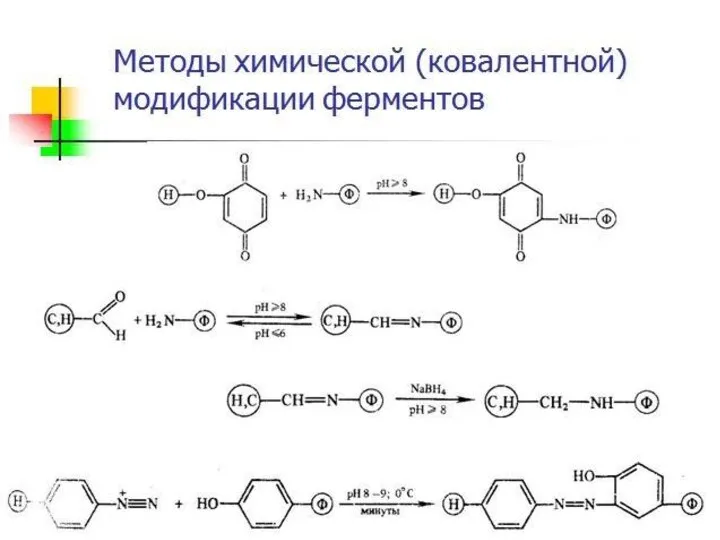
- 16. Химическая модификация фермента 1. Фермент принимает более стабильную конформацию. 2. Введение в белок новых функциональных групп
- 24. Иммобилизация фермента позволяет: Повысить устойчивость фермента (нагреванию, автолизу, действию агрессивных сред и т. д) Многократно использовать
- 25. Иммобилизованные ферменты – это препараты ферментов, молекулы которых связаны с носителем, сохраняя при этом полностью или
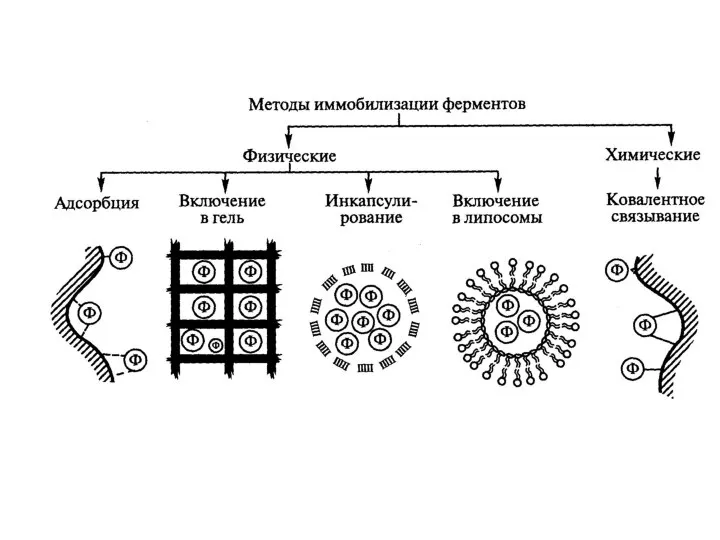
- 26. Методы иммобилизации: В качестве носителей могут применяться: 1)Органические материалы: 1.1) природные (полисахариды, белки, липиды) 1.2) синтетические
- 27. Методы физической иммобилизации: 1) адсорбция фермента на нерастворимом носителе в результате электростатических, гидрофобных, вандер-ваальсовых и др.
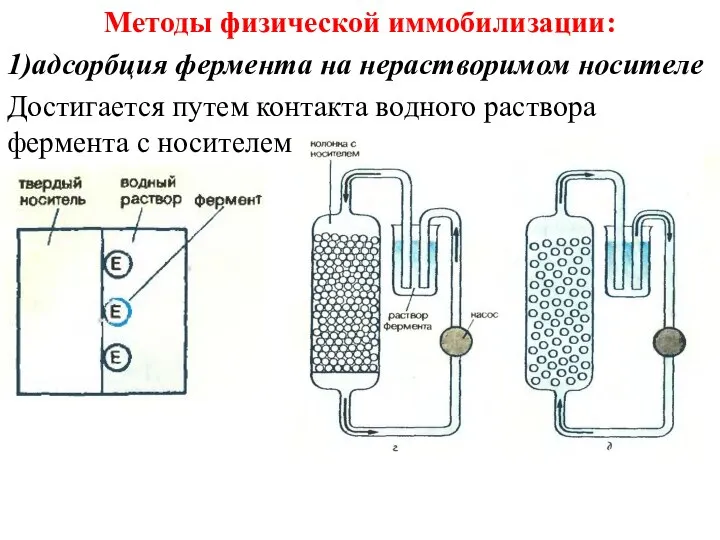
- 29. Методы физической иммобилизации: 1)адсорбция фермента на нерастворимом носителе Достигается путем контакта водного раствора фермента с носителем.
- 30. Методы физической иммобилизации: 1)адсорбция фермента на нерастворимом носителе Факторы влияющие на адсорбцию: Удельная поверхность и пористость
- 31. Методы физической иммобилизации: 1)адсорбция фермента на нерастворимом носителе Преимущества: Относительная простота методики Доступность носителей Недостатки: Недостаточная
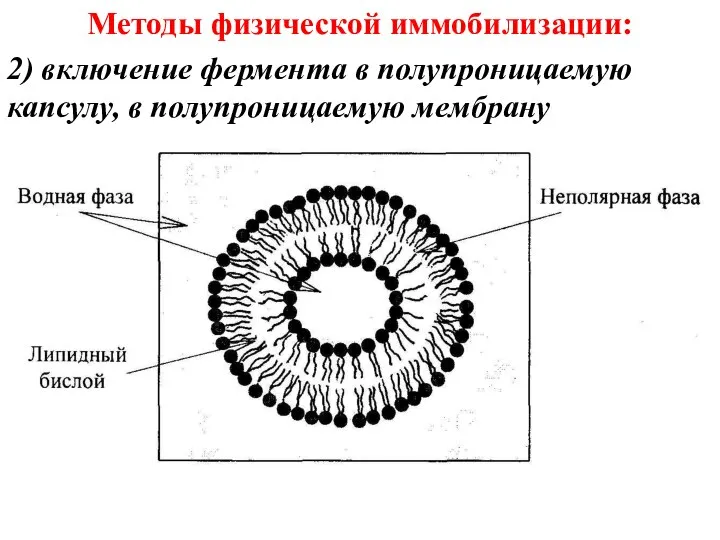
- 32. Методы физической иммобилизации: 2) включение фермента в полупроницаемую капсулу, в полупроницаемую мембрану
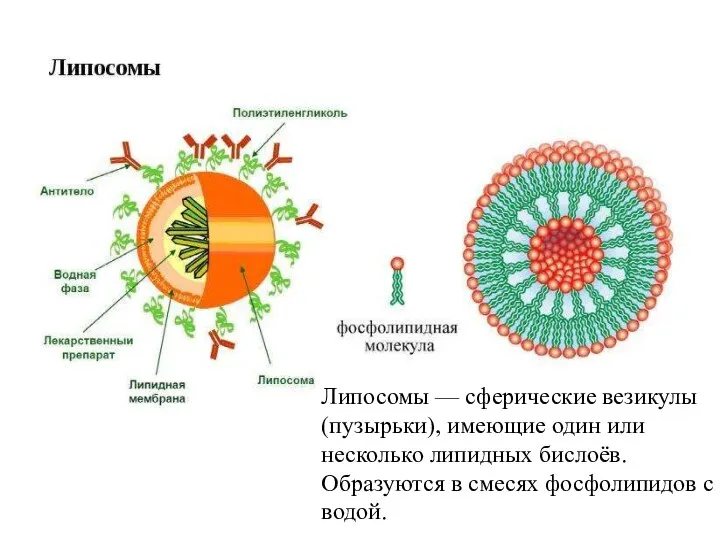
- 33. Липосомы — сферические везикулы (пузырьки), имеющие один или несколько липидных бислоёв. Образуются в смесях фосфолипидов с
- 34. Методы физической иммобилизации: 2) включение фермента в полупроницаемую капсулу, в полупроницаемую мембрану Преимущества: Относительная простота методики
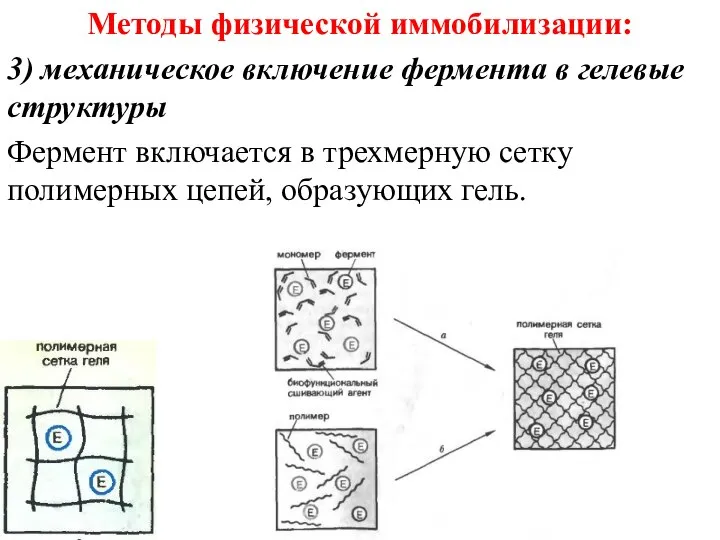
- 35. Методы физической иммобилизации: 3) механическое включение фермента в гелевые структуры Фермент включается в трехмерную сетку полимерных
- 37. Методы физической иммобилизации: 3) механическое включение фермента в гелевые структуры Необходимо учитывать: Соответствие размера пор размеру
- 38. Методы физической иммобилизации: 3) механическое включение фермента в гелевые структуры Преимущества: Относительная простота методики Повышенная механическая,
- 39. Методы физической иммобилизации: 4) Включение в двухфазную систему Фермент растворим только в одной из фаз, а
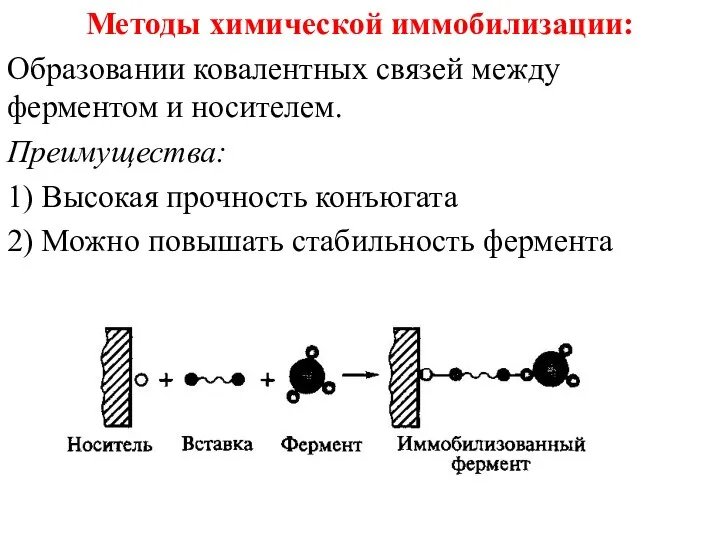
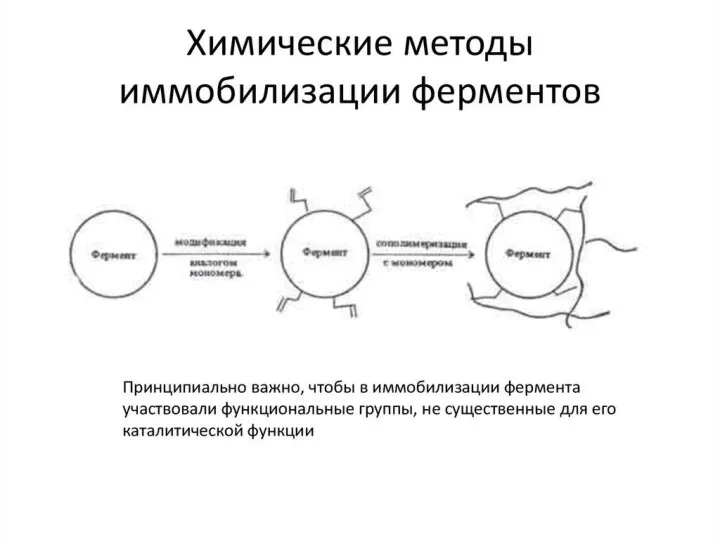
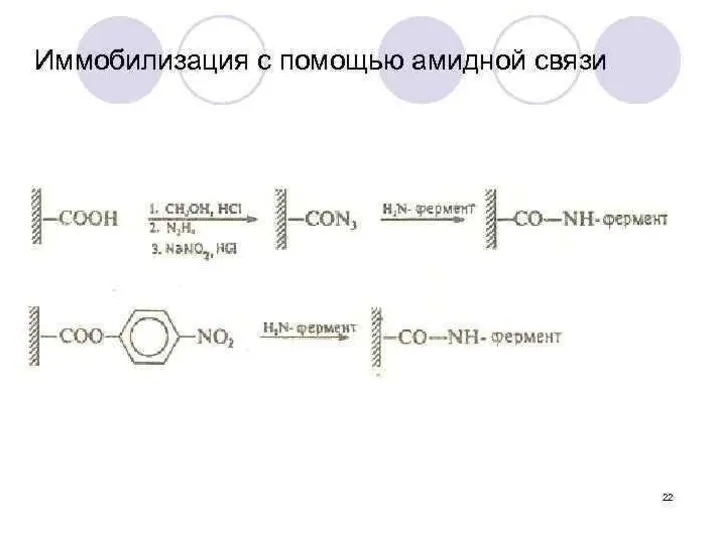
- 41. Методы химической иммобилизации: Образовании ковалентных связей между ферментом и носителем. Преимущества: 1) Высокая прочность конъюгата 2)
- 42. При иммобилизации ферментов необходимо соблюдать следующие условия: 1. Активные группы матрицы не должны блокировать каталитический центр
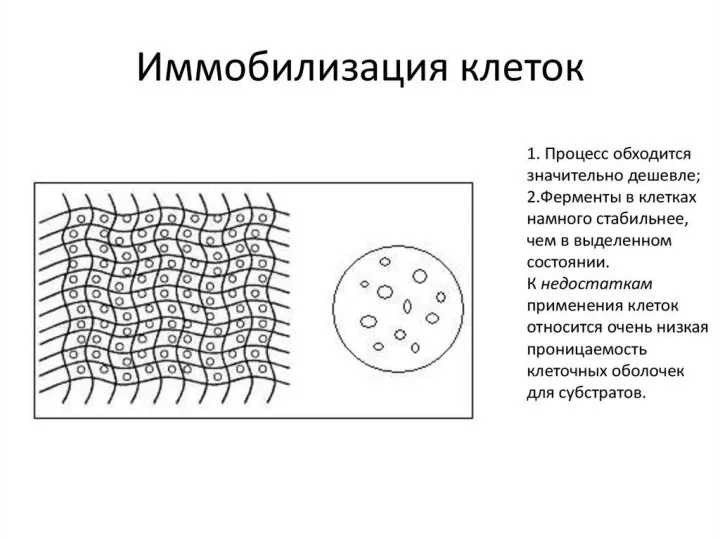
- 51. Весьма перспективным является использование в качестве биокатализаторов иммобилизованных клеток. Т.к. можно избежать: дорогостоящие стадии выделения и
- 54. https://zen.yandex.ru/video/watch/602c8a1e2ca49f59481a6792 - химозин, пр-во сыра
- 56. Термофильные и гипертермофильные микроорганизмы продуцируют ферменты, которые называются термозимы (Zeikus et al 1998). Они имеют ряд
- 57. Термозимы Стабильны в условиях высокой температуры, высоких концентраций солей и экстремальных значений рН. Гипертермофильные микроорганизмы, встречающиеся
- 58. Механизмы ответственны за термоустойчивость ферментов у термозимов: Между мезофильными и термофильными версиями ферментов - высокая степень
- 59. Было обнаружено, что дегидрогеназа из Pyrococcus furiosus (Tm == 105 °C) содержит 35 изолейцинов, в то
- 60. Возросшая термостабильность коррелирует: с увеличением жесткости белковой структуры за счет уменьшения содержания остатков глицина, с улучшением
- 62. Механизмы стабилизации: • минимизация доступной площади гидрофобной поверхности белка; • оптимизация упаковки атомов белковой молекулы (минимизация
- 63. Применение ферментов из экстремофилов Современные технологии молекулярной биологии и генной инженерии позволяет: 1) получать достаточные количества
- 64. Применение ферментов из экстремофилов: Крахмал используется для производства сахаров. Сначала процесс ведется при (95–105 °С) и
- 65. Применение ферментов из экстремофилов: Наиболее термостабильные α-амилазы были обнаружены у archaea Pyrococcus woesei, Pyrococcus furiosus, Desulfurococcus
- 66. Применение ферментов из экстремофилов: Протеолитические ферменты Сериновые щелочные протеиназы широко используются в качестве добавок к моющим
- 67. Применение ферментов из экстремофилов: ДНК-полимеразы Термостабильные ДНК-полимеразы используются в ПЦР и играют важную роль в генной
- 68. ФЕРМЕНТЕР Ферментер - это специальный резервуар, внутри которого создаются идеальные условия для культивирования полезных микроорганизмов в
- 71. Скачать презентацию

















































 Дистанционные технологии в работе психолога с одаренными детьми
Дистанционные технологии в работе психолога с одаренными детьми 15 титульные листы разделов
15 титульные листы разделов Русские народные инструменты
Русские народные инструменты Рекомендации по обустройству ДИП
Рекомендации по обустройству ДИП Анализ рабочего чертежа детали Крышка сквозная
Анализ рабочего чертежа детали Крышка сквозная Фет
Фет Introduction robot: a mechanic al piece robots and robotics intelligent systems computation and search tools. Math review
Introduction robot: a mechanic al piece robots and robotics intelligent systems computation and search tools. Math review Небесна сотня
Небесна сотня Пять элементов
Пять элементов Citizenship
Citizenship Проект НТГСПИ
Проект НТГСПИ Види колекціонування
Види колекціонування 20130117_kartochka_no_5.pptx_pishcha_0
20130117_kartochka_no_5.pptx_pishcha_0 Металлургический комплекс
Металлургический комплекс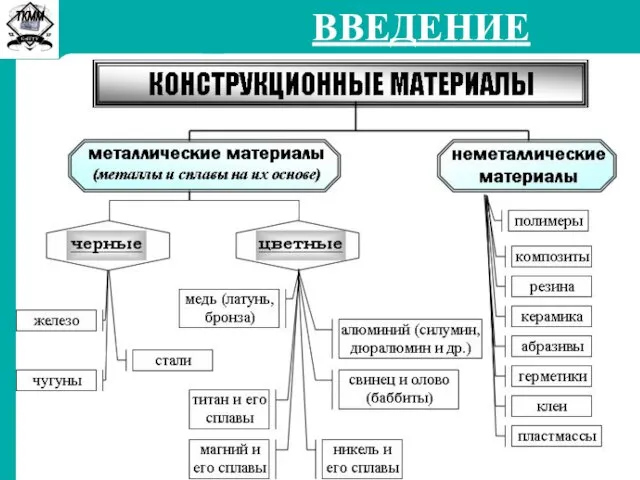 СибГТУ. Введение. Конструкционные материалы
СибГТУ. Введение. Конструкционные материалы Культурные растения
Культурные растения Устройство патрона, выключателя
Устройство патрона, выключателя Основы технологии переработки пластмасс. Формирование на подложке. Отливка, пропитка, промазка
Основы технологии переработки пластмасс. Формирование на подложке. Отливка, пропитка, промазка Используемые инструменты. Виды клеев
Используемые инструменты. Виды клеев zadanie_olimpiyskie_bogi
zadanie_olimpiyskie_bogi Модель подготовки выпускников 9 класса к выполнению задания 5 ОГЭ по русскому языку - копия
Модель подготовки выпускников 9 класса к выполнению задания 5 ОГЭ по русскому языку - копия Психология высшей школы
Психология высшей школы Примирение (маршрутами Великого Сибирского Ледяного похода) 2007-2013 гг
Примирение (маршрутами Великого Сибирского Ледяного похода) 2007-2013 гг Эксплуатация пункта редуцирования газа ПРГШ R/72 с регулятором давления R/72
Эксплуатация пункта редуцирования газа ПРГШ R/72 с регулятором давления R/72 Арина деп романда геройлордыҥ сÿр-кеберлери
Арина деп романда геройлордыҥ сÿр-кеберлери Профессиональное обучение без границ
Профессиональное обучение без границ Изобразительно-выразительные средства в тексте
Изобразительно-выразительные средства в тексте Проектор. Путешествия
Проектор. Путешествия