Содержание
- 2. Miaстенія Гравіс (хвороба Ерба–Гольдфлама) аутоімунне захворювання, яке клінічно проявляється у вигляді слабкості та патологічної м’язової стомлюваності,
- 3. Історія Клінічна картина важкої міастенії вперше була описана Th. Willis ще у 1672 р. Назва її
- 4. Епідеміологія Хворіють здебільшого жінки – співвідношення жінок та чоловіків 3:1. Початок хвороби припадає переважно (60%) на
- 5. Етіологія В етіології захворювання значну роль відіграє патологія тимуса – у понад 70% пацієнтів виявляється лімфофолікулярна
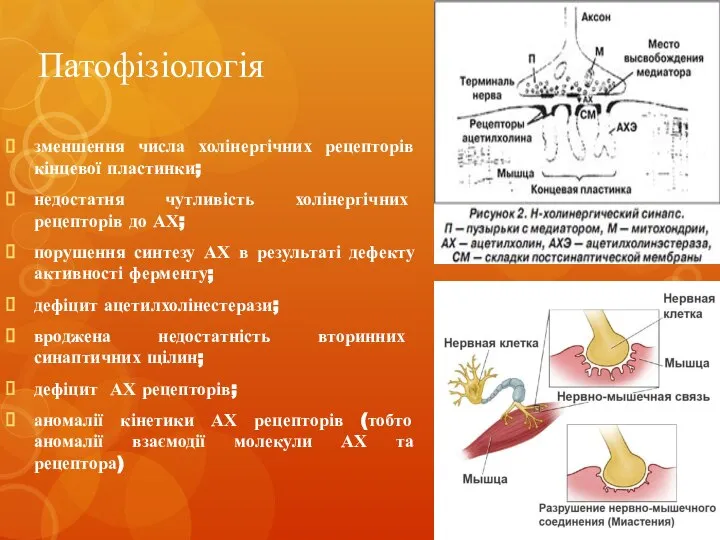
- 6. Патофізіологія зменшення числа холінергічних рецепторів кінцевої пластинки; недостатня чутливість холінергічних рецепторів до АХ; порушення синтезу АХ
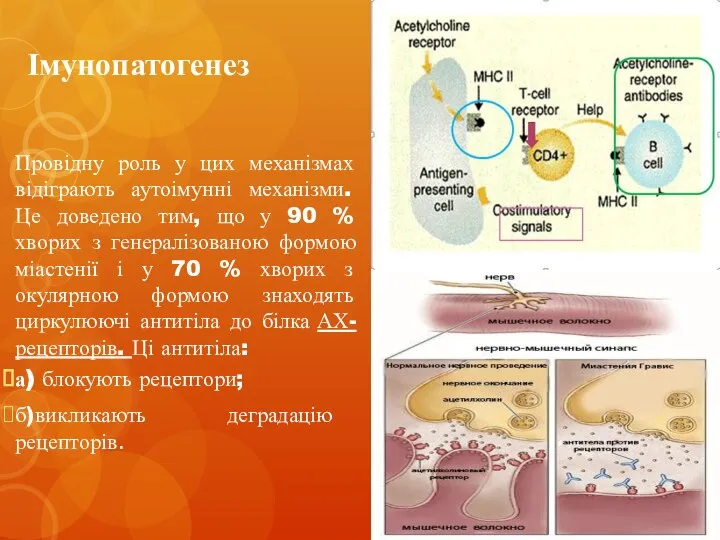
- 7. Імунопатогенез Провідну роль у цих механізмах відіграють аутоімунні механізми. Це доведено тим, що у 90 %
- 8. Доказом імунологічного генезу міастенії є : Полісистемність захворювання (часто страждає сполучна тканина, щитоподібна залоза). Часте поєднання
- 9. Антитіла до AChR. Доведено, що у хворих з геніралізованою формою МГ в 80-90% випадків виявляються антитіла
- 10. Антитіло-негативна МГ. У 3-10% хворих МГ не виявляються антитіла до AChR. Проте доказом ролі антитіл в
- 11. Механізм дії антитіл проти AChR. Встановлено, що ці антитіла зменшують кількість AChR за допомогою трьох різних
- 12. Роль тимуса в розвитку МГ. Встановлено, що тимічні порушення чітко асоціюються з МГ, але природа цих
- 13. Сироваткові імуноглобуліни і імунні комплекси при МГ. Склад сироваткових імуноглобулінів в крові різних хворих неоднаковий. У
- 14. На сьогодні чинною міжнародною класифікацією міастенії є класифікація Osserman’а (Osserman K.E., 1958), затверджена на ІІ симпозіумі
- 15. Очна форма. Найбільш часто зустрічається тріада: птоз; диплопія; обмеження рухів очних яблук. Характерні особливості: асиметричність ураження;
- 17. Генералізована міастенія часто дебютує з очних симптомів; типовим є ураження проксимальних м’язів плечового поясу та шиї;
- 18. Міастенія дитячого віку Неонатальна - у дітей, що народились у матерів, хворих на міастенію у результаті
- 19. Діагностика Фармакологічна Електрофізіологічна Імунологічна Радіологічні методи діагностики – рентгенографія, комп’ютерна (КТ) та магнітно - резонансна томографія
- 20. Фармакологічна діагностика Прозеринова проба. Прозерин в дозі 1,5-3 мл 0,05 % вводять п/ш. Можна разом з
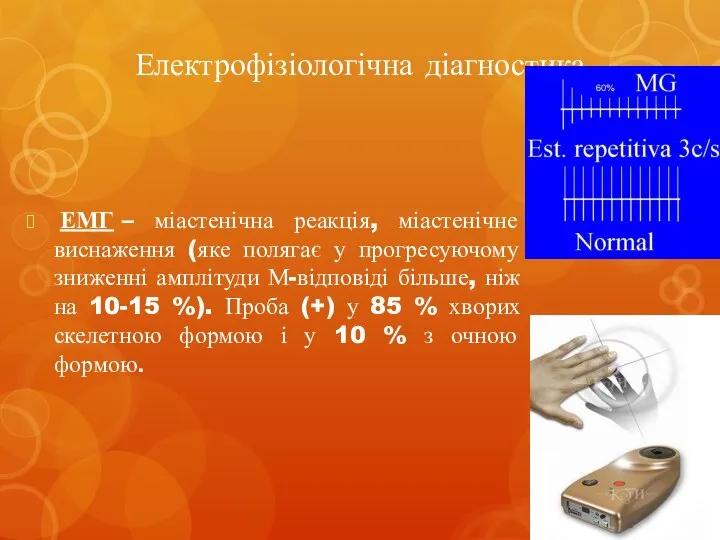
- 21. Електрофізіологічна діагностика ЕМГ – міастенічна реакція, міастенічне виснаження (яке полягає у прогресуючому зниженні амплітуди М-відповіді більше,
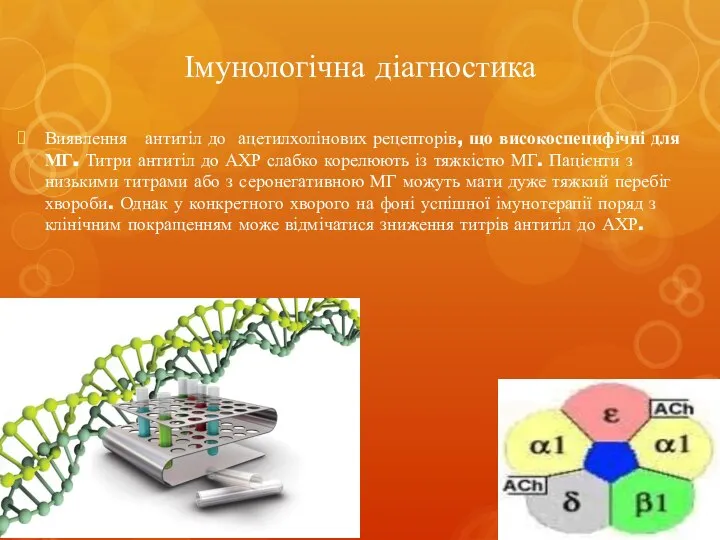
- 22. Імунологічна діагностика Виявлення антитіл до ацетилхолінових рецепторів, що високоспецифічні для МГ. Титри антитіл до АХР слабко
- 23. Диференційна діагностика неврастенія міастенічний синдром Ламберта-Ітона ботулізм полінейропатія м’язові дистрофії запальні міопатії інсульт у в/б басейні
- 24. Лікування Терапія МГ складається з чотирьох базових напрямів: • компенсуюча симптоматична терапія (антихолінестеразні препарати); • хронічна
- 25. Антихолінестеразні препарати: калімін 30 мг тричі за день, поступово можна дозу збільшувати до 60-120 мг (приймати
- 26. Кортикостероїди Призначають при недостатній ефективності антихолінестеразних препаратів. Гормони ефективні у 70-90 % хворих. Доза: починати слід
- 27. Імуносупресори Азатіопрін призначають при генералізованій та бульбарній формах, коли хворі не переносять кортикостероїдів. Доза: від 50
- 28. При різкому погіршенні стану, розвитку ускладнень, таких як міастенічний криз, необхідності передопераційної підготовки хворих перед тимектомією
- 29. Тимектомія Показаннями до хірургічного лікування є наявність тимоми, ураження процесом краніобульбарних м’язів, а також прогресуючий перебіг
- 31. Скачать презентацию






















 Электроэнергия в производстве
Электроэнергия в производстве 20141102_galakticheskiy_poedinok_5_kl
20141102_galakticheskiy_poedinok_5_kl Целлюллозно - бумажное производство
Целлюллозно - бумажное производство Гибкая автоматизированная линия FESTO, интегрированная с SCADA-системой Ciros Production
Гибкая автоматизированная линия FESTO, интегрированная с SCADA-системой Ciros Production Пед. профильные курсы Сварочных дел мастер
Пед. профильные курсы Сварочных дел мастер Мозаика из бумаги. Творческие проекты младших школьников
Мозаика из бумаги. Творческие проекты младших школьников Спутниковая система безопасности benish guard
Спутниковая система безопасности benish guard Quiewind
Quiewind Компенсация реактивной мощности в системах электроснабжения промышленных предприятий
Компенсация реактивной мощности в системах электроснабжения промышленных предприятий Диета и гигиена беременных
Диета и гигиена беременных Система питания карбюраторного двигателя внутреннего сгорания. (Тема 9.2)
Система питания карбюраторного двигателя внутреннего сгорания. (Тема 9.2) Биотехнология. История биотехнологии
Биотехнология. История биотехнологии Композиция “Голубь мира”
Композиция “Голубь мира” Лекция 1. Введение в Священное Писание Нового Завета
Лекция 1. Введение в Священное Писание Нового Завета Проект по технологии Кофта для собаки из старого джемпера
Проект по технологии Кофта для собаки из старого джемпера Что такое микроскоп?
Что такое микроскоп? Средневековый город
Средневековый город Новые ГПА на объектах общества ОАО Газпром. Опыт эксплуатации
Новые ГПА на объектах общества ОАО Газпром. Опыт эксплуатации Traveling and busniness
Traveling and busniness Флюгер Кот в полёте
Флюгер Кот в полёте Услуги почтовой связи Почта России
Услуги почтовой связи Почта России Сборка универсального компьютера
Сборка универсального компьютера Презентация
Презентация Салфетки-Подушки
Салфетки-Подушки Отчёт главы Кондратовского сельского поселения от 24.02.2021
Отчёт главы Кондратовского сельского поселения от 24.02.2021 Коммерческие перевозчики НГПТ
Коммерческие перевозчики НГПТ Рекомендации по работе с колодой карт Таро
Рекомендации по работе с колодой карт Таро Резюме Патлатый Илья
Резюме Патлатый Илья