Содержание
- 2. Česká republika se stala jedním z center evropského farmaceutického průmyslu Zentiva jako významná součást vedoucí globální
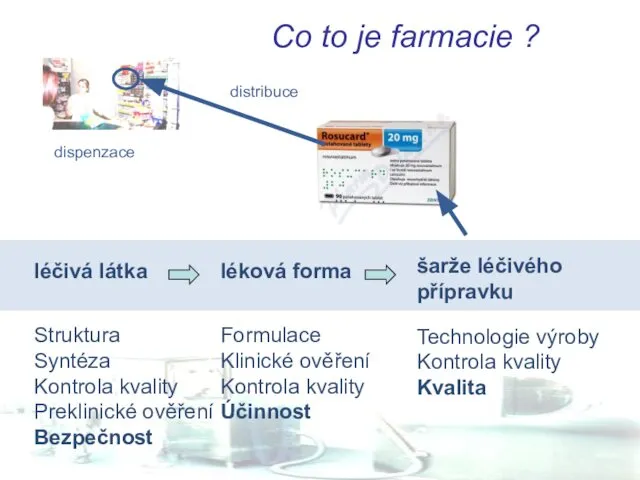
- 3. léčivá látka Struktura Syntéza Kontrola kvality Preklinické ověření Bezpečnost léková forma Formulace Klinické ověření Kontrola kvality
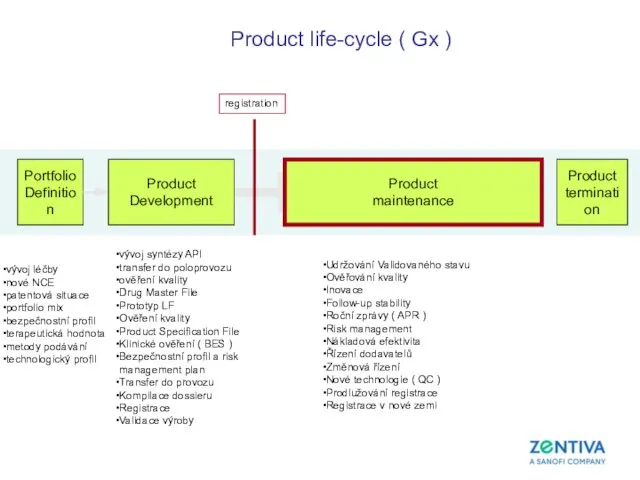
- 4. Product life-cycle ( Gx ) Portfolio Definition Product Development registration Product maintenance Product termination vývoj léčby
- 5. Co jsou generika ( Gx ) ? odborná / regulační definice pohled intelektuálního vlastnictví / patenty
- 6. Definice generického léku léčivý přípravek, který má shodné kvalitativní a kvantitativní složení pokud jde o účinné
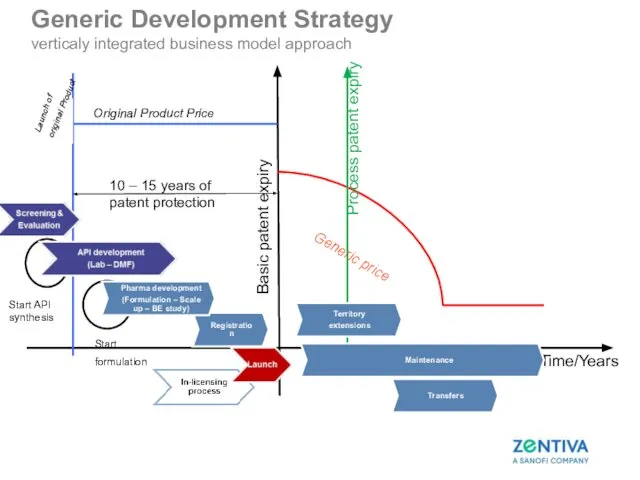
- 7. R&D Process Time/Years Original Product Price 10 – 15 years of patent protection Basic patent expiry
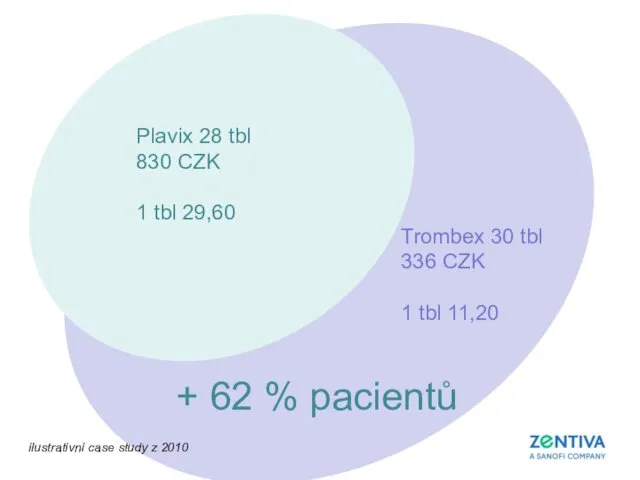
- 8. Plavix 28 tbl 830 CZK 1 tbl 29,60 Trombex 30 tbl 336 CZK 1 tbl 11,20
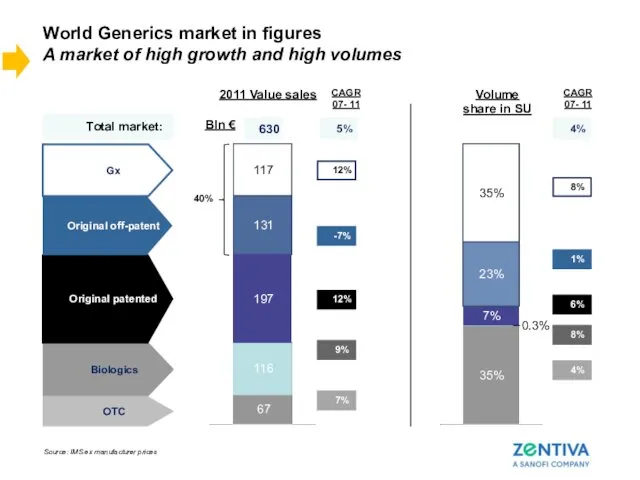
- 9. World Generics market in figures A market of high growth and high volumes Total market: 0.3%
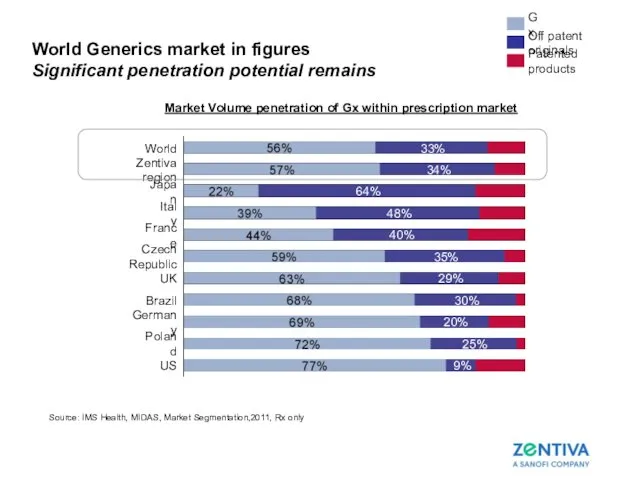
- 10. World Generics market in figures Significant penetration potential remains | Source: IMS Health, MIDAS, Market Segmentation,2011,
- 11. A. Základní organizace farmaceutické společnosti B. úvod do regulace vývoje, výroby a distribuce léčiv C. základy
- 12. Podmínka úspěchu – strategie a leadership Orientace na potřeby zákazníků Orientace na procesy s vysokou přidanou
- 13. CIS Nové produkty Dostupné produkty základní procesní model Procesy a zdroje zákazník / pacient
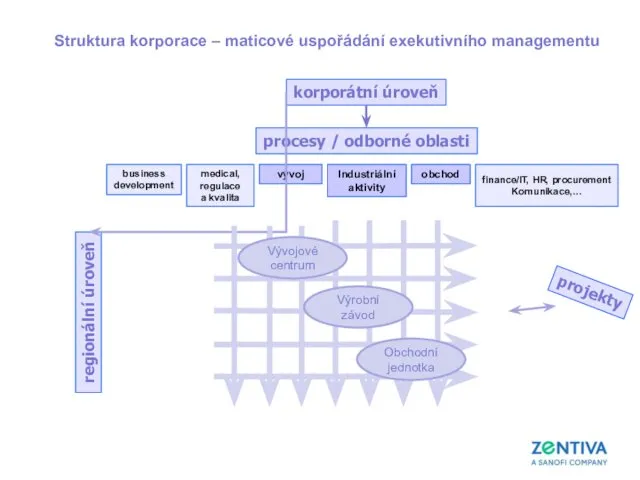
- 14. korporátní úroveň regionální úroveň procesy / odborné oblasti Výrobní závod Obchodní jednotka projekty Industriální aktivity vývoj
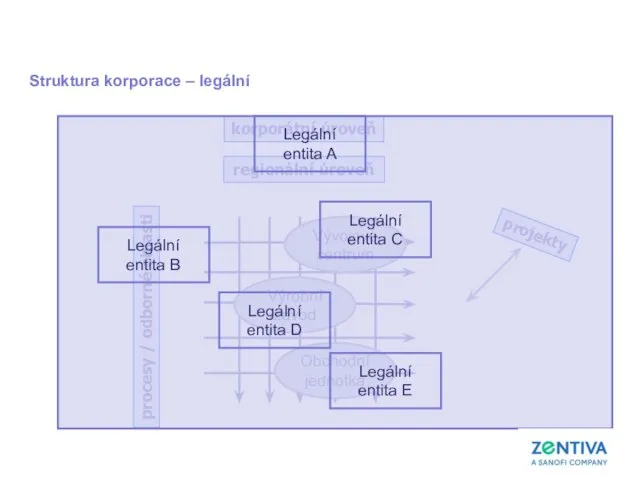
- 15. korporátní úroveň regionální úroveň procesy / odborné oblasti Vývojové centrum Výrobní závod Obchodní jednotka projekty Legální
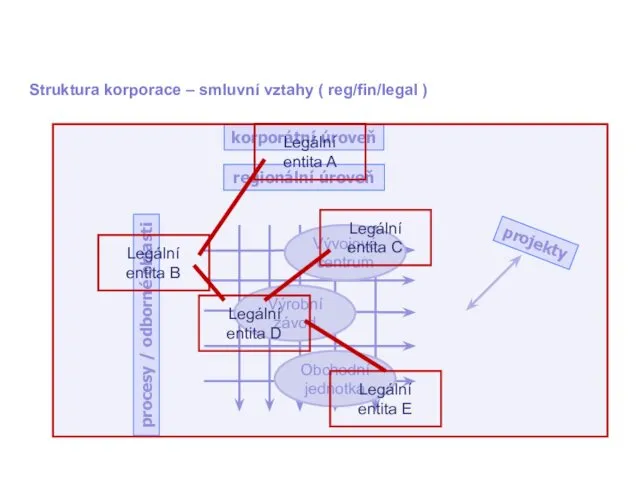
- 16. korporátní úroveň regionální úroveň procesy / odborné oblasti Vývojové centrum Výrobní závod Obchodní jednotka projekty Legální
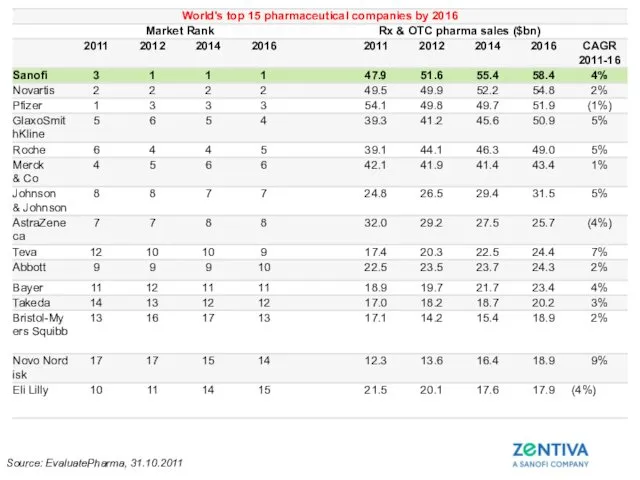
- 17. Source: EvaluatePharma, 31.10.2011
- 18. SANOFI A global healthcare leader, focused on patients’ needs
- 19. A global diversified healthcare leader, focused on patients’ needs world’s largest pharmaceutical groups 1 employees in
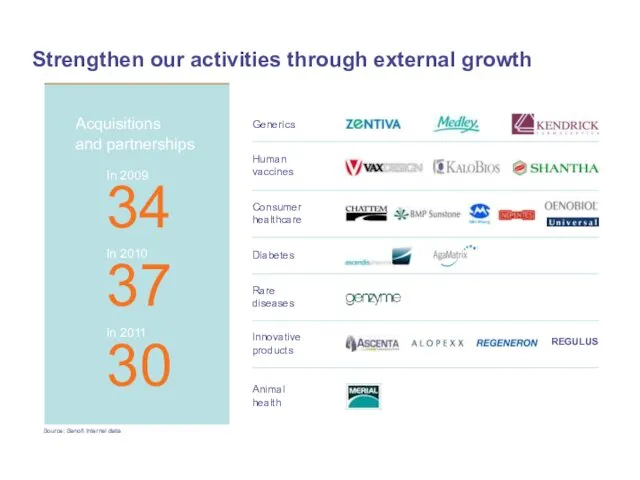
- 20. Strengthen our activities through external growth Generics Human vaccines Consumer healthcare Diabetes Rare diseases Innovative products
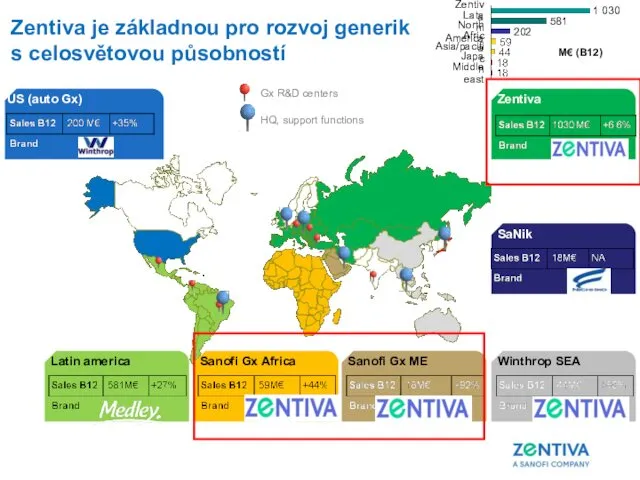
- 21. Zentiva je základ generické platformy sanofi 3. největší generická společnost v Evropě ( Teva, Sandoz, Zentiva
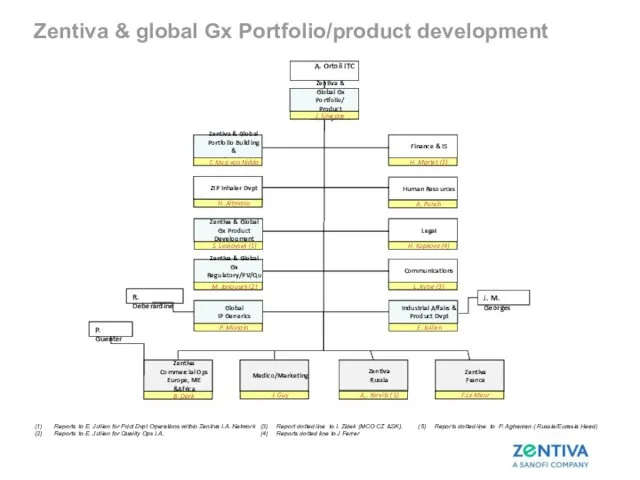
- 22. Zentiva & global Gx Portfolio/product development
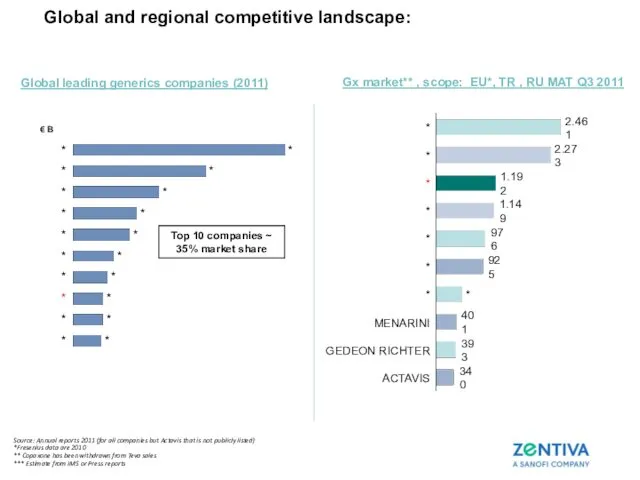
- 23. Global and regional competitive landscape: Global leading generics companies (2011) Source: Annual reports 2011 (for all
- 24. Zentiva Middle east Japan Africa North America 202 Latam 581 Zentiva Asia/pacific 1 030 SaNik Winthrop
- 25. B. úvod do regulace vývoje, výroby a distribuce léčiv
- 26. Historie lékové regulace Lékopisy Průkaz účinku a bezpečnosti Správné praxe ( výroba, klinické hodnocení, distribuce,..)
- 27. Léková regulace : nástroje kontroly „kvality“ léků a léčivých látek správné účinnosti, minimálních vedlejších účinků a
- 28. 1957 - 1962 thalidomid ( Contergan ) lék pro spaní, způsobil tělesné defekty tisícům dětí ve
- 29. zakotvení v právním řádu ( zákon o léčivech ) existence nezávislé státní autority / lékové agentury
- 30. Autorita ( SÚKL, ..) Žadatel farmaceutická firma ( držitel registrace, výrobce ..) Registrace léčivých přípravků Registrační
- 31. Farmaceutická legislativa v EU Dva cíle: Ochrana veřejného zdraví Volný pohyb léčivých přípravků Navíc: Kontrola veřejných
- 32. Klíčová nařízení v EU Nařízení 726/2004 o autorizaci a dozoru nad léčivými přípravky pro humánní a
- 33. Klíčové směrnice v EU Směrnice 2001/83/EC – legislativa pro léčivé přípravky pro humánní použití + její
- 34. Rozhodnutí o registraci (Marketing Authorisation) Léčivý přípravek může být uveden na trh v EU, pokud získal
- 35. EU registrační procedury Centralizovaná procedura (CP) ⇒ MA platné pro území celého Společenství, vydává je EMEA
- 36. Regulační prostředí v České republice odpovídá evropským standardům Pro vývoj a výrobu léků platí stejné standardy
- 37. C. základy farmaceutického jištění jakosti , Správné výrobní praxe a jejich praktické uplatnění ve farmaceutické výrobě
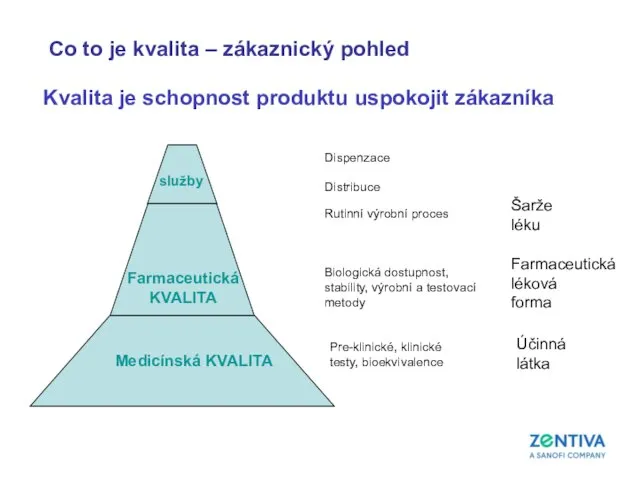
- 38. co to je kvalita ?
- 39. Medicínská KVALITA Farmaceutická KVALITA služby Pre-klinické, klinické testy, bioekvivalence Biologická dostupnost, stability, výrobní a testovací metody
- 40. Manažerský- systémový pohled Zákaznický - produktový pohled Inženýrský pohled
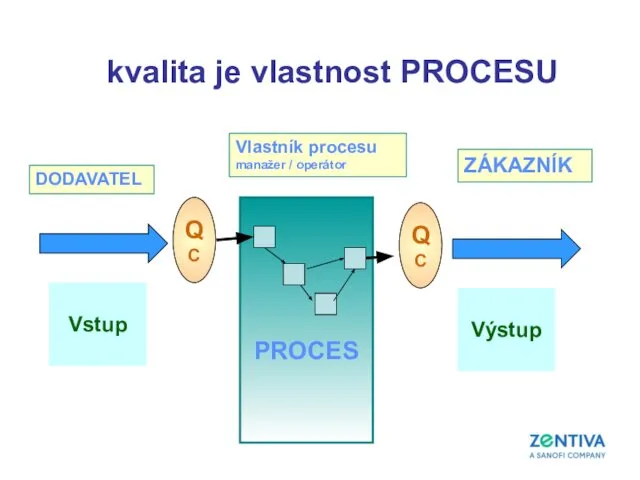
- 41. PROCES ZÁKAZNÍK DODAVATEL Vstup Výstup QC QC Vlastník procesu manažer / operátor kvalita je vlastnost PROCESU
- 42. Kvalita je způsob myšlení orientovaný na uspokojení zákazníka a zlepšování…. zlepšování efektivity (do the right things,
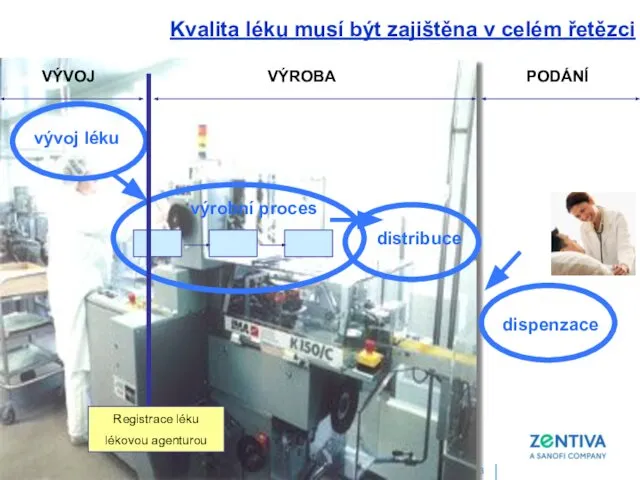
- 44. ADAPTAČNÍ SEMINÁŘ LEDEN 2003 výrobní proces vývoj léku dispenzace distribuce Registrace léku lékovou agenturou VÝVOJ VÝROBA
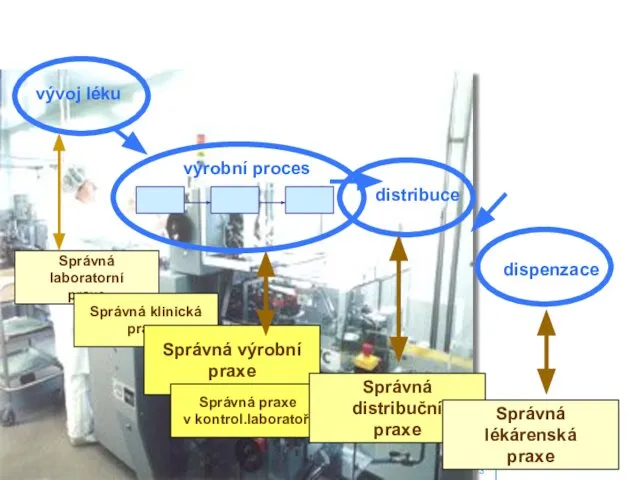
- 45. ADAPTAČNÍ SEMINÁŘ LEDEN 2003 výrobní proces vývoj léku Správná laboratorní praxe Správná klinická praxe Správná výrobní
- 46. Reálný stav - pacient nepozná že lék je nekvalitní Etika - nekvalita léku může mít vážné
- 47. Co znamená SVP / GMP ? Každá vyrobená šarže odpovídá registrovaným podmínkám a je shodná se
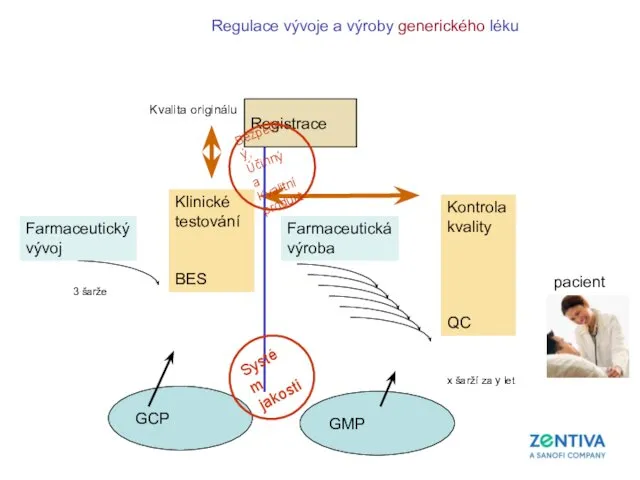
- 48. Farmaceutický vývoj Klinické testování BES Farmaceutická výroba Kontrola kvality QC pacient 3 šarže x šarží za
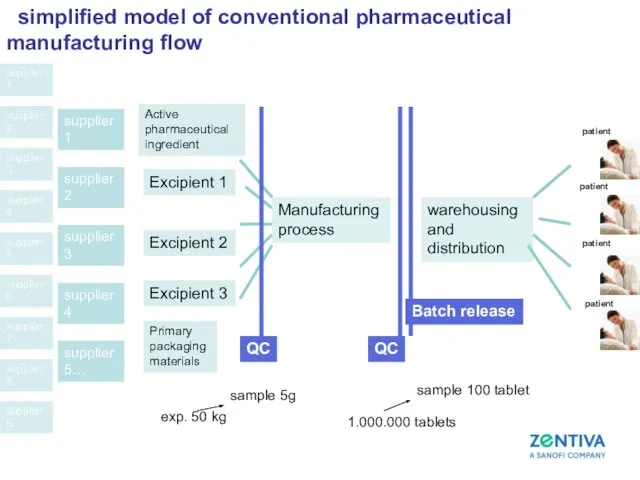
- 49. simplified model of conventional pharmaceutical manufacturing flow supplier 1 Active pharmaceutical ingredient Excipient 1 QC Manufacturing
- 50. jištění jakosti ( QA - quality assurance ) souhrn všech záměrných opatření sledujících zajištění toho, že
- 51. kvalifikovaná osoba ( QP - qualified person ) je stanovený pracovník výrobce (distributora), který je odpovědný
- 52. řízení jakosti ( QA systém ) organizace a pracovníci prostory a zařízení dokumentace výroba vzorkování +
- 53. vliv historie, velikosti firmy, personální zázemí organizační řád písemné popisy pracovních činností nezávislost klíčových funkcí :
- 54. Role QP ve firmě je odpovědná za to, že každá šarže léčivého přípravku se vyrábí a
- 55. Role QP v budoucnosti – vliv vnějších faktorů spojování společností koncentrace výrobních kapacit rozvoj smluvní výroby
- 56. vysoká úroveň motivace pracovníků ke kvalitě na všech stupních řízení je základním předpokladem úspěšného zavedení a
- 57. předpis definující zásady hygieny ve výrobních a obslužných útvarech systém používání ošacení a pomůcek hygienické chování
- 58. výrobní, skladovací, pomocné, laboratoře zabezpečení ochrany produktu před kontaminací ( křížová kontaminace, mikrobiální, částicová ) a
- 59. vhodnost k užití konstrukce - materiály, čistitelnost preventivní a havarijní údržba kalibrace, kvalifikace a validace metrologické
- 60. předpisy ( SOP – standardní operační postupy ) vytváří systém kde je zaručeno, že činnosti (
- 61. uživatel si je jist, že dokument je platný a úplný dokumenty musí vznikat definovaným postupem připomínek
- 62. organizační normy - předpisy, směrnice, SOP dokumentace k produktu : - registrační dokumentace ( registrační složka
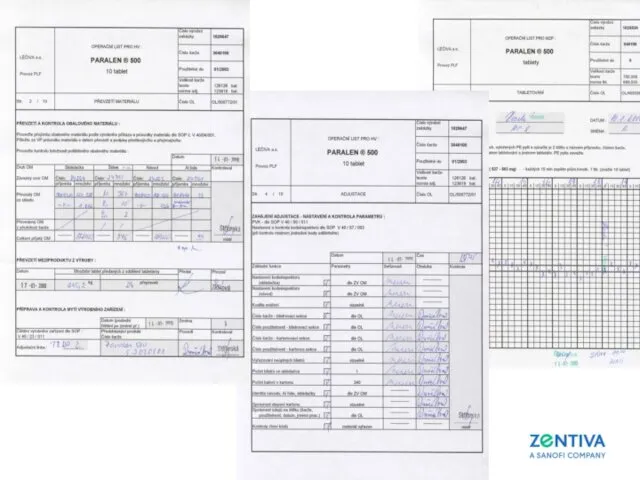
- 63. Dokumentace operační listy výroby
- 64. přesně definovanými postupy vyrobit produkty, které mají požadovanou jakost a odpovídají registraci příjem a zacházení se
- 65. dokumentovaná činnost prokazující, že výrobní či kontrolní proces náležitě funguje a je pod kontrolou
- 66. prospektivní validace konkurentní validace retrospektivní validace řídící plán validací validují se : technologické postupy, kontrolní metody,
- 67. DQ - “kvalifikovaný požadavek” IQ - instalační kvalifikace - zařízení je vhodné, úplné, pro zamýšlené použití
- 68. zabezpečit, že jsou řádně prováděny kontroly a testování materiálů a že jsou tyto uvolňovány k dalšímu
- 69. zabezpečit, že smluvně prováděné činnosti nemohou negativně ovlivnit jakost produktu či informace o ní existence písemné
- 70. zabezpečit, že všechny reklamace jsou řádně prošetřeny a že je možno zajistit stažení konkrétní šarže z
- 71. slouží k ověření zda systémy a činnosti uvedené v předchozích kapitolách fungují podle definovaných požadavků -
- 73. Скачать презентацию
















































 Эдом. Происхождение идумеев
Эдом. Происхождение идумеев Организация движения поездов
Организация движения поездов Иконы и фрески
Иконы и фрески С новым годом
С новым годом Правила оформления заявления на участие в конкурсе по предоставлению помещений
Правила оформления заявления на участие в конкурсе по предоставлению помещений Автопарк ГФ
Автопарк ГФ Растительные волокна
Растительные волокна Адаптации организмов
Адаптации организмов 20160324_zhenskie_obrazy_v_iskusstve
20160324_zhenskie_obrazy_v_iskusstve Березник – моя малая родина
Березник – моя малая родина Онлайн-курсы (1)
Онлайн-курсы (1) 20180304_urok_6_kl
20180304_urok_6_kl Салахова Саида
Салахова Саида День милосердия и благотворительности
День милосердия и благотворительности Предложения разные по цели высказывания
Предложения разные по цели высказывания Табиғат ресурстары
Табиғат ресурстары O Holy Night. Зимние пейзажи
O Holy Night. Зимние пейзажи Особенности транспорта
Особенности транспорта 20110802_Vzaimosvyaz_iskusstv
20110802_Vzaimosvyaz_iskusstv Сепараторы для гравитационного обогащения угля
Сепараторы для гравитационного обогащения угля Сетевая акция
Сетевая акция Оценка количественных параметров текстового документа
Оценка количественных параметров текстового документа Вакуумные уборочные машины
Вакуумные уборочные машины Don sanoati bo'yicha kadrlar buyurtmachilari va ishlab chiqarish korxonalari
Don sanoati bo'yicha kadrlar buyurtmachilari va ishlab chiqarish korxonalari Архангельская область
Архангельская область Экран состояния охраны труда в хозяйстве электрификации и электроснабжени
Экран состояния охраны труда в хозяйстве электрификации и электроснабжени Основные сведения о системах электроснабжения объектов
Основные сведения о системах электроснабжения объектов Машины для посева и посадки
Машины для посева и посадки