Содержание
- 2. Биохимия (1 часть) Статическая биохимия Биохимия (2 часть) Динамическая биохимия Контрольная работа N1 по завершении 1
- 3. Биохимия (1 часть) Статическая биохимия Белки. Ферменты Нуклеиновые кислоты Углеводы Липиды Витамины
- 4. Темы для семинаров Аминокислоты. 1. Аминокислоты – производные карбоновых кислот. 2. Классификация аминокислот по структуре и
- 5. Белки.Структурная организация белков. Первичная структура. Вторичная структура белка, зависимость от первичной структуры. От чего зависит тип
- 6. Ферменты. Химическая природа и структура. Перечислите основные отличия биологических катализаторов от химических. Классификация и номенклатура ферментов.
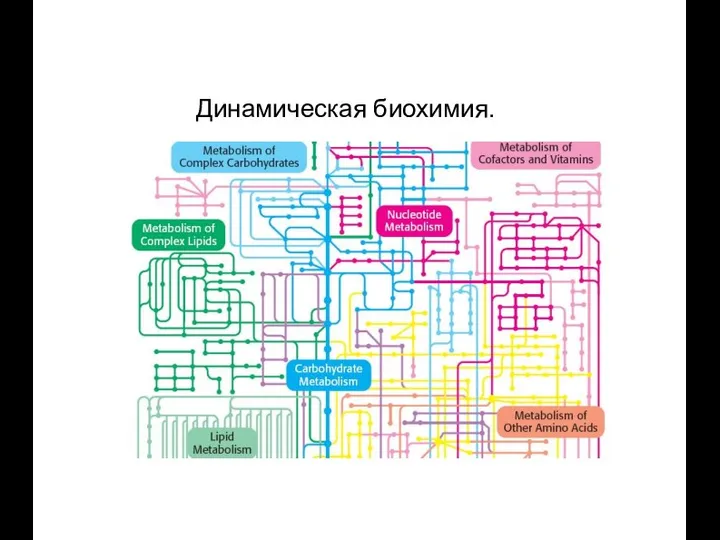
- 7. Динамическая биохимия.
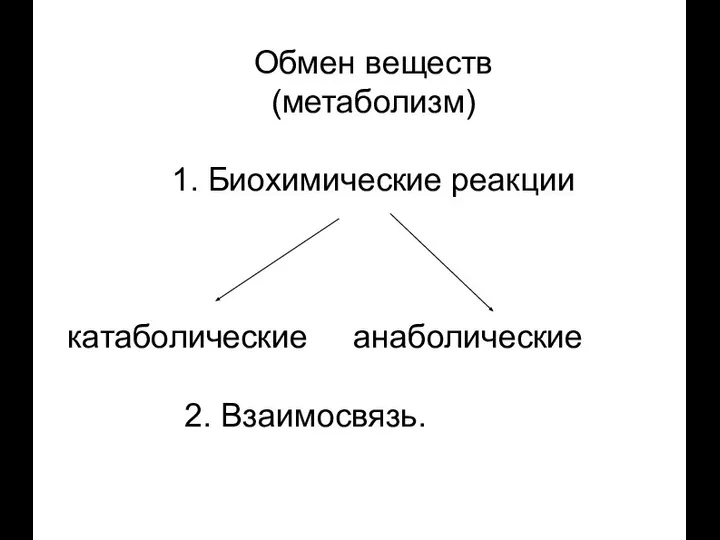
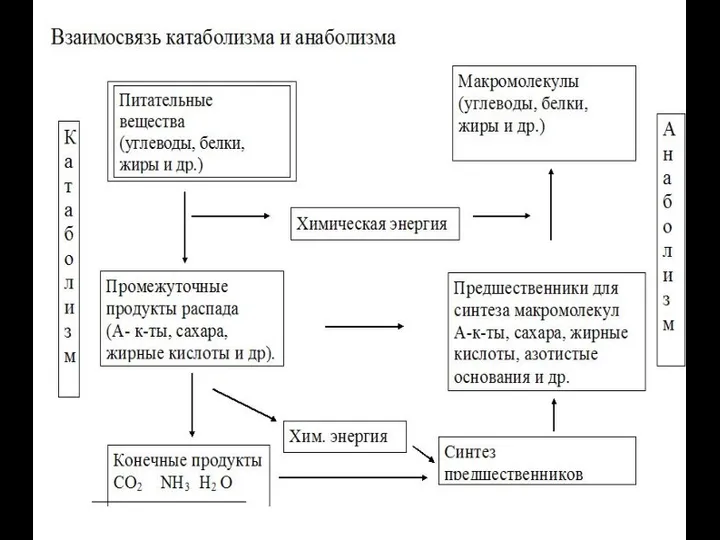
- 8. Обмен веществ (метаболизм) 1. Биохимические реакции катаболические анаболические 2. Взаимосвязь.
- 10. 1. Элементный состав живых организмов Макроэлементы: C, N,O,H, P, S, Cl, K, Na, Ca, Mg, Fe
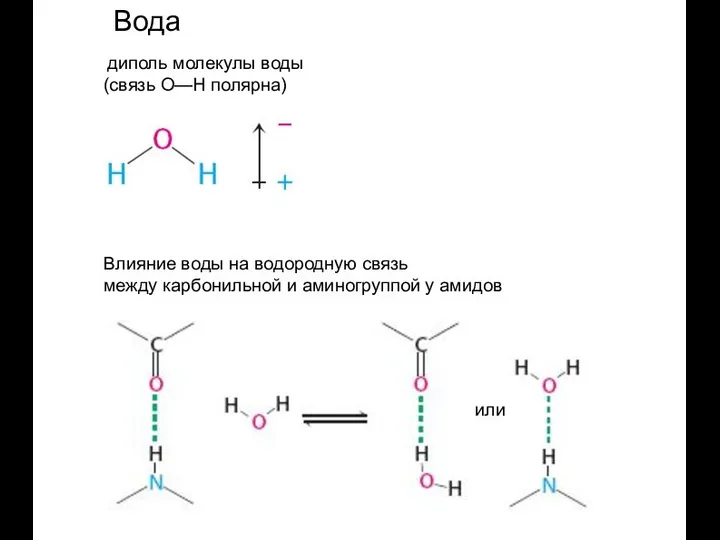
- 11. Вода. Значение для живых организмов. (около 90% массы клеток приходится на долю воды)
- 12. Вода диполь молекулы воды (связь О—Н полярна) Влияние воды на водородную связь между карбонильной и аминогруппой
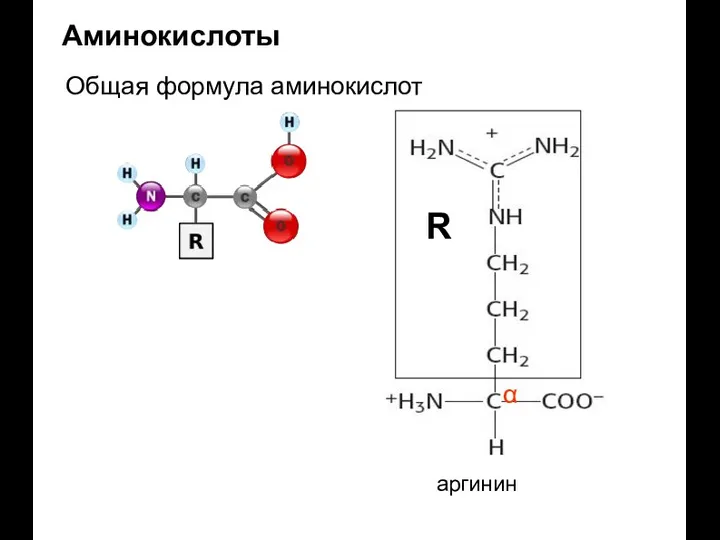
- 13. Аминокислоты Общая формула аминокислот α R аргинин
- 14. Аминокислоты – производные карбоновых кислот Глицин ( α – аминоуксусная) Аланин (α – аминопропионовая) Серин (α
- 15. 10 незаменимых аминокислот: Аргинин Валин Гистидин Лизин Изолейцин Лейцин Метионин Треонин Триптофан Фенилаланин
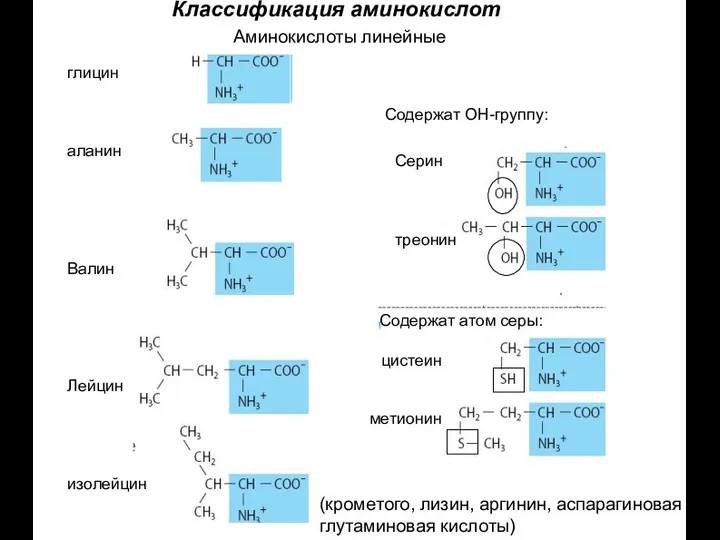
- 16. Классификация аминокислот Аминокислоты линейные Содержат атом серы: Содержат ОН-группу: глицин аланин Валин Лейцин изолейцин Серин треонин
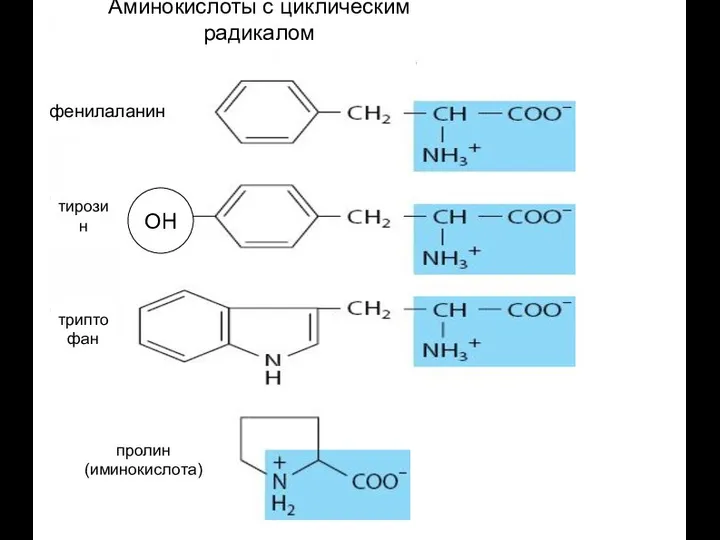
- 17. фенилаланин тирозин триптофан пролин (иминокислота) Аминокислоты с циклическим радикалом ОН
- 18. Классификация по числу амино- и карбоксильных групп: моноаминомонокарбоновые (глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин,
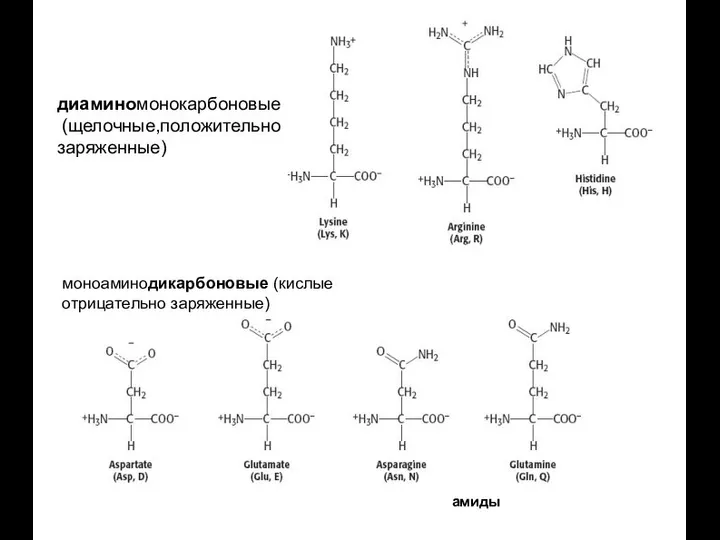
- 19. диаминомонокарбоновые (щелочные,положительно заряженные) моноаминодикарбоновые (кислые отрицательно заряженные) амиды
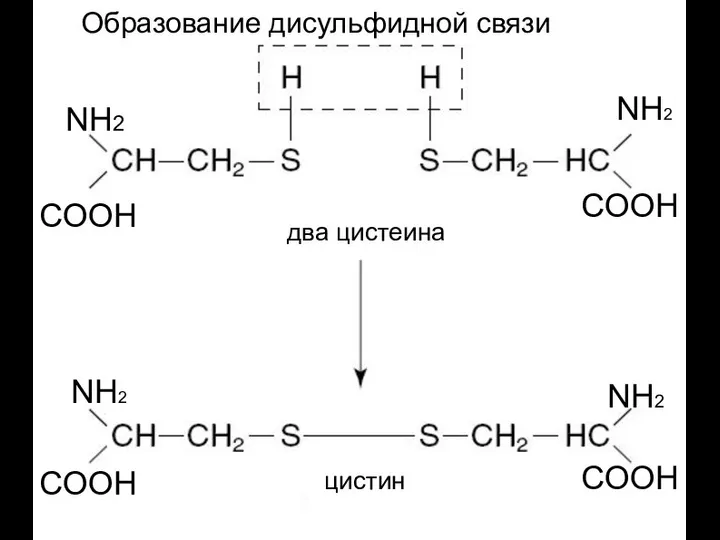
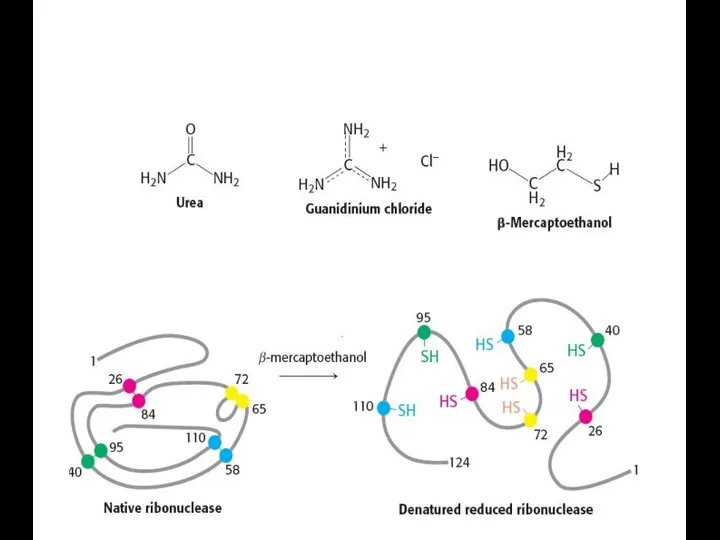
- 20. NH2 COOH NH2 COOH NH2 COOH COOH NH2 цистин два цистеина Образование дисульфидной связи
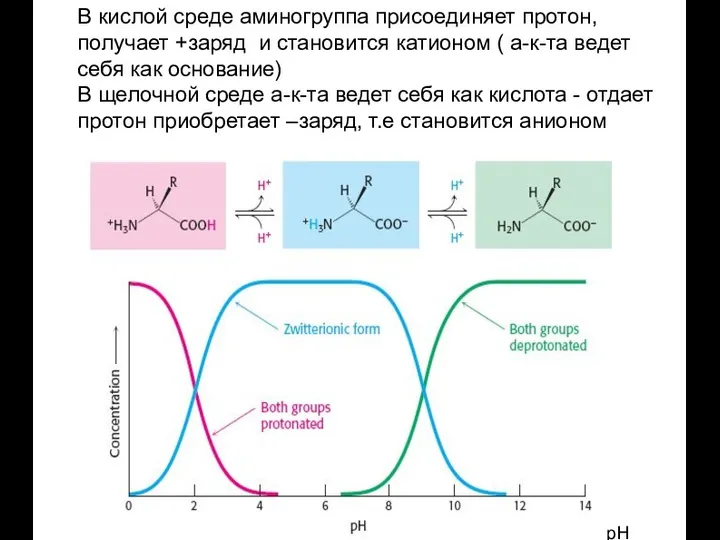
- 21. Аминокислоты хорошо растворимы в воде. В водных растворах они существуют в виде биполярных ионов: В кислой
- 22. В кислой среде аминогруппа присоединяет протон, получает +заряд и становится катионом ( а-к-та ведет себя как
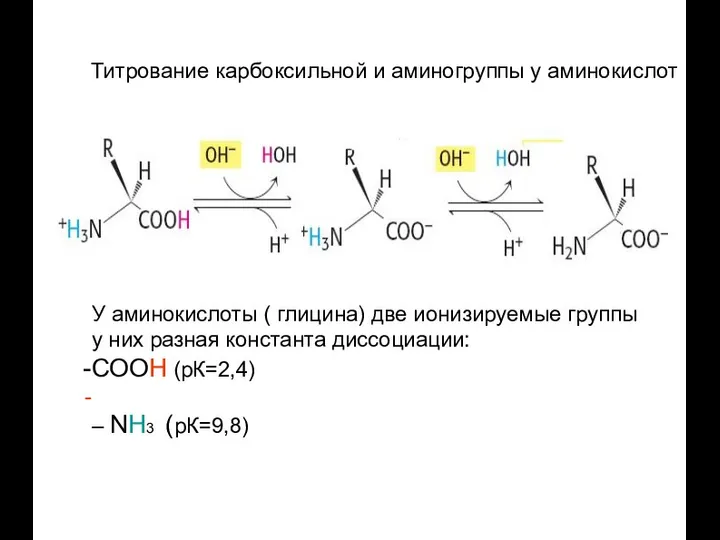
- 23. Титрование карбоксильной и аминогруппы у аминокислот У аминокислоты ( глицина) две ионизируемые группы у них разная
- 24. Для каждой аминокислоты существует своя изоэлектрическая точка (ИЭТ), т.е значение рН, при котором сумма +зарядов равна
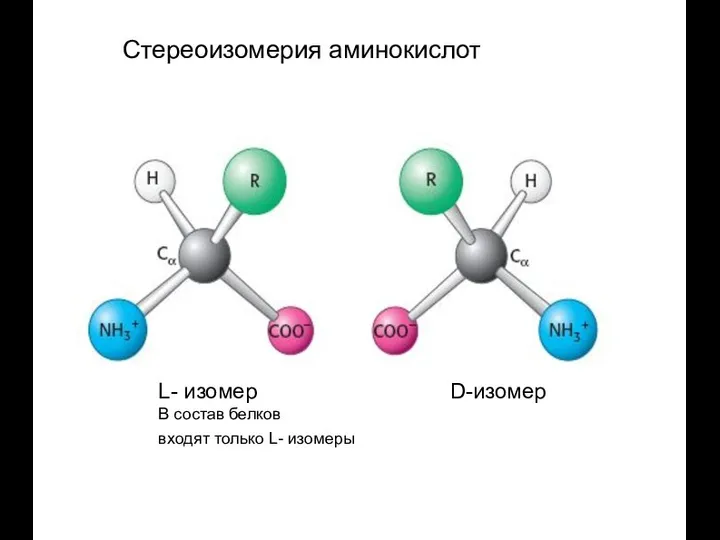
- 25. Стереоизомерия аминокислот L- изомер D-изомер В состав белков входят только L- изомеры
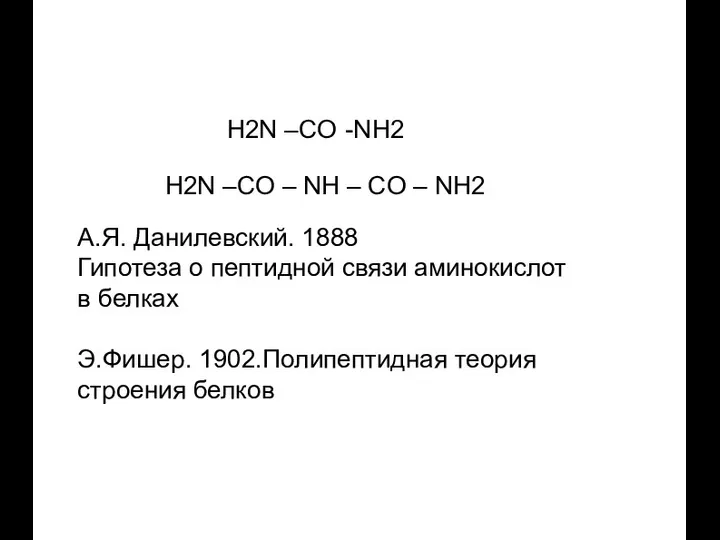
- 26. H2N –CO – NH – CO – NH2 H2N –CO -NH2 А.Я. Данилевский. 1888 Гипотеза о
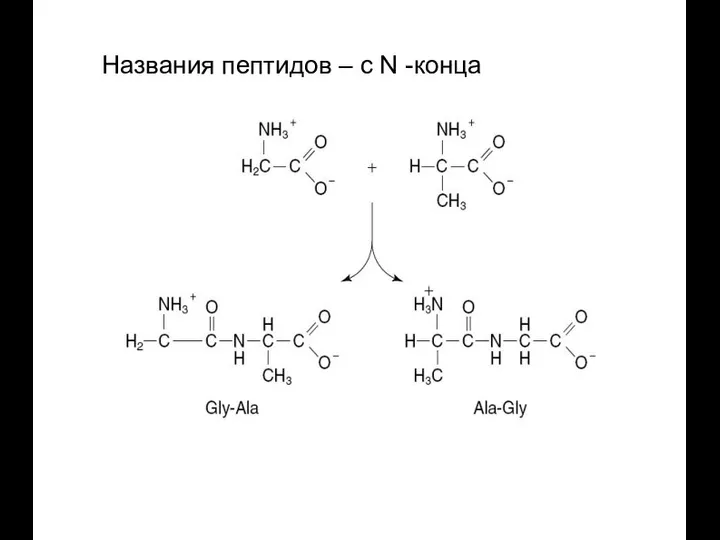
- 28. Названия пептидов – с N -конца
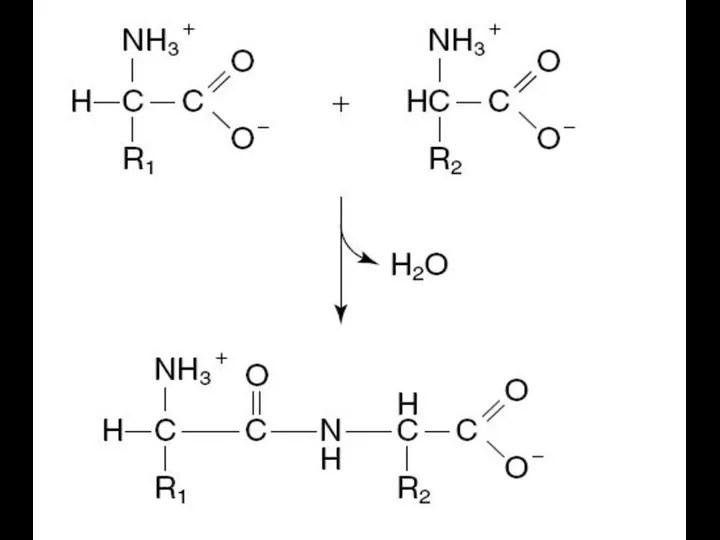
- 29. Пептиды: число а-к-тных остатков Ди- трипептиды 2-3 Олигопептиды 10-20 Полипептиды 20-50 Белки (способны 50 и более
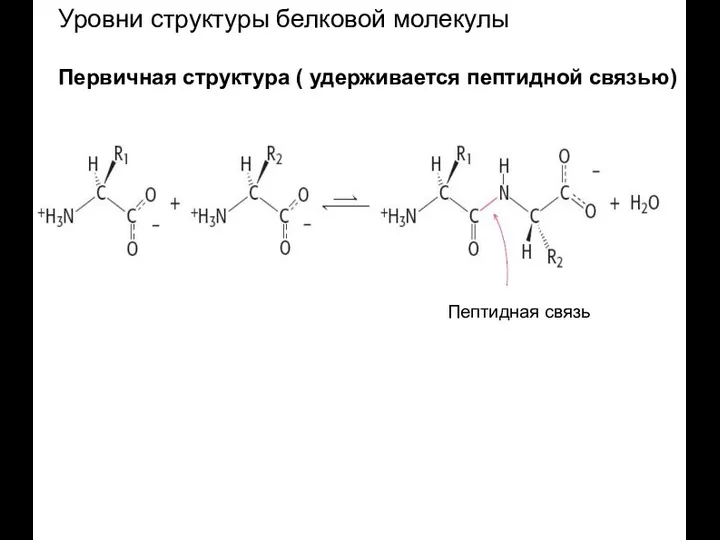
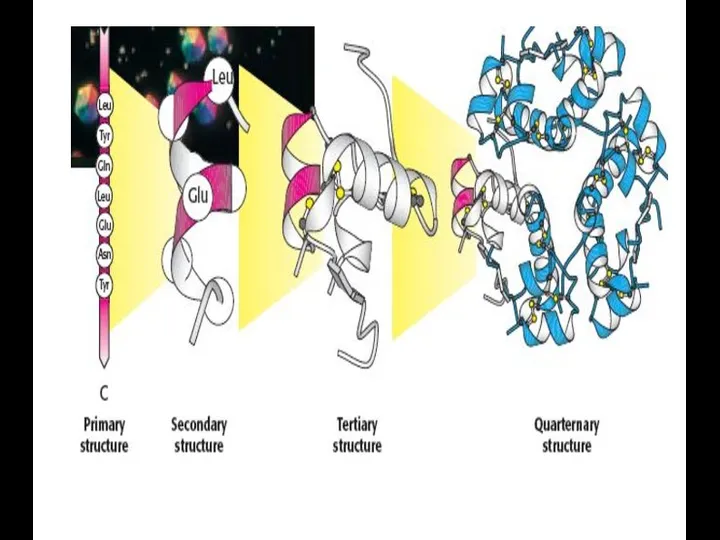
- 30. Пептидная связь Уровни структуры белковой молекулы Первичная структура ( удерживается пептидной связью)
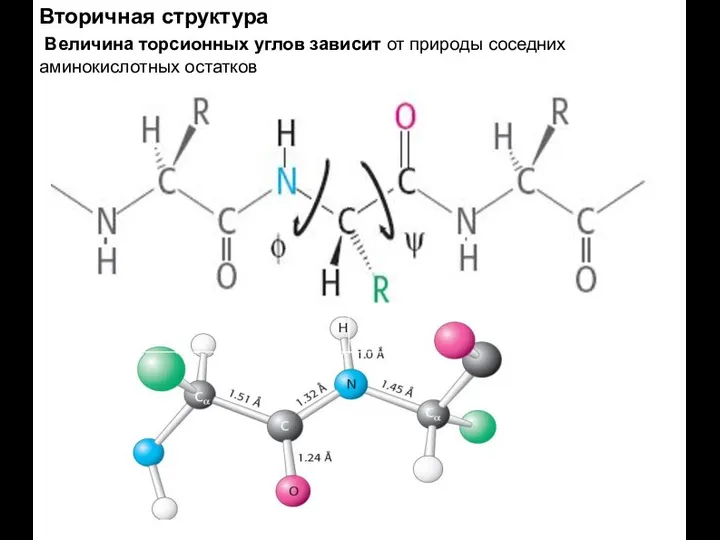
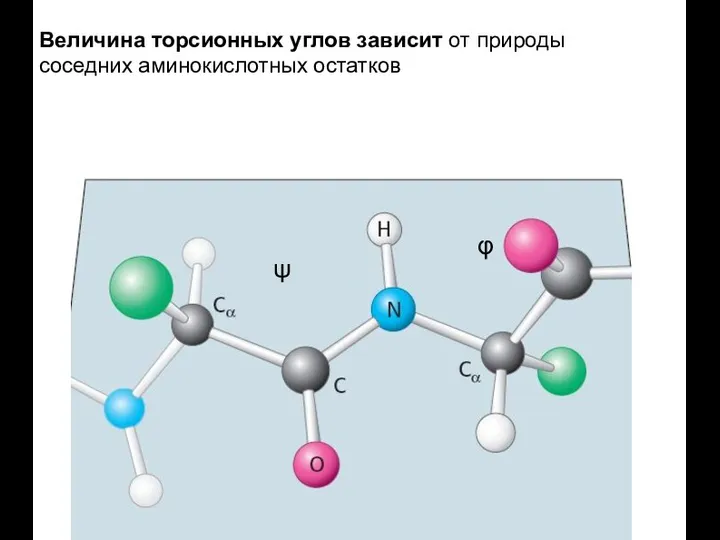
- 31. Вторичная структура Величина торсионных углов зависит от природы соседних аминокислотных остатков
- 32. φ ψ Величина торсионных углов зависит от природы соседних аминокислотных остатков
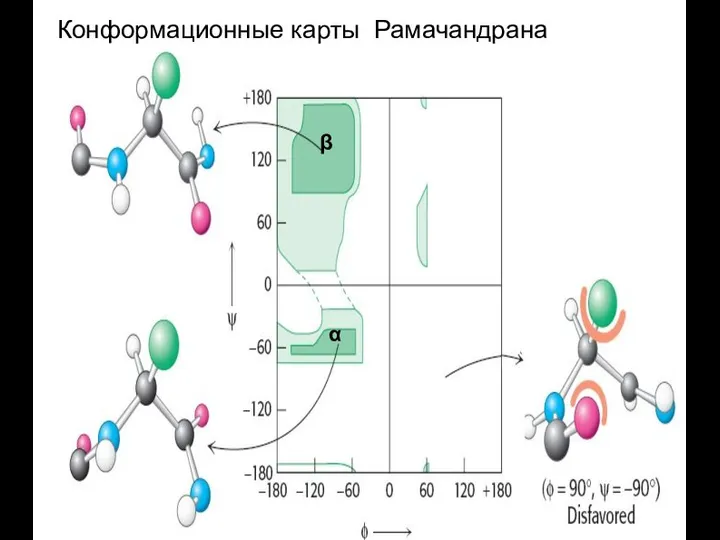
- 33. Конформационные карты Рамачандрана β α
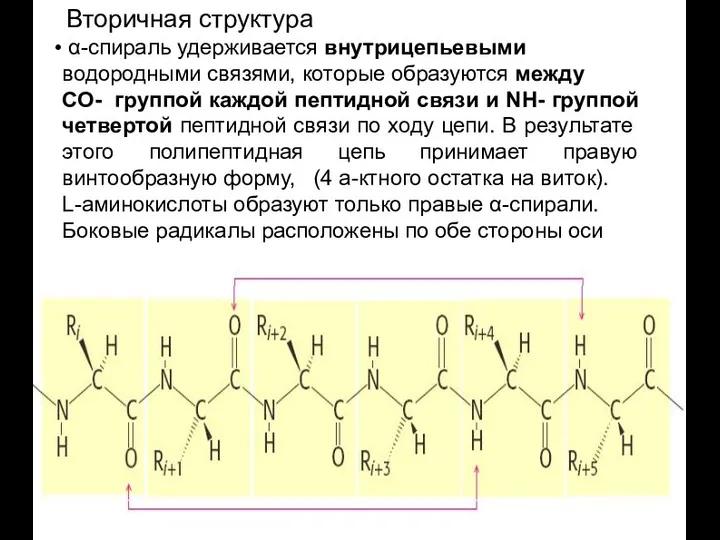
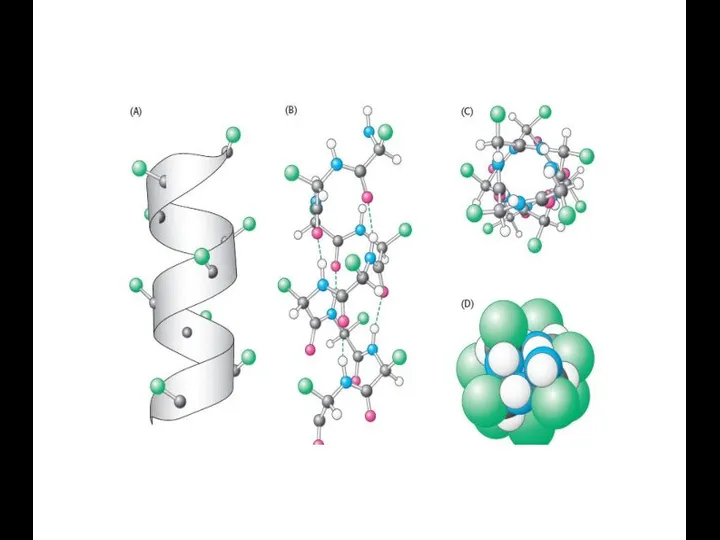
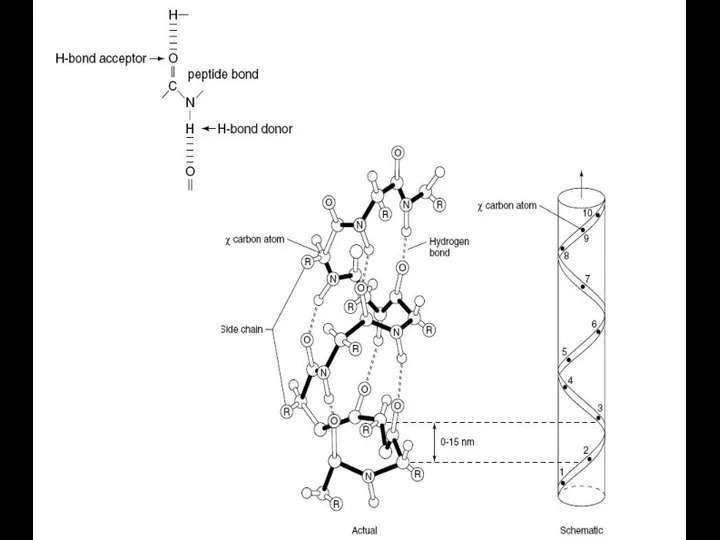
- 34. Вторичная структура α-спираль удерживается внутрицепьевыми водородными связями, которые образуются между СО- группой каждой пептидной связи и
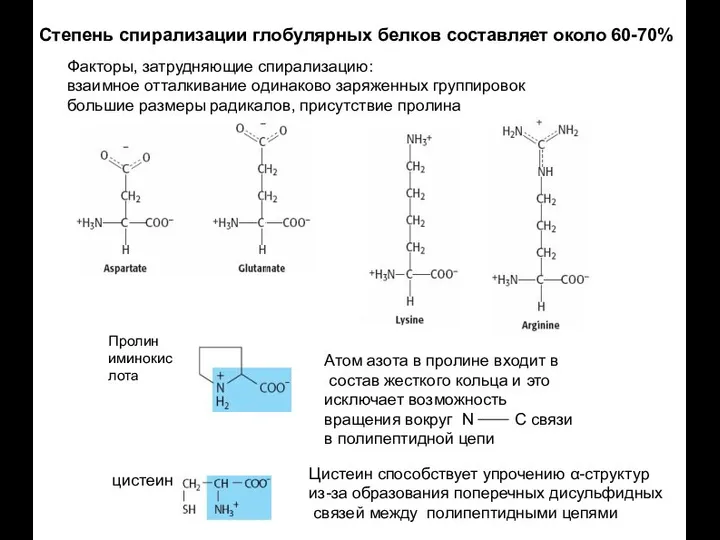
- 35. Степень спирализации глобулярных белков составляет около 60-70% Факторы, затрудняющие спирализацию: взаимное отталкивание одинаково заряженных группировок большие
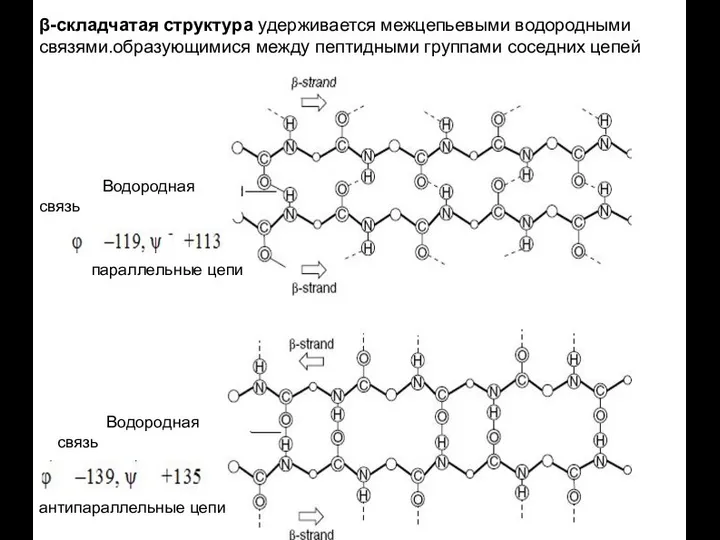
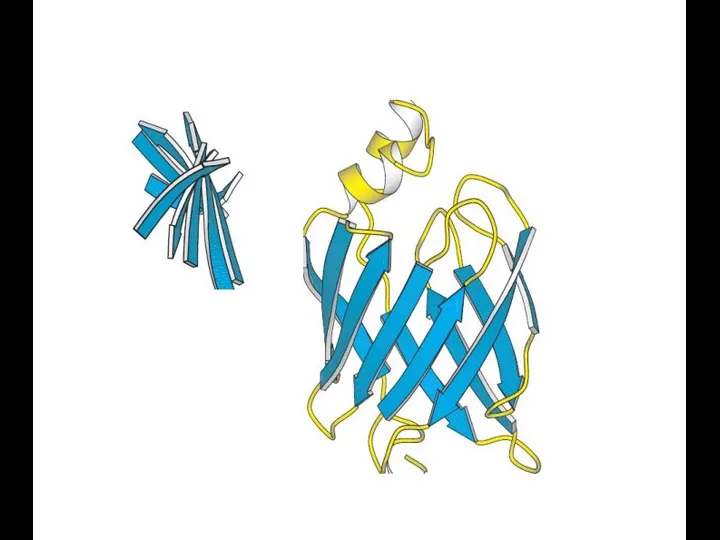
- 38. β-складчатая структура удерживается межцепьевыми водородными связями.образующимися между пептидными группами соседних цепей Водородная связь Водородная связь параллельные
- 39. Образованию β- складчатой структуры способствуют аминокислотные остатки с малыми размерами радикалов: глицин, аланин и др. β
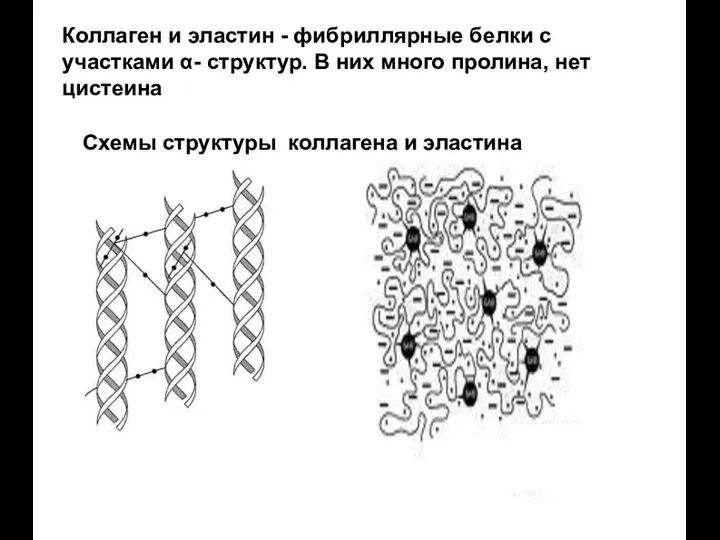
- 40. Схемы структуры коллагена и эластина Коллаген и эластин - фибриллярные белки с участками α- структур. В
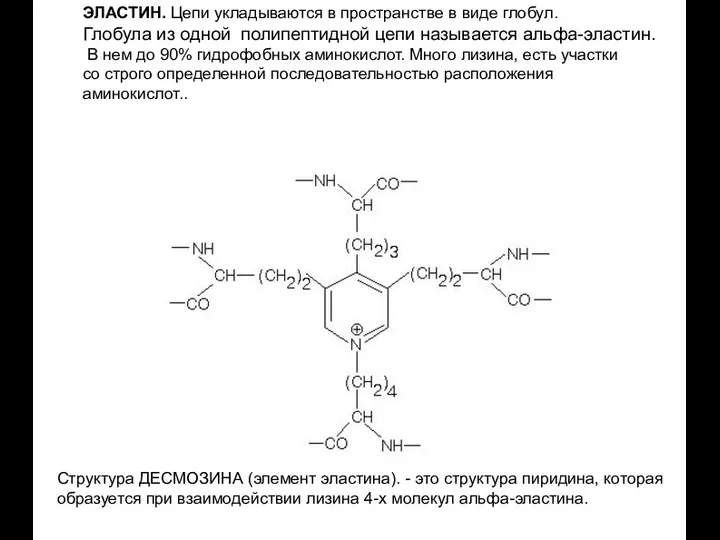
- 41. ЭЛАСТИН. Цепи укладываются в пространстве в виде глобул. Глобула из одной полипептидной цепи называется альфа-эластин. В
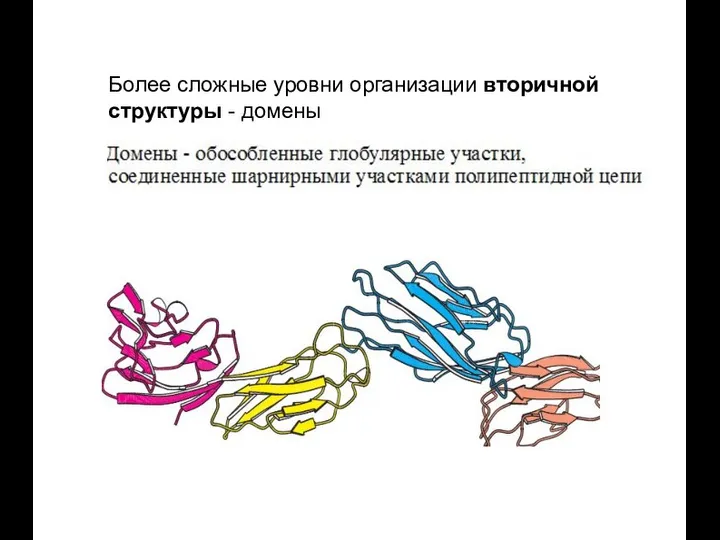
- 42. Более сложные уровни организации вторичной структуры - домены
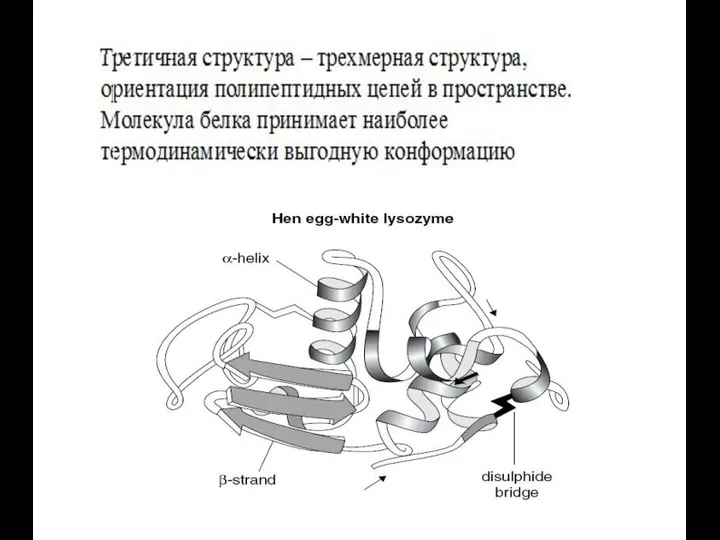
- 43. Третичная структура – это трехмерная ориентация полипептидных цепей. При образовании третичной структуры молекула белка принимает термодинамически
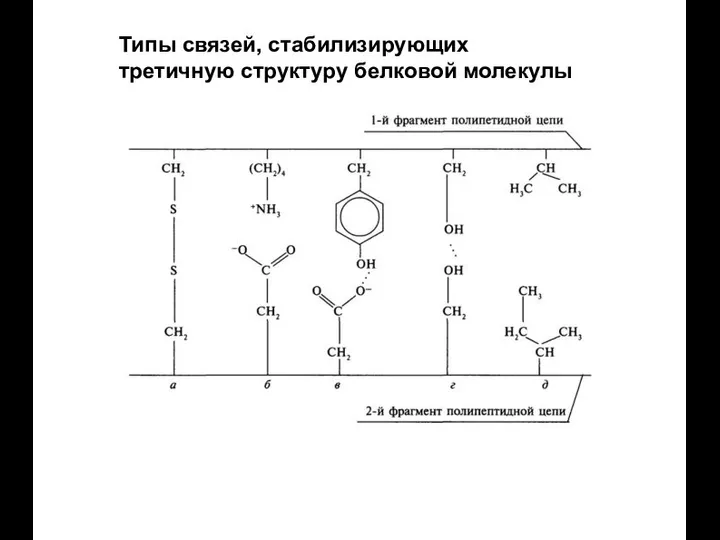
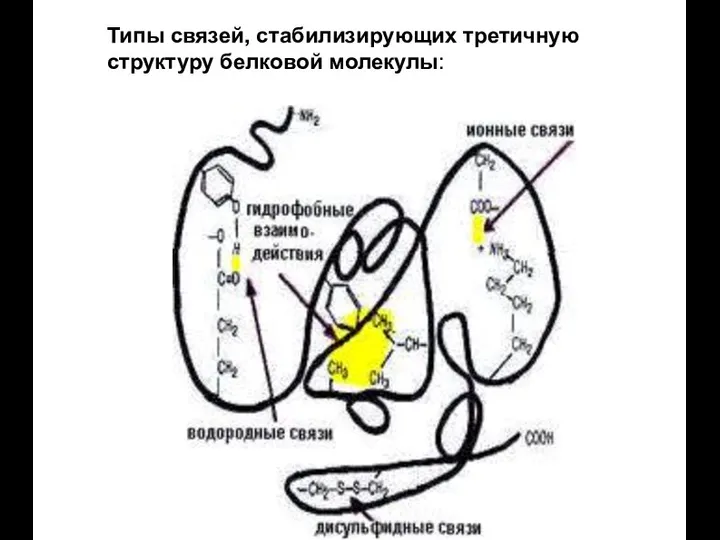
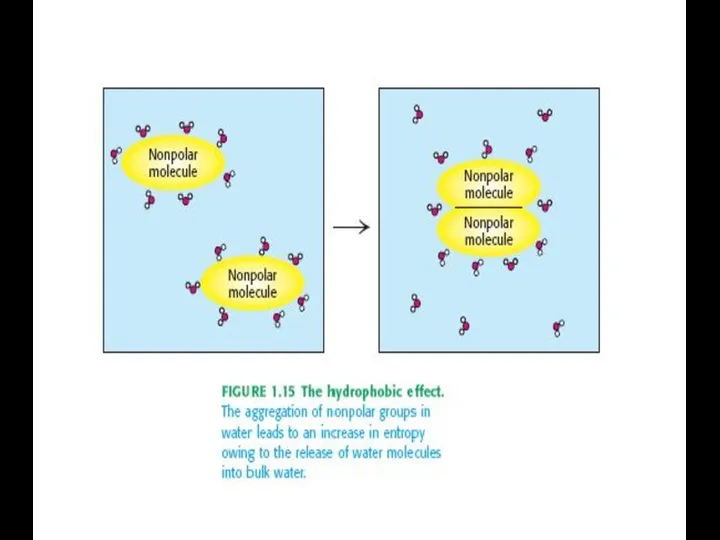
- 45. Типы связей, стабилизирующих третичную структуру белковой молекулы: 1. Гидрофобные взаимодействия между неполярными радикалами. 2. Дисульфидные связи
- 46. Типы связей, стабилизирующих третичную структуру белковой молекулы
- 47. Типы связей, стабилизирующих третичную структуру белковой молекулы:
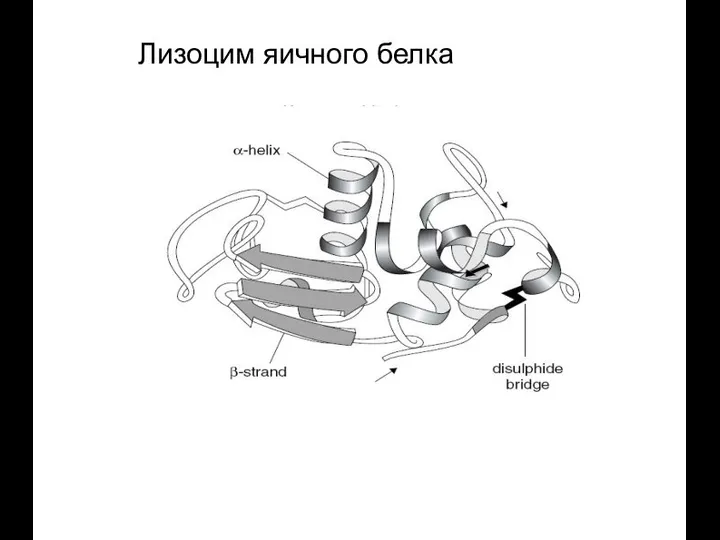
- 49. Лизоцим яичного белка
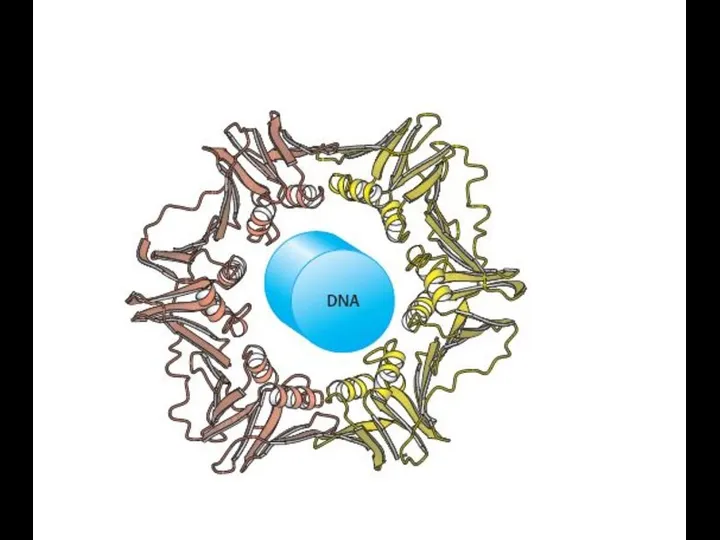
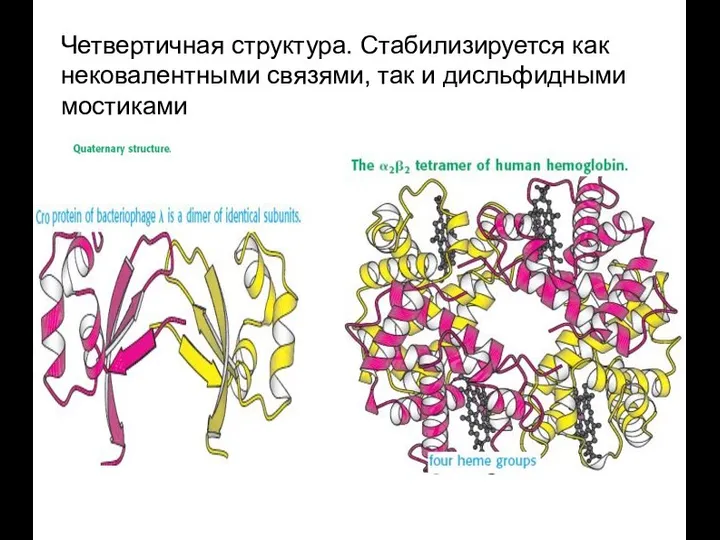
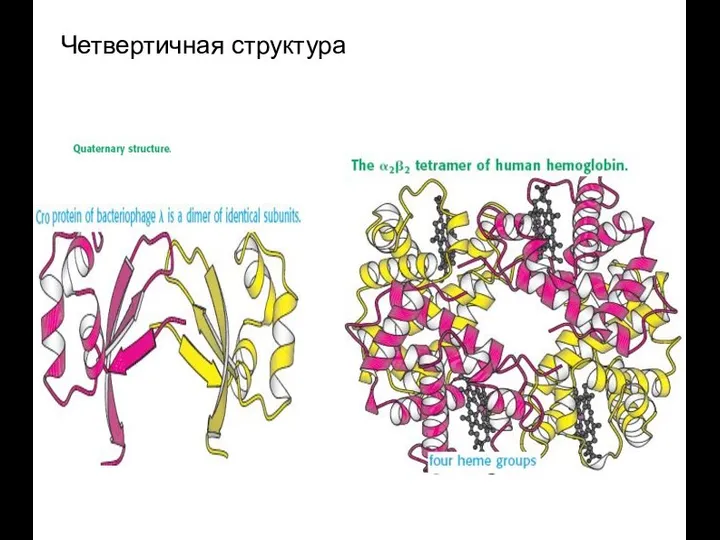
- 52. Четвертичная структура. Стабилизируется как нековалентными связями, так и дисльфидными мостиками
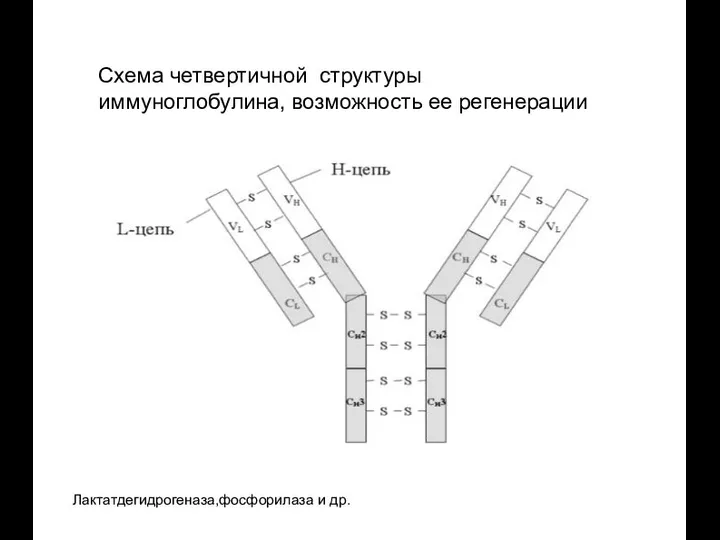
- 53. Схема четвертичной структуры иммуноглобулина, возможность ее регенерации Лактатдегидрогеназа,фосфорилаза и др.
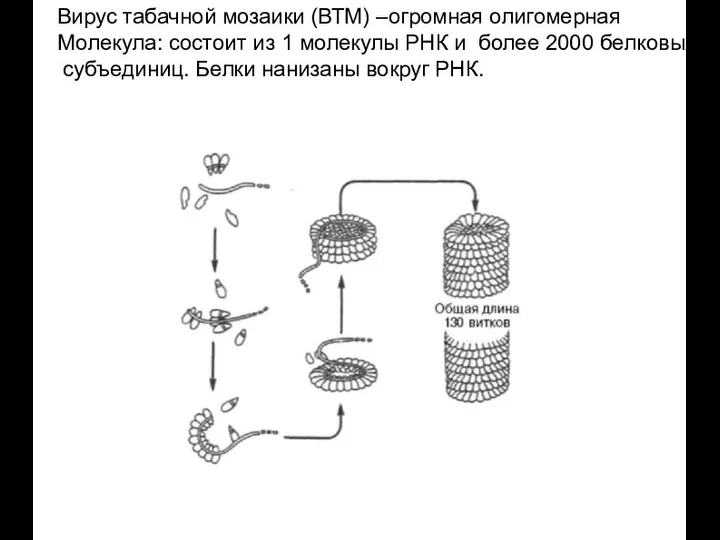
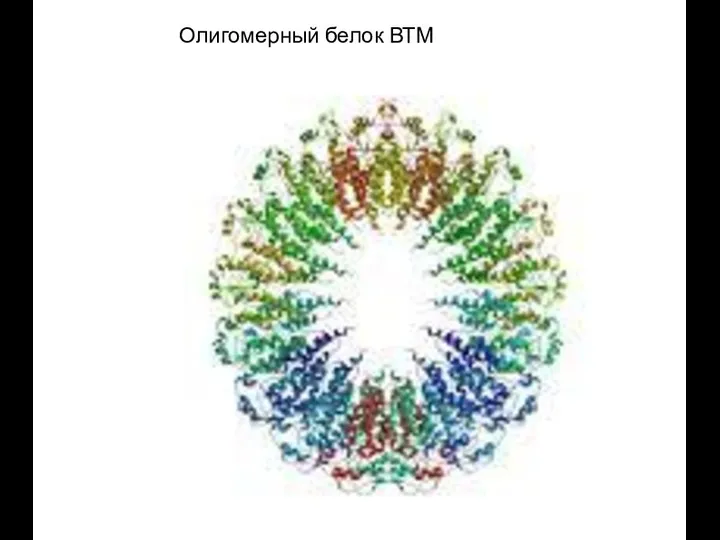
- 54. Вирус табачной мозаики (ВТМ) –огромная олигомерная Молекула: состоит из 1 молекулы РНК и более 2000 белковых
- 55. Олигомерный белок ВТМ
- 56. Четвертичная структура
- 58. Некоторые исследователи склонны рассматривать, и не без основания, существование пятого уровня структурной организации белков. Речь идет
- 62. Функции белков: Каталитическая функция Транспортная (альбумины, гемоглобин, пермеазы) Резервная функция (проламины, глютелины, овальбумин, лактоальбумин, белки икры)
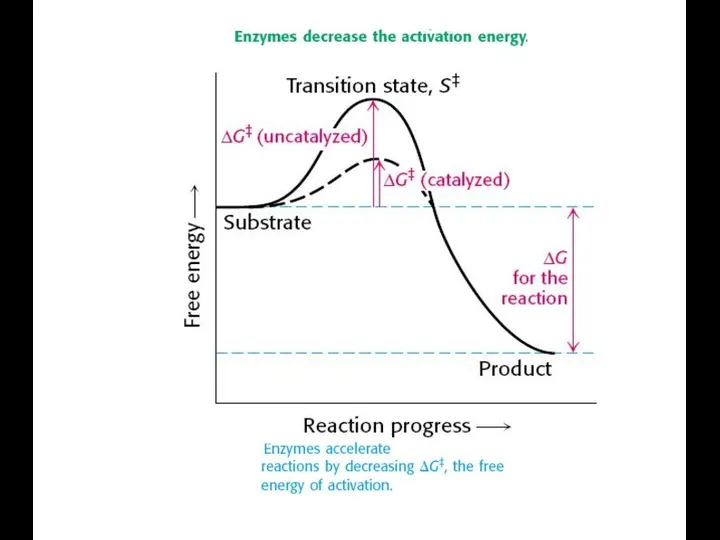
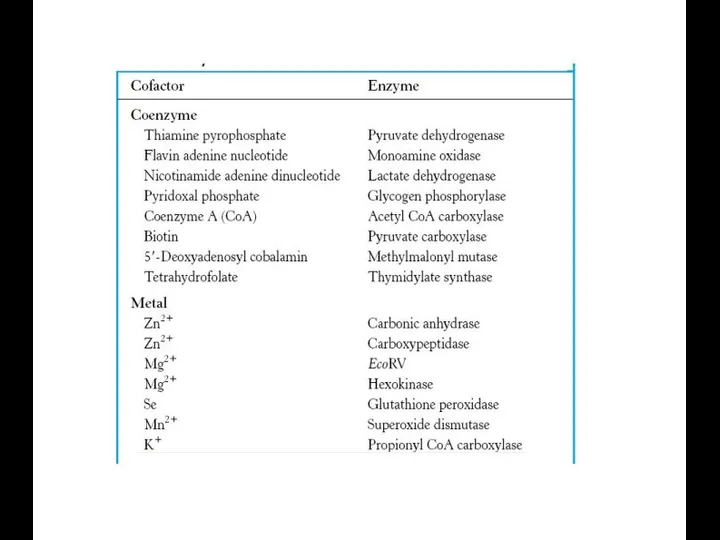
- 63. Ферменты – глобулярные белки. Сложные ферменты (холофермент) состоят из белкового и небелкового компонентов: апофермента и кофермента
- 64. Классификация ферментов Оксиредуктазы (окислительно- восстановительные реакции) Трансферазы (перенос функциональных групп) Гидролазы (гидролиз с присоединением воды) Лиазы
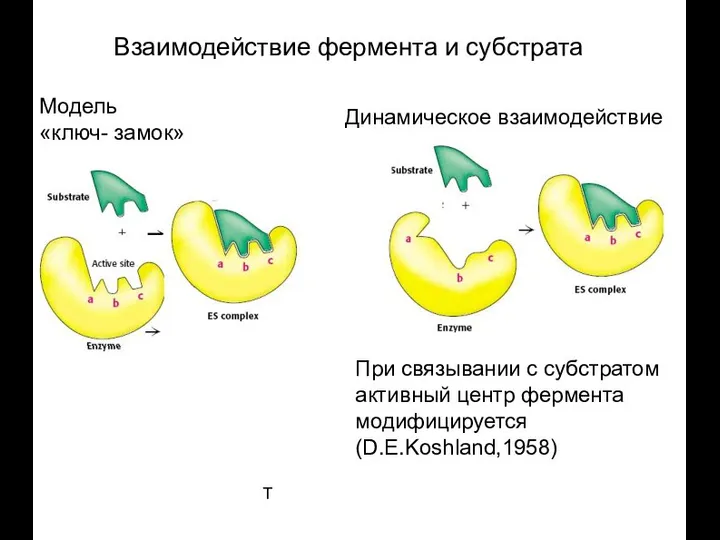
- 67. T Взаимодействие фермента и субстрата Модель «ключ- замок» При связывании с субстратом активный центр фермента модифицируется
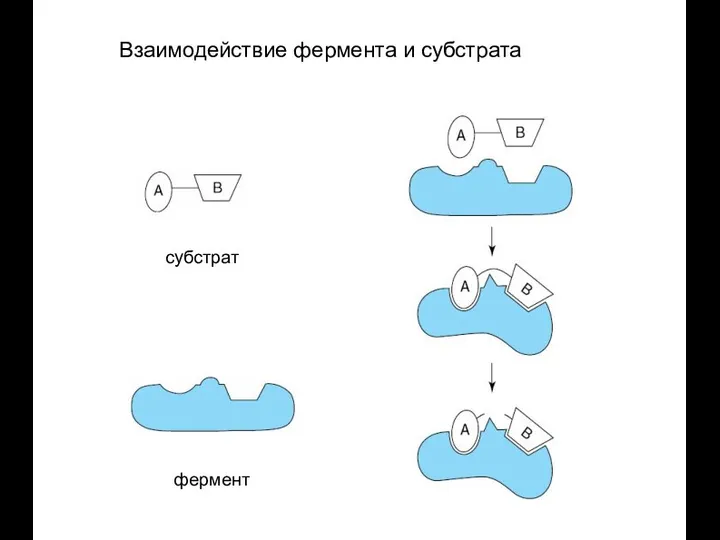
- 69. Взаимодействие фермента и субстрата субстрат фермент
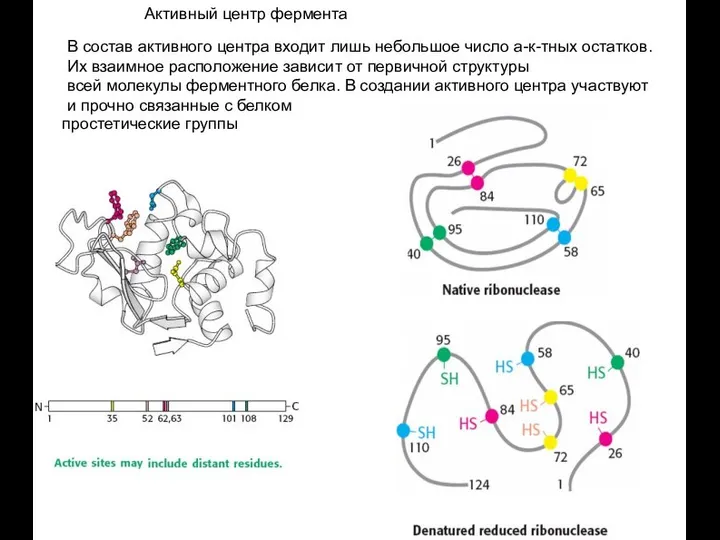
- 70. Активный центр фермента В состав активного центра входит лишь небольшое число а-к-тных остатков. Их взаимное расположение
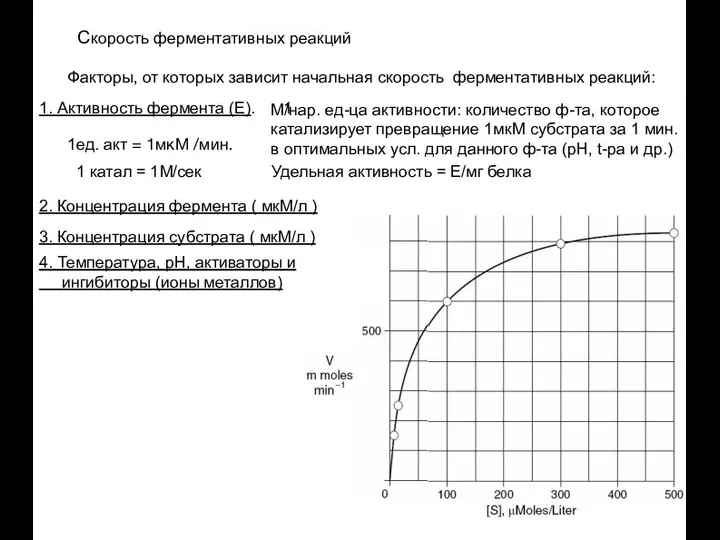
- 71. Скорость ферментативных реакций Факторы, от которых зависит начальная скорость ферментативных реакций: 1. Активность фермента (Е). 1
- 72. Различие между конкурентным и неконкурентным ингибитором
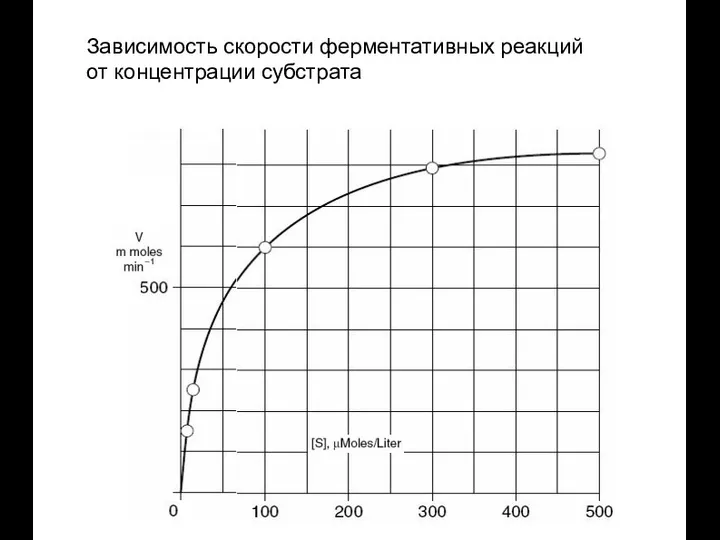
- 73. Зависимость скорости ферментативных реакций от концентрации субстрата
- 75. Скорость ферментативных реакций 1. Активность фермента (Е). 1 М/нар. единица активности: количество фермента, которое катализирует превращение
- 78. Скачать презентацию



























 Сегментация рынка Компания «Coca-cola»
Сегментация рынка Компания «Coca-cola» Ранения(повреждения) черепа, головного мозга, позвоночника и спинного мозга.
Ранения(повреждения) черепа, головного мозга, позвоночника и спинного мозга. КОНВЕРГЕНЦИЯ ИНТЕРНЕТА И ТЕЛЕВИДЕНИЯ КАК НОВЫЙ МЕДИЙНЫЙ СУПЕРГЕРОЙ
КОНВЕРГЕНЦИЯ ИНТЕРНЕТА И ТЕЛЕВИДЕНИЯ КАК НОВЫЙ МЕДИЙНЫЙ СУПЕРГЕРОЙ ФЕНОМЕНЫ ГРУППОВОЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ
ФЕНОМЕНЫ ГРУППОВОЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ Теоретические основы дисциплины "Территориальное планирование". Лекция 1
Теоретические основы дисциплины "Территориальное планирование". Лекция 1 Состояние и перспективы развития малой гидроэнергетики в России
Состояние и перспективы развития малой гидроэнергетики в России Разговорник. Турецкий язык
Разговорник. Турецкий язык Эксплуатационные характеристики (Э.Х.) энергоустановок
Эксплуатационные характеристики (Э.Х.) энергоустановок Цветущая сакура. Урок ИЗО в 4 классе
Цветущая сакура. Урок ИЗО в 4 классе Норийные ковши, скребки, ролики (пластиковые) для цепных транспортеров
Норийные ковши, скребки, ролики (пластиковые) для цепных транспортеров Программирование на Python
Программирование на Python Валютный курс рубля
Валютный курс рубля Orifleym. Менеджер 9%
Orifleym. Менеджер 9% Презентация "Экономическая сфера общества" - скачать презентации по Экономике
Презентация "Экономическая сфера общества" - скачать презентации по Экономике ОРГАНЫ УПРАВЛЕНИЯ И КОНТРОЛЯ УСТРОЙСТВА УПРАВЛЕНИЯ (УУС) СТАНЦИИ. ПОРЯДОК ПРОВЕРКИ РАБОТОСПОСОБНОСТИ УУС
ОРГАНЫ УПРАВЛЕНИЯ И КОНТРОЛЯ УСТРОЙСТВА УПРАВЛЕНИЯ (УУС) СТАНЦИИ. ПОРЯДОК ПРОВЕРКИ РАБОТОСПОСОБНОСТИ УУС Леонард Эйлер (1707-1783)
Леонард Эйлер (1707-1783) ПРИНЦИПЫ И ВИДЫ ПРИРОДОПОЛЬЗОВАНИЯ Выполнили: студенты группы Ю-101 Меженько Юлия Шевцова Екатерина
ПРИНЦИПЫ И ВИДЫ ПРИРОДОПОЛЬЗОВАНИЯ Выполнили: студенты группы Ю-101 Меженько Юлия Шевцова Екатерина Политические партии
Политические партии Проектирование двухэтажного коттеджа с гаражом
Проектирование двухэтажного коттеджа с гаражом Путешествие в страну дробных чисел Урок математики в 6 классе Автор: учитель математики МОУ «СОШ №4» Шарова Валентина Степ
Путешествие в страну дробных чисел Урок математики в 6 классе Автор: учитель математики МОУ «СОШ №4» Шарова Валентина Степ Дом из дров и глины по технологии Cordwood
Дом из дров и глины по технологии Cordwood Антифосфолипидный синдром
Антифосфолипидный синдром Ключ к тесту
Ключ к тесту Адаптация детей и их родителей в д/у ЛЯПУНОВА М.В. ВОСПИТАТЕЛЬ ГРУППЫ №12 МАДОУ №95 «БАЛКЫШ» Г. НАБЕРЕЖНЫЕ ЧЕЛНЫ ТАТАРСТАН
Адаптация детей и их родителей в д/у ЛЯПУНОВА М.В. ВОСПИТАТЕЛЬ ГРУППЫ №12 МАДОУ №95 «БАЛКЫШ» Г. НАБЕРЕЖНЫЕ ЧЕЛНЫ ТАТАРСТАН  Базовые движения
Базовые движения Строительство универсальной спортивной площадки
Строительство универсальной спортивной площадки Презентация на тему Сказка Колобок Мультфильм
Презентация на тему Сказка Колобок Мультфильм  Пожар - презентация для начальной школы_
Пожар - презентация для начальной школы_