Содержание
- 3. Буферный раствор – раствор, содержащий протолитическую равновесную систему, способную поддерживать постоянное значение рН при разбавлении или
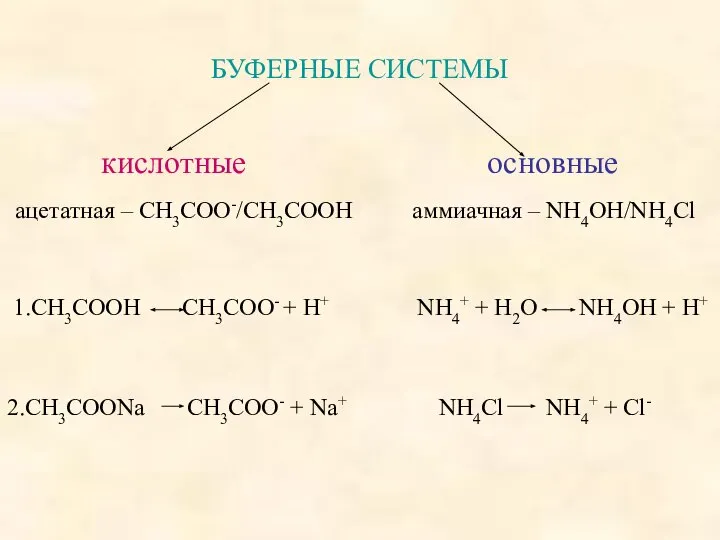
- 4. БУФЕРНЫЕ СИСТЕМЫ кислотные основные ацетатная – СН3СОО-/СН3СООН аммиачная – NH4OH/NH4Cl 1.СН3СООН СН3СОО- + Н+ NH4+ +
- 5. Уравнение Гендерсона -Хассельбаха Для кислотных буферных систем Для основных буферных систем
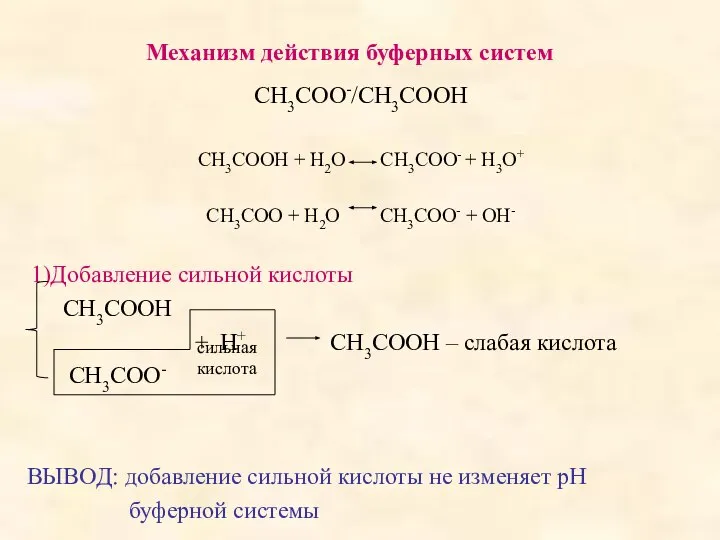
- 6. Механизм действия буферных систем СН3СОО-/СН3СООН СН3СООН + Н2О СН3СОО- + Н3О+ СН3СОО + Н2О СН3СОО- +
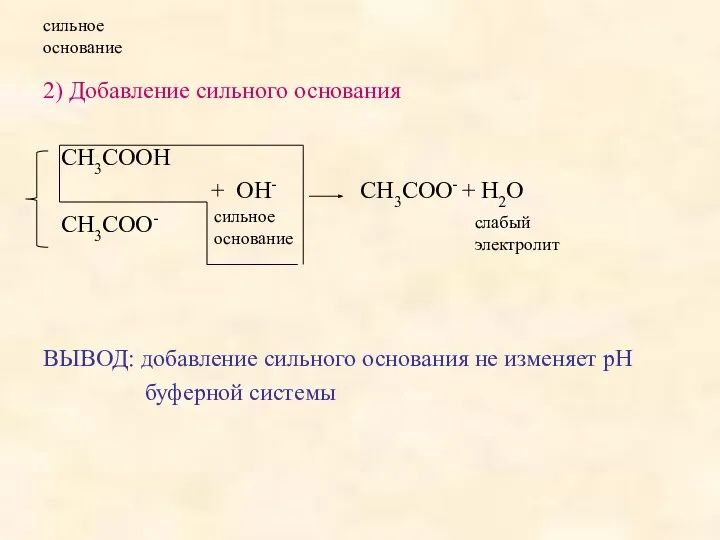
- 7. сильное основание 2) Добавление сильного основания СН3СООН + ОН- СН3СОО- + Н2О СН3СОО- ВЫВОД: добавление сильного
- 8. 3) Разбавление Предел – пока концентрация компонентов буферных растворов не станет меньше 0,01 моль/л.
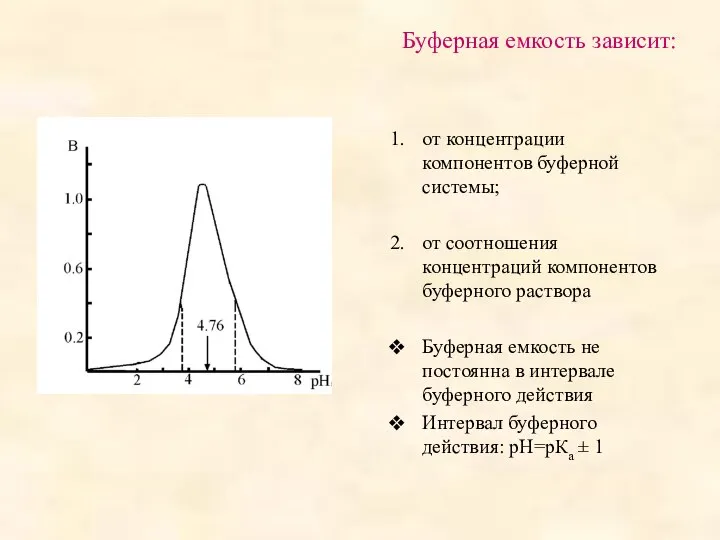
- 9. Буферная емкость Это величина, характеризующая способность буферного раствора противодействовать изменению рН среды при добавлении кислот и
- 10. Буферная емкость зависит: от концентрации компонентов буферной системы; от соотношения концентраций компонентов буферного раствора Буферная емкость
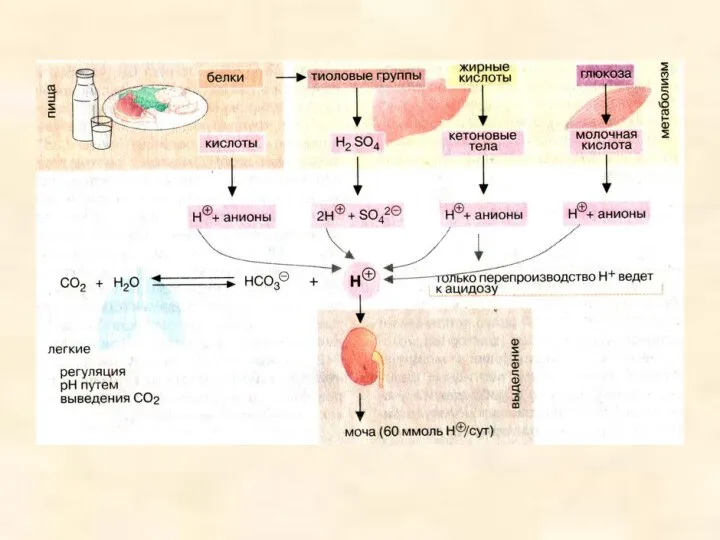
- 11. Буферные системы организма человека гидрокарбонатная, гемоглобиновая, гидрофосфатная и белковая. Буферные системы крови Буферные системы слюны гидрокарбонатная,
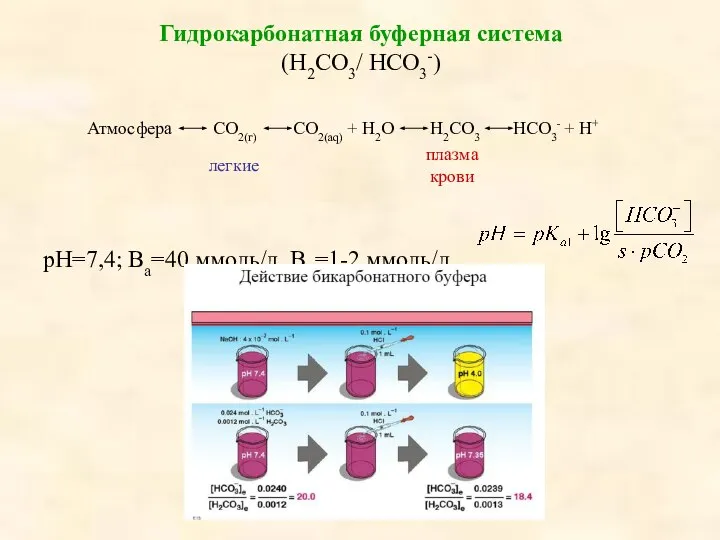
- 12. Гидрокарбонатная буферная система (Н2СО3/ НСО3-) Атмосфера СО2(г) СО2(aq) + Н2О Н2СО3 НСО3- + H+ рН=7,4; Ва=40
- 13. Гидрофосфатная буферная система (плазма крови – NaH2PO4/ Na2HPO4, клетки - КH2PO4/ К2HPO4) H2PO4- H+ + HPO42-
- 15. Скачать презентацию






 Антропогенное воздействие на гидросферу
Антропогенное воздействие на гидросферу Christmas
Christmas Методология и методы педагогических исследований
Методология и методы педагогических исследований Начертательная геометрия. Изучение начертательной геометрии и черчения
Начертательная геометрия. Изучение начертательной геометрии и черчения Свойства древесины
Свойства древесины Политика и власть
Политика и власть Календарь дат и событий. (Окружающий мир, 4 класс)
Календарь дат и событий. (Окружающий мир, 4 класс) Презентация Наследственное право
Презентация Наследственное право Преступность несовершеннолетних и пути её преодолевания
Преступность несовершеннолетних и пути её преодолевания Проблемы грамматического описания неглагольных частей речи. Лекция 4
Проблемы грамматического описания неглагольных частей речи. Лекция 4 Триггеры
Триггеры Урок китайского языка. 朋友
Урок китайского языка. 朋友 Древнегреческие ученые
Древнегреческие ученые Мировая валютная система (МВС) и международные валютные отношения.
Мировая валютная система (МВС) и международные валютные отношения. Лабораторная диагностика аденовирусной и герпетической инфекции
Лабораторная диагностика аденовирусной и герпетической инфекции  Тема 4. Конкуренция в маркетинге Понятие и содержание конкуренции Виды маркетинговой конкуренции Стратегии рыночных конкуренто
Тема 4. Конкуренция в маркетинге Понятие и содержание конкуренции Виды маркетинговой конкуренции Стратегии рыночных конкуренто Сибирь постиндустриальная
Сибирь постиндустриальная Классификация структур данных. (Лекция 8)
Классификация структур данных. (Лекция 8) Зубчатые передачи
Зубчатые передачи Android shared preferences
Android shared preferences Введение в события
Введение в события Объектноориентированное программирование. Наследование
Объектноориентированное программирование. Наследование CORPORATE STRATEGY AND STRUCTURE
CORPORATE STRATEGY AND STRUCTURE A Chaisg timcheall an t-Saoghail. Пасха во всём мире
A Chaisg timcheall an t-Saoghail. Пасха во всём мире Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4)
Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4) Русский национальный костюм
Русский национальный костюм Управляющие устройства в микроконтроллерах. (Лекция 9)
Управляющие устройства в микроконтроллерах. (Лекция 9) Презентация Преступления. Признаки преступления. Классификация преступлений
Презентация Преступления. Признаки преступления. Классификация преступлений