Содержание
- 2. Формирование расчетной системы уравнений Тогда энтропия Sg этой первой подсистемы окажется равной: где - молярная (отнесенная
- 3. Формирование расчетной системы уравнений К третьей подсистеме отнесем конденсированные растворы, например, X1и X2. При этом предполагается,
- 4. Формирование расчетной системы уравнений Условия, связывающие параметры многокомпонентных рабочих тел. Функция Лагранжа. Определение параметров равновесного состояния
- 5. Формирование расчетной системы уравнений Условия, связывающие параметры многокомпонентных рабочих тел. Функция Лагранжа. Б. При установлении равновесного
- 6. Формирование расчетной системы уравнений Условия, связывающие параметры многокомпонентных рабочих тел. Функция Лагранжа. В. При всех превращениях
- 7. Формирование расчетной системы уравнений Условия, связывающие параметры многокомпонентных рабочих тел. Функция Лагранжа. Г. При всех превращениях
- 8. Метод Лагранжа в термодинамике Для отыскания условного экстремума в теоретической физике широко используется метод Лагранжа, в
- 9. Метод Лагранжа в термодинамике Для того, чтобы найти условный экстремум величины S как функции нескольких переменных,
- 10. Метод Лагранжа в термодинамике Система уравнений для определения параметров равновесных систем. Дифференцирование функции Лагранжа начнем с
- 11. Метод Лагранжа в термодинамике Система уравнений для определения параметров равновесных систем. В уравнении (3) энтропия и
- 12. Метод Лагранжа в термодинамике Система уравнений для определения параметров равновесных систем. Возьмем теперь частные производные функции
- 13. Метод Лагранжа в термодинамике Система уравнений для определения параметров равновесных систем. Входящее в (6) выражение для
- 14. Алгоритм численного расчета Расчетная система уравнений в окончательном виде содержит: Набор уравнений, учитывающий индивидуальные энтропии газообразных
- 15. Алгоритм численного расчета 5. Уравнение состояния идеального газа: 6. Уравнение для расчета полной внутренней энергии: 7.
- 16. Алгоритм численного расчета Всего система содержит: (Ng + Nc + Ne + 5) уравнений и (Ng
- 18. Скачать презентацию















 Численный анализ истории погружения, термической эволюции и процессов генерации углеводородов в осадочных бассейнах
Численный анализ истории погружения, термической эволюции и процессов генерации углеводородов в осадочных бассейнах  Древний Вавилон
Древний Вавилон Базовые алгоритмы обработки одномерных массивов
Базовые алгоритмы обработки одномерных массивов Основы информатики и прграммирования» Нуридинов Азизжон Ф
Основы информатики и прграммирования» Нуридинов Азизжон Ф Лазеры на красителях
Лазеры на красителях  Управление тестированием. Анализ типичных проблем Александр Александров. УЦ Люксофт
Управление тестированием. Анализ типичных проблем Александр Александров. УЦ Люксофт Государственный долг: причины возникновения и следствия
Государственный долг: причины возникновения и следствия  ЗВІТ ПРО ВИКОНАННЯ ПРОГРАМИ « Основні орієнтири виховання» Підготувала : класний керівник 7 класу Сахно В.В.
ЗВІТ ПРО ВИКОНАННЯ ПРОГРАМИ « Основні орієнтири виховання» Підготувала : класний керівник 7 класу Сахно В.В. Влияние социальных сетей на ментальное здоровье людей
Влияние социальных сетей на ментальное здоровье людей UML. Диаграмма Use Case
UML. Диаграмма Use Case Кафедра общей хирургии КГМУ Лекция Гнойные заболевания костей и суставов
Кафедра общей хирургии КГМУ Лекция Гнойные заболевания костей и суставов  Скифская культура
Скифская культура Первый космонавт – Юрий Гагарин
Первый космонавт – Юрий Гагарин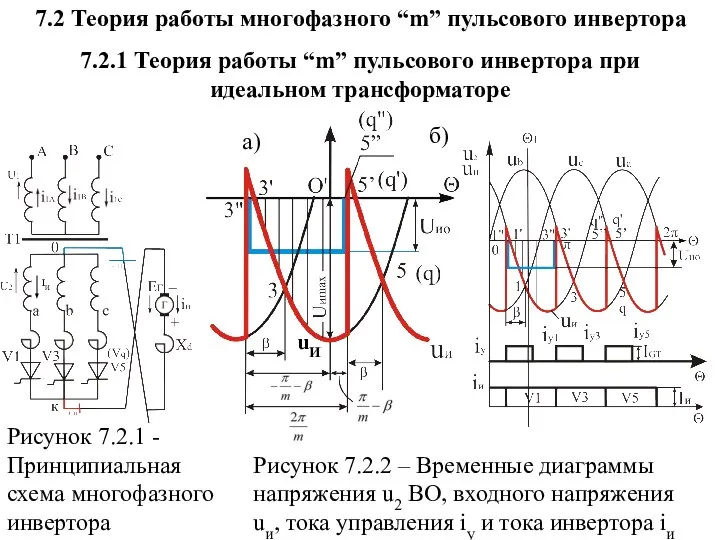 Теория работы многофазного “m” пульсового инвертора
Теория работы многофазного “m” пульсового инвертора Logistica în distribuție (Aval)
Logistica în distribuție (Aval) Европейская литература и нацизм
Европейская литература и нацизм Ныне праздник Рождества, славьте Бога все сердца
Ныне праздник Рождества, славьте Бога все сердца Рычаг и блок
Рычаг и блок Классификация и характеристика пищевых добавок, производимых фирмой «АРТ Современные научные технологии»
Классификация и характеристика пищевых добавок, производимых фирмой «АРТ Современные научные технологии» Запас вооруженных сил РФ
Запас вооруженных сил РФ Uniforme scolaire. "Pour" et "Contre"
Uniforme scolaire. "Pour" et "Contre" 7+ способов испортить презентацию
7+ способов испортить презентацию Работа со счётом. Депозиты Дубров М.А.© Преподаватель «Центра информационной культуры» Санкт-Петербург 2007 год.
Работа со счётом. Депозиты Дубров М.А.© Преподаватель «Центра информационной культуры» Санкт-Петербург 2007 год. Решение метрических задач
Решение метрических задач Компонувальник. Патерни проектування
Компонувальник. Патерни проектування Культурологические идеи эпохи Возрождения и Нового Времени
Культурологические идеи эпохи Возрождения и Нового Времени Главное в 7 номере журнала «Справочник кадровика»
Главное в 7 номере журнала «Справочник кадровика» Формы и методы контроля
Формы и методы контроля