Содержание
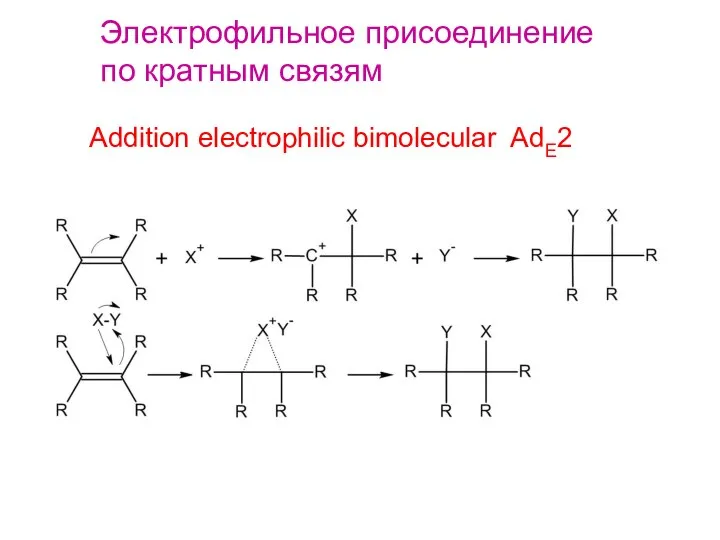
- 2. Электрофильное присоединение по кратным связям Addition electrophilic bimolecular AdE2
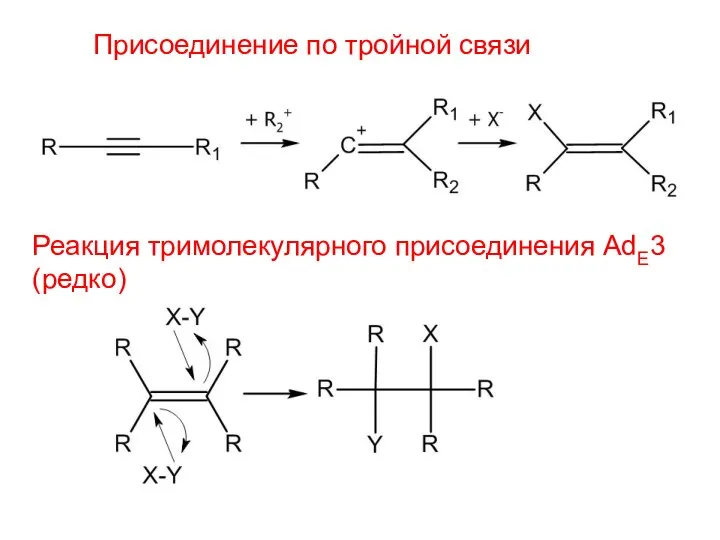
- 3. Присоединение по тройной связи Реакция тримолекулярного присоединения AdE3 (редко)
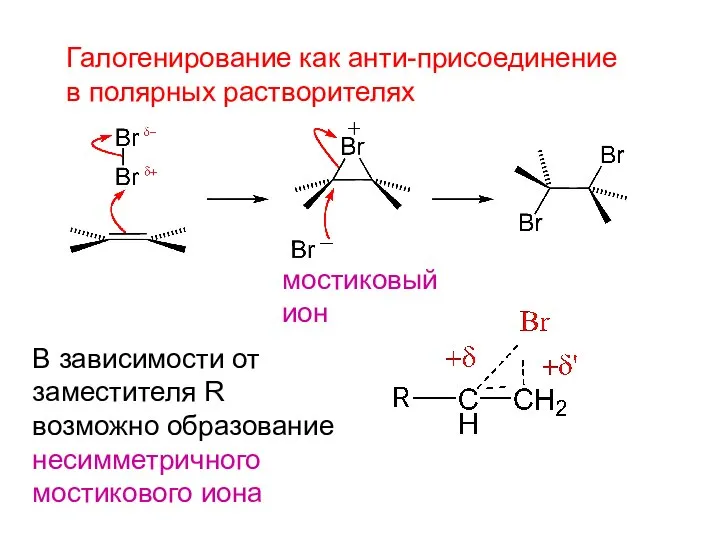
- 4. Галогенирование как анти-присоединение в полярных растворителях В зависимости от заместителя R возможно образование несимметричного мостикового иона
- 5. РСА галогенониевых ионов (длины связей в ангстремах) Асимметрия больше, чем для бромониевых иодониевых ионов С-С в
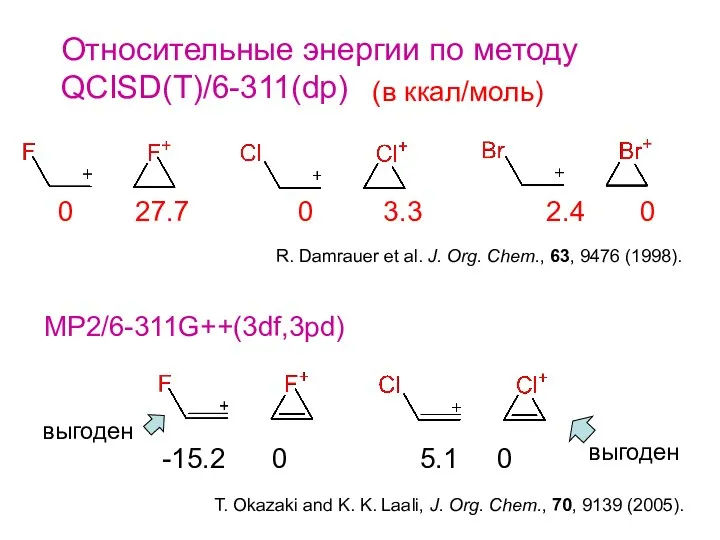
- 6. Относительные энергии по методу QCISD(T)/6-311(dp) 0 27.7 0 3.3 2.4 0 (в ккал/моль) R. Damrauer et
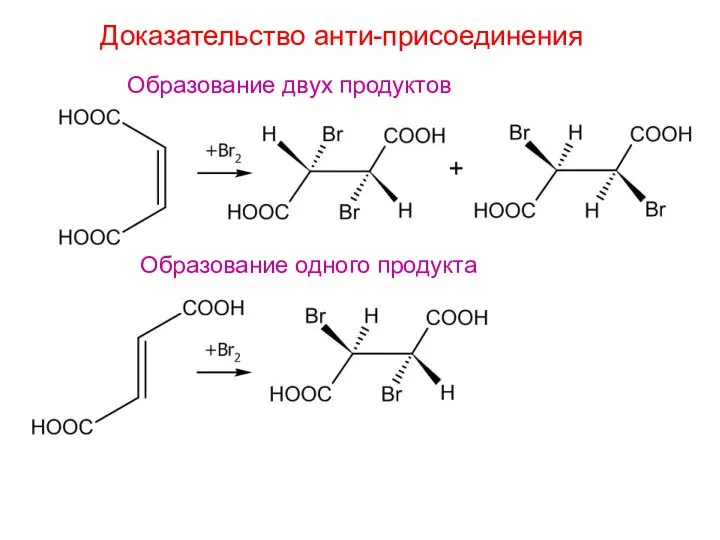
- 7. Доказательство анти-присоединения Образование двух продуктов Образование одного продукта
- 8. Влияние полярности растворителя Pr-CH=CH2 + Br2 Pr-CHBr-CH2Br Растворитель H2O CF3CH2OH MeOH MeCOOH k25o л/(моль.сек) 2.107 7.104
- 9. Кинетика Хлорирование (обычно второго порядка): w = k [RRC=CRR] [Cl2 ] Бромирование ( более сложный процесс):
- 10. w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR] [Br2]2 + k3[RRC=CRR][Br2][Br -] Кинетика бромирования В MeOH –
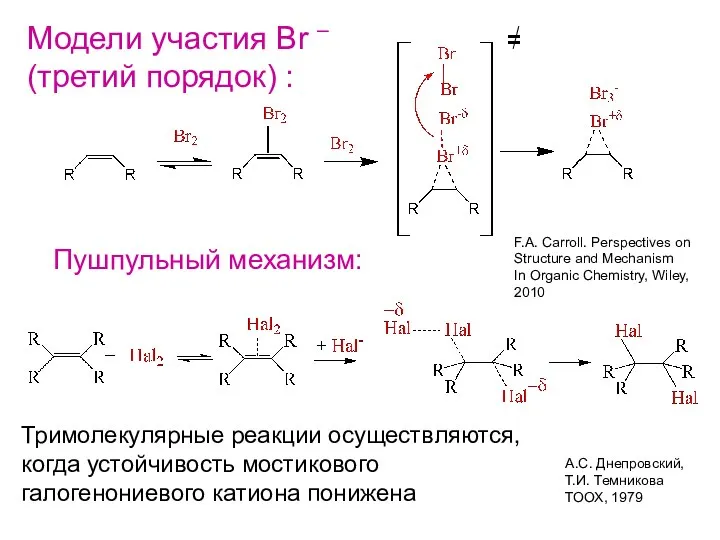
- 11. Модели участия Br – (третий порядок) : F.A. Carroll. Perspectives on Structure and Mechanism In Organic
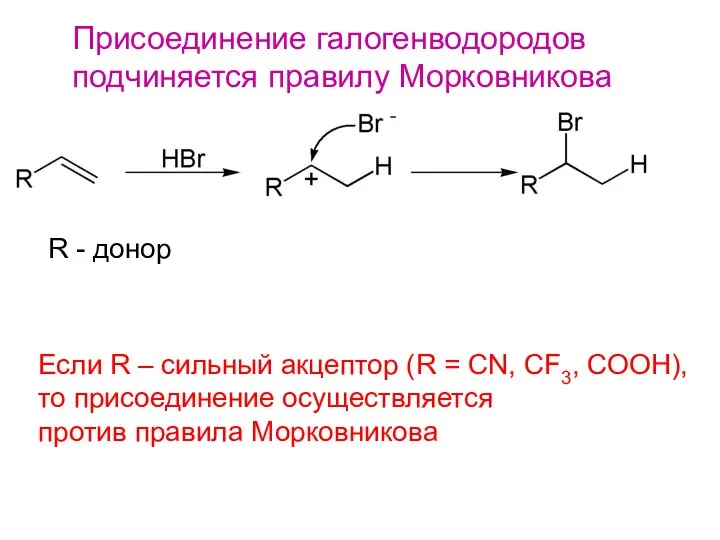
- 12. Присоединение галогенводородов подчиняется правилу Морковникова R - донор Если R – сильный акцептор (R = СN,
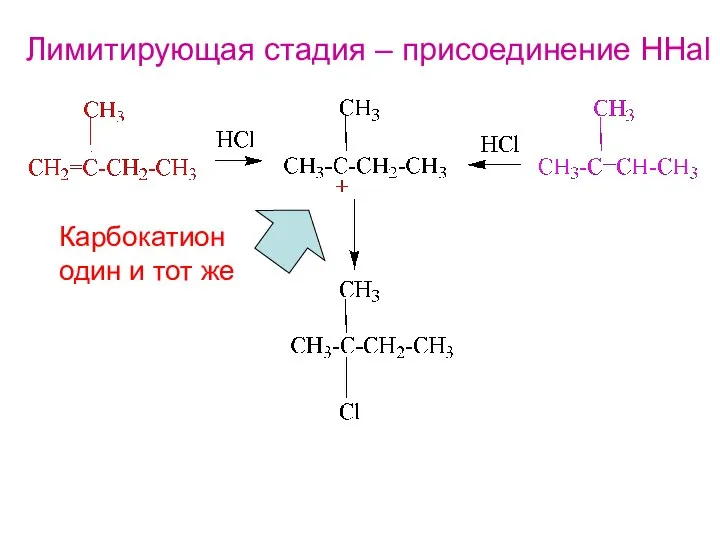
- 13. Лимитирующая стадия – присоединение HHal Карбокатион один и тот же
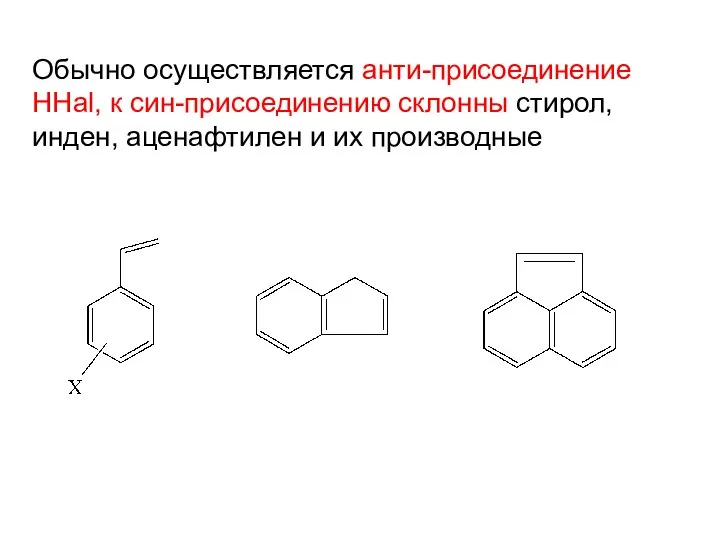
- 14. Обычно осуществляется анти-присоединение HHal, к син-присоединению склонны стирол, инден, аценафтилен и их производные
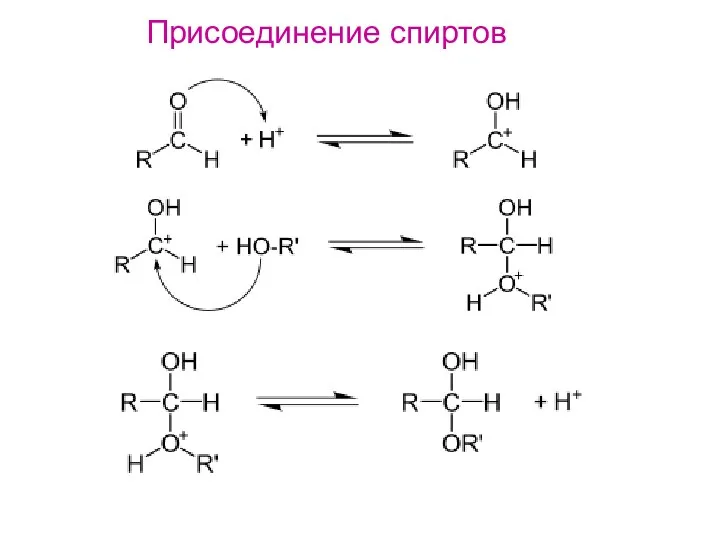
- 15. Типичные реакции электрофильного присоединения: 1. Гидратация. 2. Присоединение спирта2. Присоединение спирта с образованием простого эфира. 3.
- 16. Присоединение спиртов
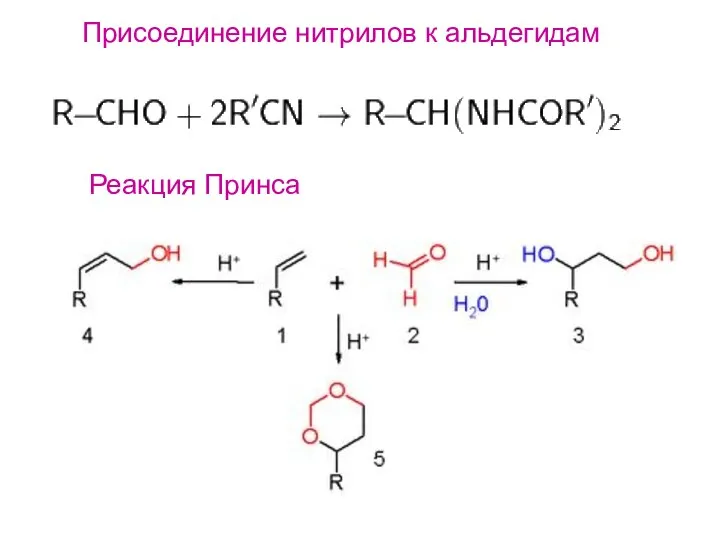
- 17. Присоединение нитрилов к альдегидам Реакция Принса
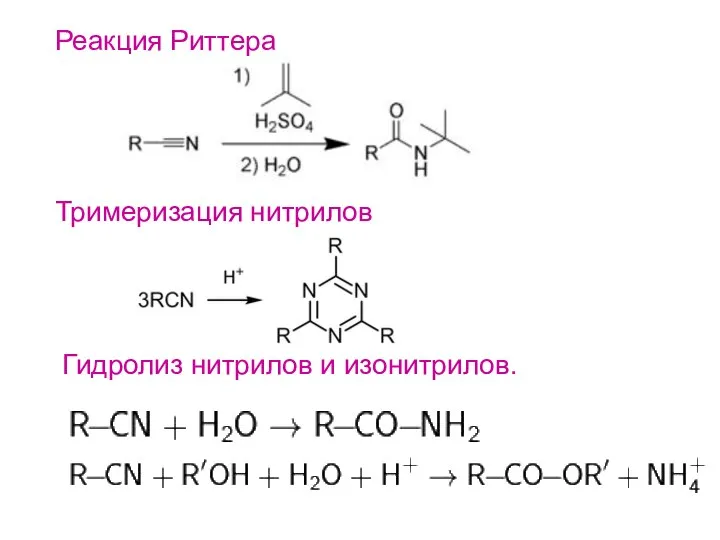
- 18. Реакция Риттера Тримеризация нитрилов Гидролиз нитрилов и изонитрилов.
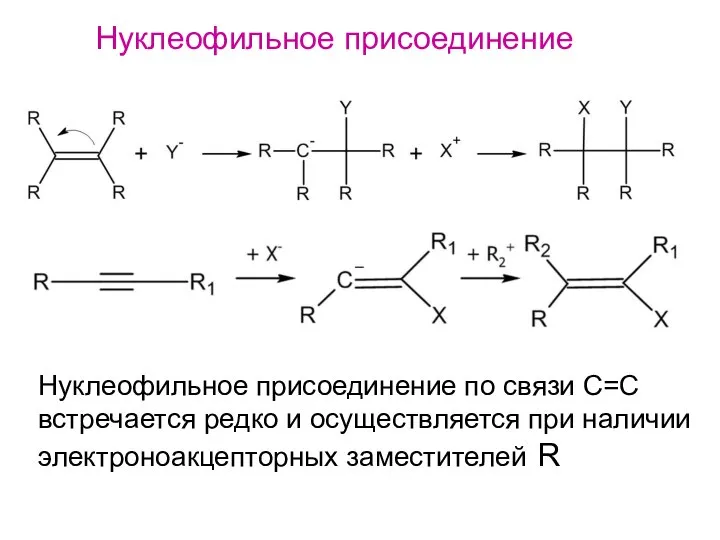
- 19. Нуклеофильное присоединение Нуклеофильное присоединение по связи С=C встречается редко и осуществляется при наличии электроноакцепторных заместителей R
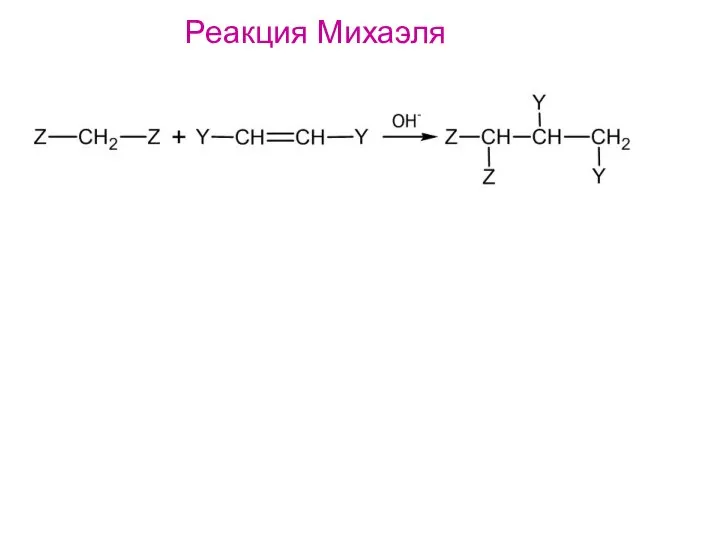
- 20. Реакция Михаэля
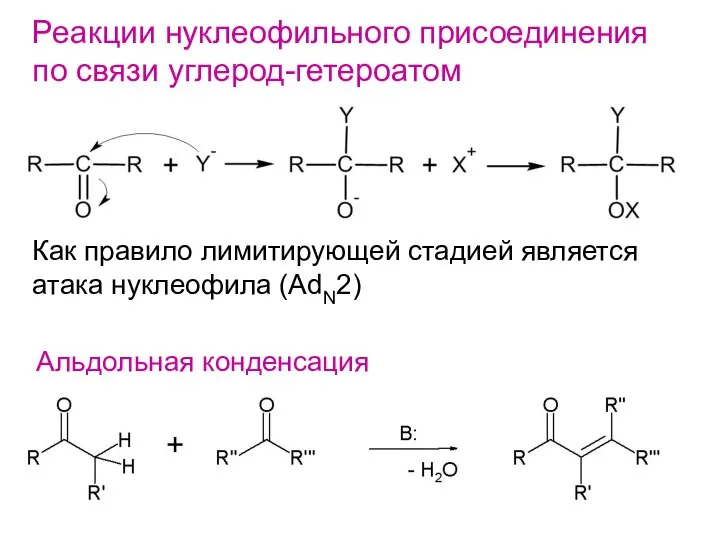
- 21. Реакции нуклеофильного присоединения по связи углерод-гетероатом Как правило лимитирующей стадией является атака нуклеофила (AdN2) Альдольная конденсация
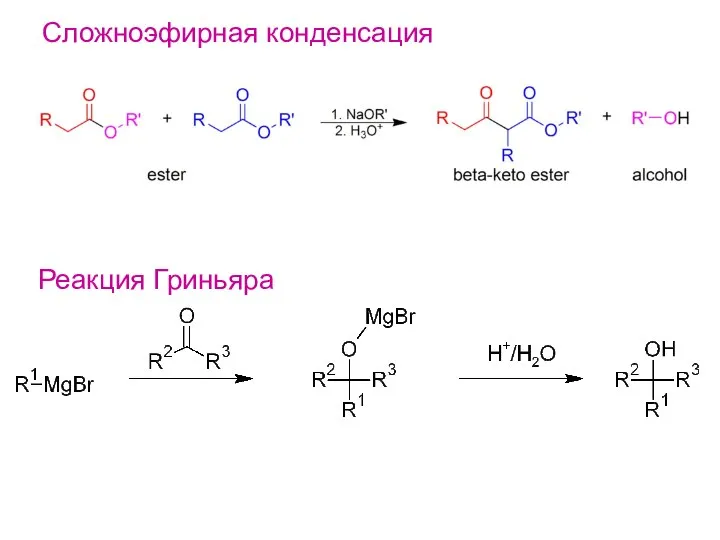
- 22. Сложноэфирная конденсация Реакция Гриньяра
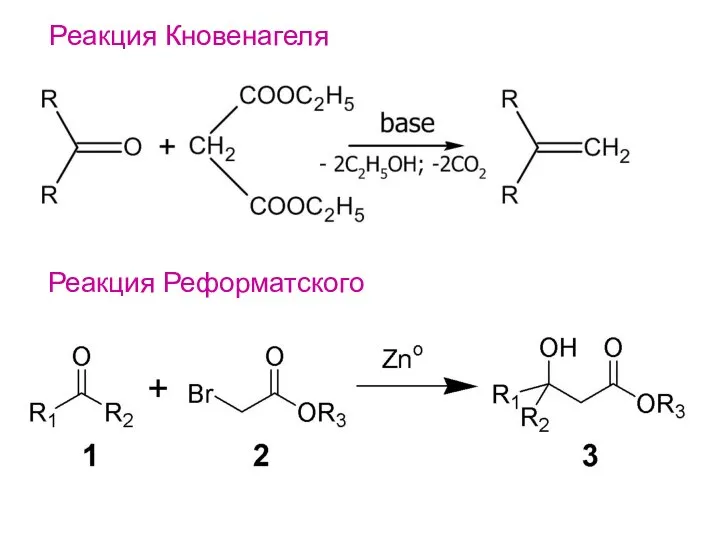
- 23. Реакция Реформатского Реакция Кновенагеля
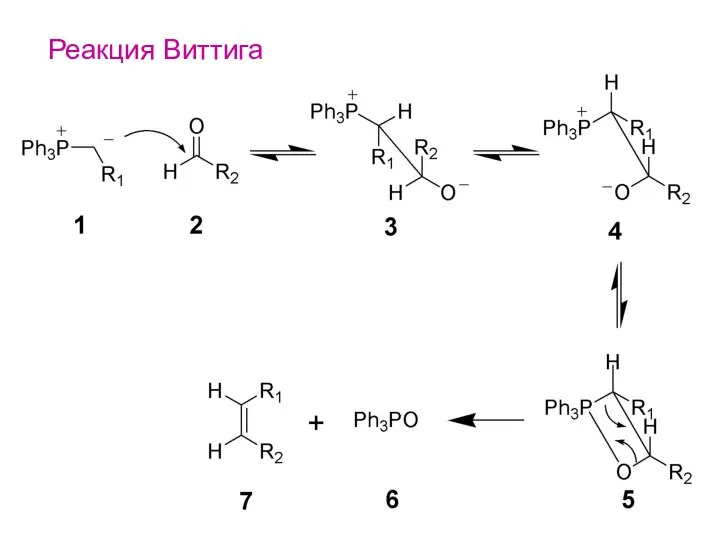
- 24. Реакция Виттига
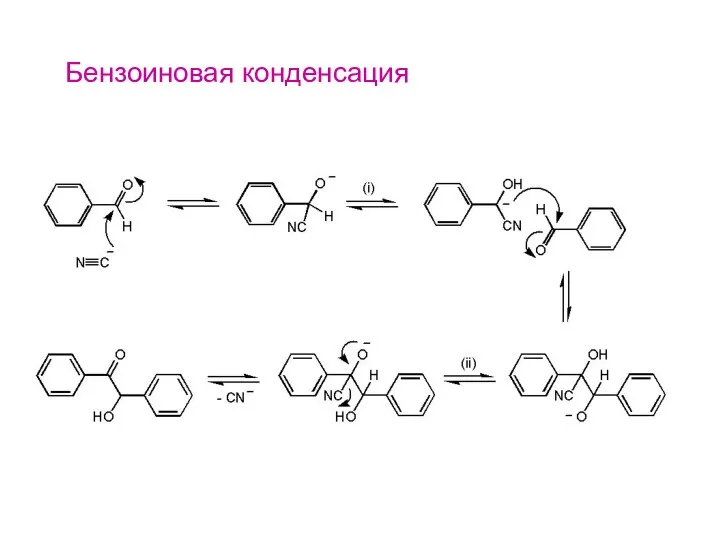
- 25. Бензоиновая конденсация
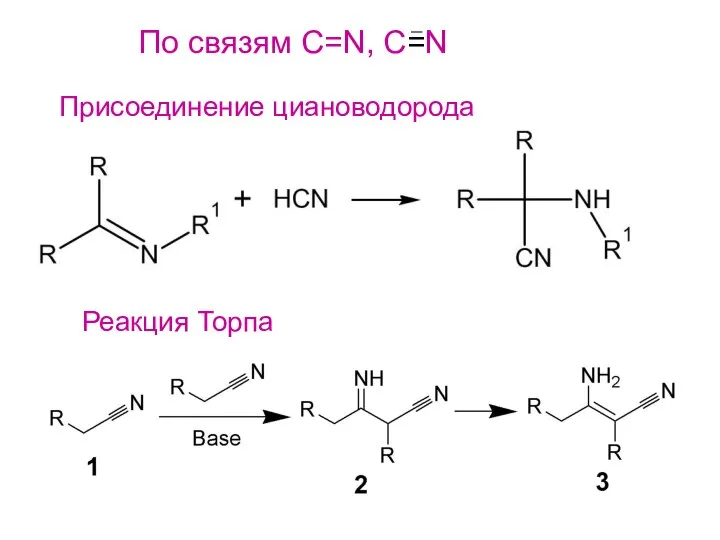
- 26. По связям С=N, C=N Присоединение циановодорода Реакция Торпа
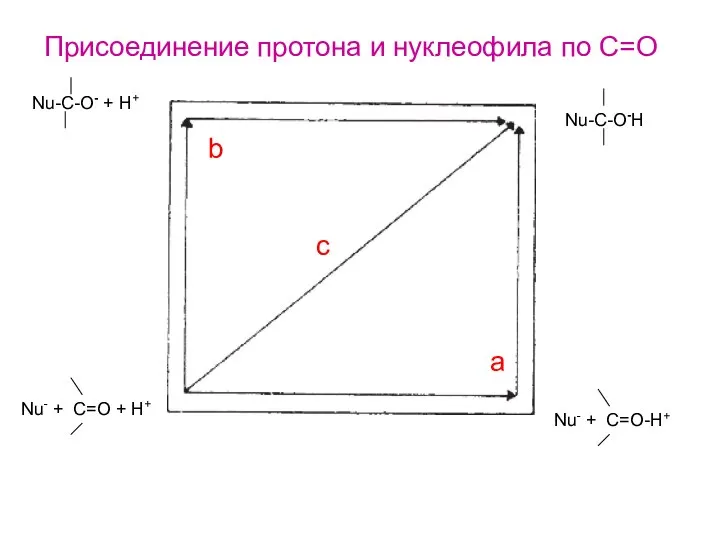
- 27. Nu-C-O- + H+ Nu-C-O-H Nu- + C=O + H+ Nu- + C=O-H+ a c b Присоединение
- 29. Скачать презентацию


![Кинетика Хлорирование (обычно второго порядка): w = k [RRC=CRR] [Cl2 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304046/slide-8.jpg)
![w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR] [Br2]2 + k3[RRC=CRR][Br2][Br -]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304046/slide-9.jpg)

 Облигации
Облигации  Мышечные ткани
Мышечные ткани  Структура бизнес-плана Структура бизнес-плана инвестиционного проекта не регламентирована законодательством, поэтому каждая
Структура бизнес-плана Структура бизнес-плана инвестиционного проекта не регламентирована законодательством, поэтому каждая Правове регулювання фінансового контролю
Правове регулювання фінансового контролю Урок алгебры в 7 классе «Линейная функция и её график» Подготовила Татчин У.В. учитель математики МБОУ СОШ №3 город Сургут
Урок алгебры в 7 классе «Линейная функция и её график» Подготовила Татчин У.В. учитель математики МБОУ СОШ №3 город Сургут  Перитонит, плеврит, артрит
Перитонит, плеврит, артрит  стабилизация, хранение и транспортировка проб. Л.4
стабилизация, хранение и транспортировка проб. Л.4 Проект Редизайн
Проект Редизайн Internet
Internet Экологическая тропа «К истокам...»
Экологическая тропа «К истокам...» Презентация Социально-экономическая характеристика Сибирского ФО
Презентация Социально-экономическая характеристика Сибирского ФО Бестраншейный ремонт трубопроводов с разрушением старого трубопровода
Бестраншейный ремонт трубопроводов с разрушением старого трубопровода Автор: Сычева Яна 10 А МОУ СОШ №1 Свердловская область, Нижнесергинский район, город Михайловск
Автор: Сычева Яна 10 А МОУ СОШ №1 Свердловская область, Нижнесергинский район, город Михайловск  Стратегия развития территории. Роль культуры в развитии территорий
Стратегия развития территории. Роль культуры в развитии территорий Анализаторы человека
Анализаторы человека Теннис. Правила игры
Теннис. Правила игры Пластилиновая живопись
Пластилиновая живопись РАБОТА С ОДАРЕННЫМИ ДЕТЬМИ КАК ПРОФЕССИОНАЛЬНАЯ КОМПЕТЕНТНОСТЬ ПЕДАГОГА МБОУ СОШ «Рабочий п.Октябрьский» Зам. по УВР Кузьми
РАБОТА С ОДАРЕННЫМИ ДЕТЬМИ КАК ПРОФЕССИОНАЛЬНАЯ КОМПЕТЕНТНОСТЬ ПЕДАГОГА МБОУ СОШ «Рабочий п.Октябрьский» Зам. по УВР Кузьми Высокое Возрождение Качественные изменения в живописи
Высокое Возрождение Качественные изменения в живописи Нервная ткань
Нервная ткань  Политика и ее роль в жизни общества
Политика и ее роль в жизни общества Мемлекеттік орган
Мемлекеттік орган Волны де-Бройля
Волны де-Бройля Конструктор процессов для 1С УНФ
Конструктор процессов для 1С УНФ Гиперссылки. Фреймы в HTML документе
Гиперссылки. Фреймы в HTML документе Прикладная механика. Редукторы, вариаторы, коробки скоростей
Прикладная механика. Редукторы, вариаторы, коробки скоростей Тире между подлежащим и сказуемым 5 класс - презентация_
Тире между подлежащим и сказуемым 5 класс - презентация_ Институты развития и их роль в реализации проектов
Институты развития и их роль в реализации проектов