Содержание
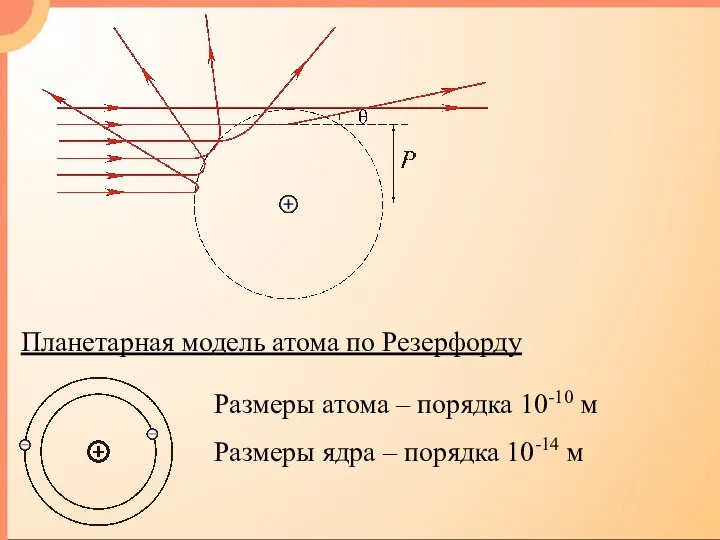
- 2. Планетарная модель атома по Резерфорду Размеры атома – порядка 10-10 м Размеры ядра – порядка 10-14
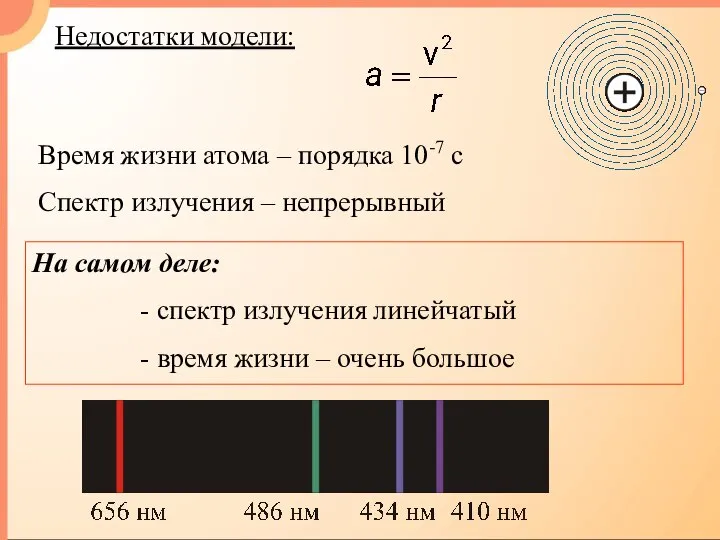
- 3. Недостатки модели: Время жизни атома – порядка 10-7 с Спектр излучения – непрерывный На самом деле:
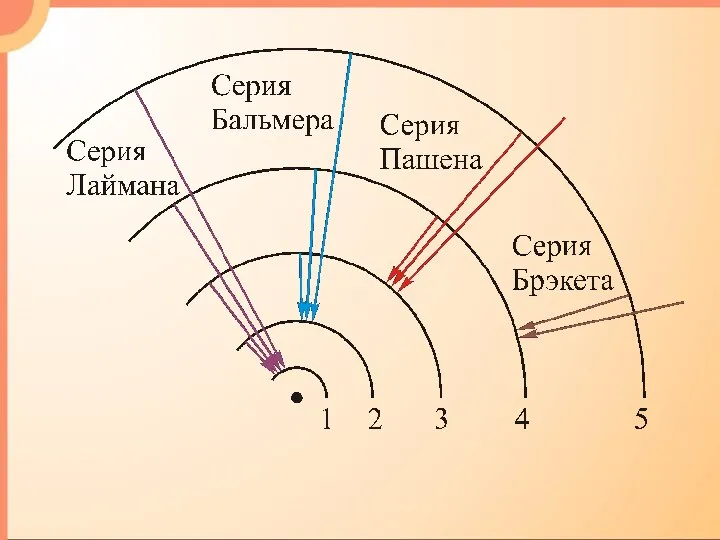
- 4. В 1885г. Бальмер нашел, что длину волны λ, которая соответствует линиям водорода, расположенным в видимой части
- 5. Волновое число: Тогда формула Бальмера принимает вид: R - постоянная Ридберга (R=1,097·107 м-1). Johannes Robert Rydberg,
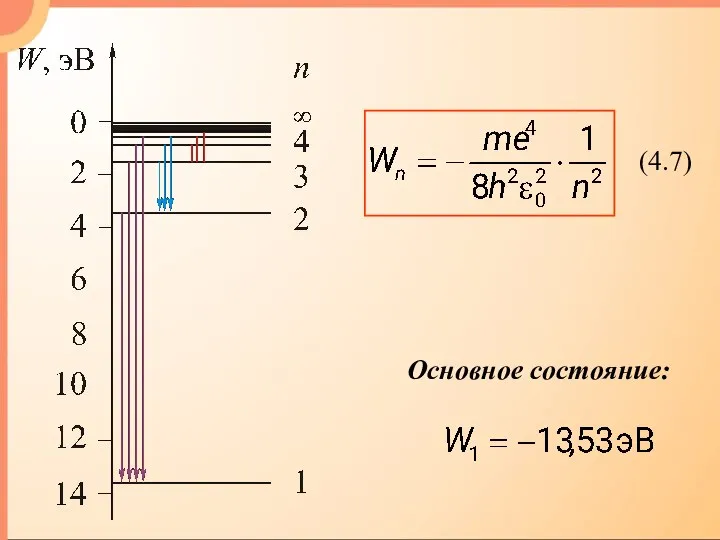
- 7. Нильс Хенрик Давид Бор (1885 - 1962) Постулаты Бора 1. Существуют стационарные состояния атома. Этим стационарным
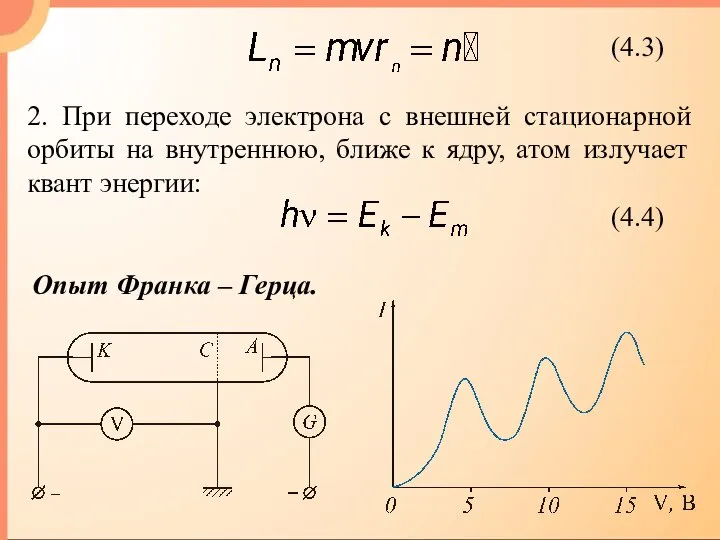
- 8. 2. При переходе электрона с внешней стационарной орбиты на внутреннюю, ближе к ядру, атом излучает квант
- 10. Чтобы электрон удержался на орбите, сила кулонов-ского взаимодействия должна сообщать ему центро-стремительное ускорение. (4.5)
- 11. Полная энергия электрона на орбите: Из первого постулата Бора:
- 14. Задача 4.1 Определить по теории Бора радиус, частоту и скорость обращения электрона для первой орбиты, а
- 16. Задача 4.2 Атом водорода в основном состоянии поглотил квант света с длиной волны 0,1215 мкм. Определить
- 18. 4.3. Квантовые числа.
- 19. n = 1, 2, 3, 4…
- 20. l = 0, 1, 2, 3, … (n-1). Согласно принципу неопределенности Гайзенберга одновременно могут иметь определенные
- 21. m – магнитное число, так как момент импульса и магнитный момент однозначно связаны гиро-магнитным соотношением. Магнитное
- 23. Кратность вырождения: В электрическом и магнитном полях вырождение снимается (эффекты Штарка и Зеемана).
- 24. - определяет вероятность состояния электрона. l – определяет форму волновой функции («орбиты») электрона. l = 0
- 25. Полный момент импульса электрона:
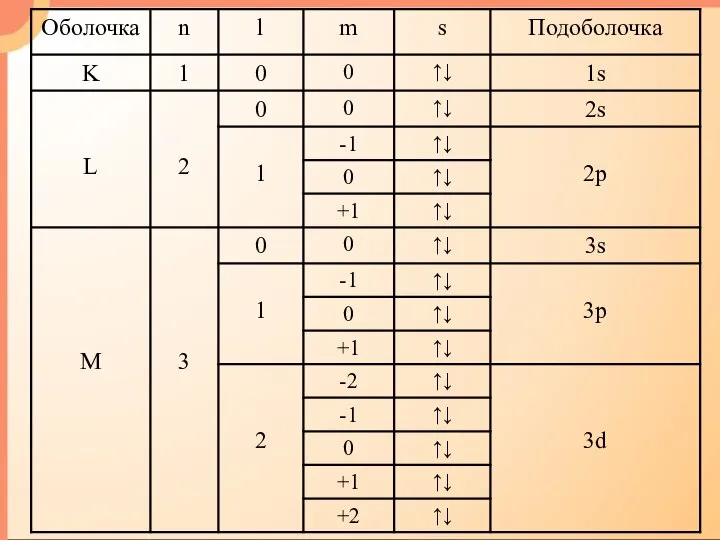
- 26. 4.4. Принцип Паули. Распределение электронов в атоме. Правила отбора: Переход из d – состояния (l =
- 27. Вольфганг Эрнст Паули 1900 - 1958 n=1 l=0 m=0 s=±½ - 2 электрона n=2 l=0, 1
- 28. Подоболочки: 1s; 2s, 2p; 3s, 3p, 3d; 4s, 4p, 4d, 4f; Число состояний в подоболочке 2(2l+1)
- 30. 4.5. Периодическая система Д.И. Менделеева. В 1869 г. Д.И. Менделеев открыл периодический закон изменения химических и
- 31. Квантовые числа атома равны сумме соответству-ющих квантовых чисел всех электронов атома. Для полностью заполненной подоболочки L
- 33. Скачать презентацию
























 Повышение эффективности руководства трудовым коллективом в условиях корпоративного управления
Повышение эффективности руководства трудовым коллективом в условиях корпоративного управления  Джон фон Нейман
Джон фон Нейман Ата-аналарға арналған нұсқаулық
Ата-аналарға арналған нұсқаулық Презентация Этнический (этнолингвистический) состав населения
Презентация Этнический (этнолингвистический) состав населения  Информационные технологии в лингвистике
Информационные технологии в лингвистике Лекция №1. Data types, variables, operators (Java)
Лекция №1. Data types, variables, operators (Java) Переменные: тип, имя, значение
Переменные: тип, имя, значение Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни
Аттестационная работа. Значимость конструкторской и проектноисследовательской деятельности в учебных программах по робототехни Підготовка вагону та перевірка його стану
Підготовка вагону та перевірка його стану Многомерные статические массивы
Многомерные статические массивы Тема №2 ЕКОНОМІЧНІ ТЕОРІЇ ТА БАЗИСНІ ІНСТИТУТИ НАЦІОНАЛЬНОЇ ЕКОНОМІКИ План Основні теоретичні концепції формування націона&s
Тема №2 ЕКОНОМІЧНІ ТЕОРІЇ ТА БАЗИСНІ ІНСТИТУТИ НАЦІОНАЛЬНОЇ ЕКОНОМІКИ План Основні теоретичні концепції формування націона&s Муниципальное бюджетное образовательное учреждение «Средняя школа № 10 п.Раздольное Надеждинского района» Приморского края РЫНОЧНАЯ ЭКОНОМИКА § 14 8 класс. Обществознание по учебнику под ред. Боголюбова Л.Н. Быков
Муниципальное бюджетное образовательное учреждение «Средняя школа № 10 п.Раздольное Надеждинского района» Приморского края РЫНОЧНАЯ ЭКОНОМИКА § 14 8 класс. Обществознание по учебнику под ред. Боголюбова Л.Н. Быков Живот без тютюнев дим-2
Живот без тютюнев дим-2 Ответственность за имущественные преступления
Ответственность за имущественные преступления  ИЗ ЧЕГО ЧТО СДЕЛАНО? Поспелова И. В. МОУ СОШ №7 Г. Шарыпово
ИЗ ЧЕГО ЧТО СДЕЛАНО? Поспелова И. В. МОУ СОШ №7 Г. Шарыпово Travel4friends. Welcome
Travel4friends. Welcome Презентация на тему "Методика использования ИКТ на уроках окружающего мира" - скачать презентации по Педагогике
Презентация на тему "Методика использования ИКТ на уроках окружающего мира" - скачать презентации по Педагогике С++ тілінің операторлары. Шартты оператор. Таңдау операторы
С++ тілінің операторлары. Шартты оператор. Таңдау операторы История Египет
История Египет Микрорайон «Соловьиная роща. Новый квартал»
Микрорайон «Соловьиная роща. Новый квартал» Молитва за Израиль
Молитва за Израиль Этнический туризм
Этнический туризм Презентация "Маркетинг" - скачать презентации по Экономике
Презентация "Маркетинг" - скачать презентации по Экономике АВ т3.35
АВ т3.35 Сбор первичной информации, сводка и группировка статистических данных. Лекция 2
Сбор первичной информации, сводка и группировка статистических данных. Лекция 2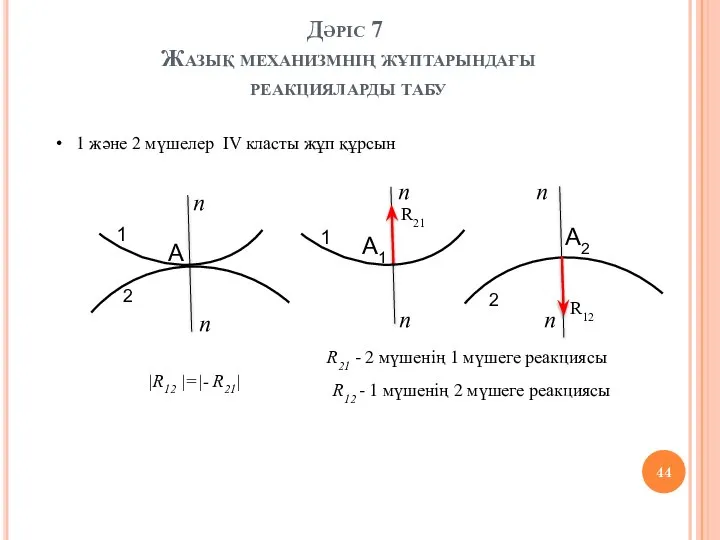 Жазық механизмнің жұптарындағы реакцияларды табу
Жазық механизмнің жұптарындағы реакцияларды табу МОУ«Любомировская СОШ» Таврического муниципального района Омской области Мастер-класс «Формы и методы работы с учащимися, имею
МОУ«Любомировская СОШ» Таврического муниципального района Омской области Мастер-класс «Формы и методы работы с учащимися, имею Экономическая стратификация
Экономическая стратификация