Содержание
- 2. ФОТОБИОЛОГИЧЕСКИЕ ПРОЦЕССЫ И ИХ КЛАССИФИКАЦИЯ С ЭНЕРГЕТИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ ЭНДЭРГОНИЧЕСКИЕ ЭКЗЭРГОНИЧЕСКИЕ Фотобиологическим называют процесс, который начинается
- 3. С БИОЛОГИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ СОБСТВЕННО ФИЗИОЛОГИЧЕСКИЕ А) ЭНЕРГЕТИЧЕСКИЕ Б) ИНФОРМАЦИОННЫЕ В) БИОСИНТЕТИЧЕСКИЕ
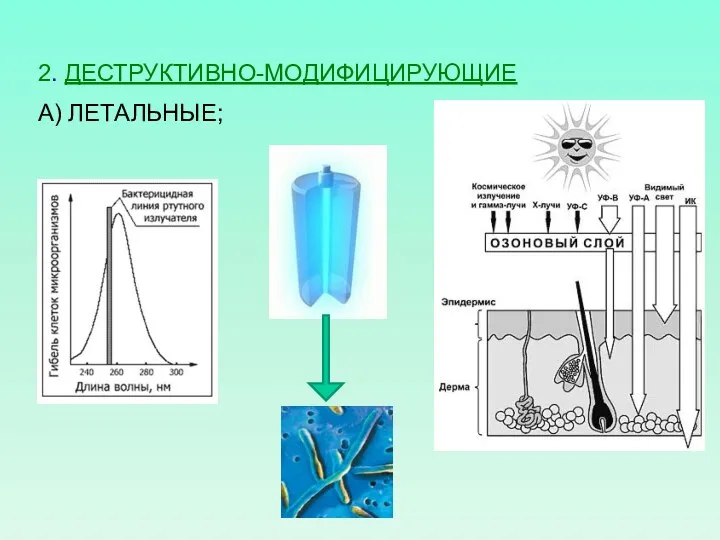
- 4. 2. ДЕСТРУКТИВНО-МОДИФИЦИРУЮЩИЕ А) ЛЕТАЛЬНЫЕ;
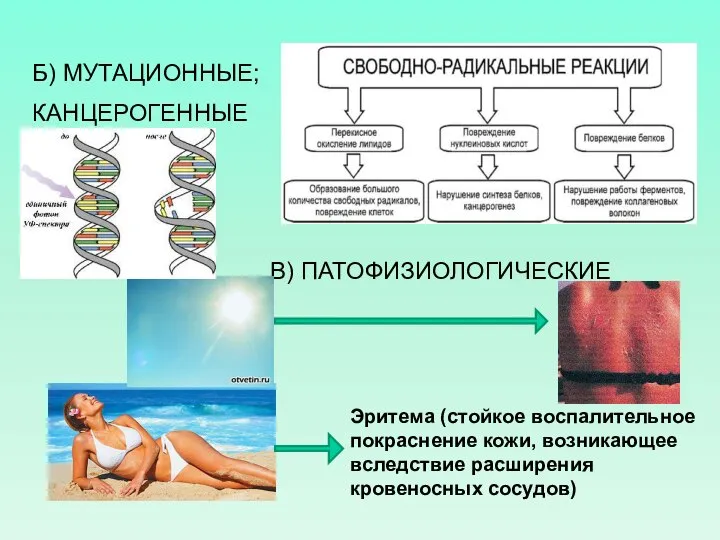
- 5. Б) МУТАЦИОННЫЕ; КАНЦЕРОГЕННЫЕ В) ПАТОФИЗИОЛОГИЧЕСКИЕ Эритема (стойкое воспалительное покраснение кожи, возникающее вследствие расширения кровеносных сосудов)
- 6. Стадии фотобиологического процесса: поглощение кванта света; внутримолекулярные процессы размена энергией (фотофизические процессы); межмолекулярные процессы переноса энергии
- 7. Все виды электромагнитного излучения ( от коротковолновых рентгеновских лучей до радиоволн) представляют собой различные формы одного
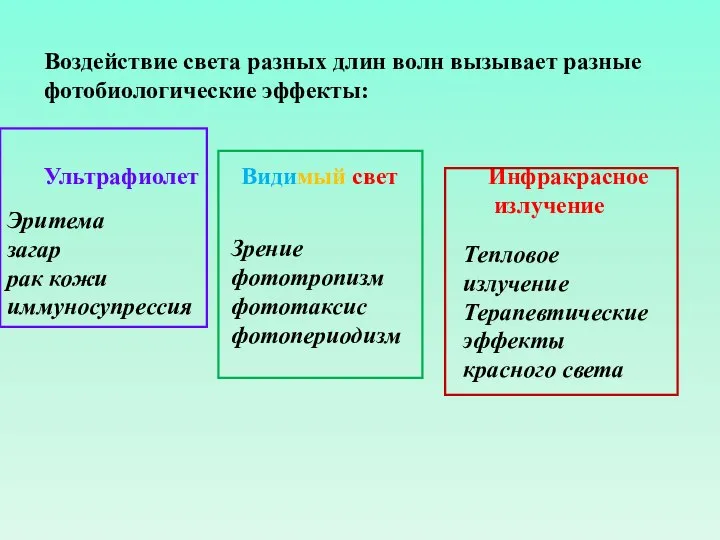
- 8. Воздействие света разных длин волн вызывает разные фотобиологические эффекты: Ультрафиолет Видимый свет Инфракрасное излучение Эритема загар
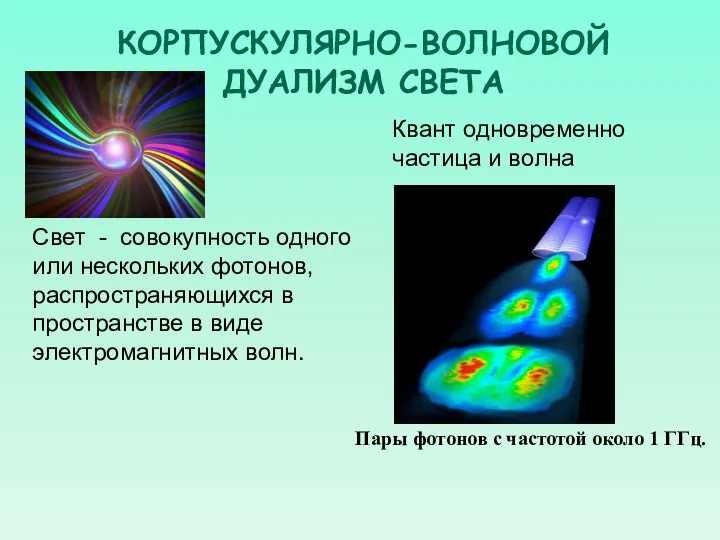
- 9. КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ СВЕТА Квант одновременно частица и волна Свет - совокупность одного или нескольких фотонов, распространяющихся
- 11. МОДЕЛЬ АТОМА Н.БОРА Нильс Бор (1885-1962) Нобелевская премия, 1922
- 12. Первый постулат Бора (постулат стационарных состояний): атомная система может находится только в особых стационарных или квантовых
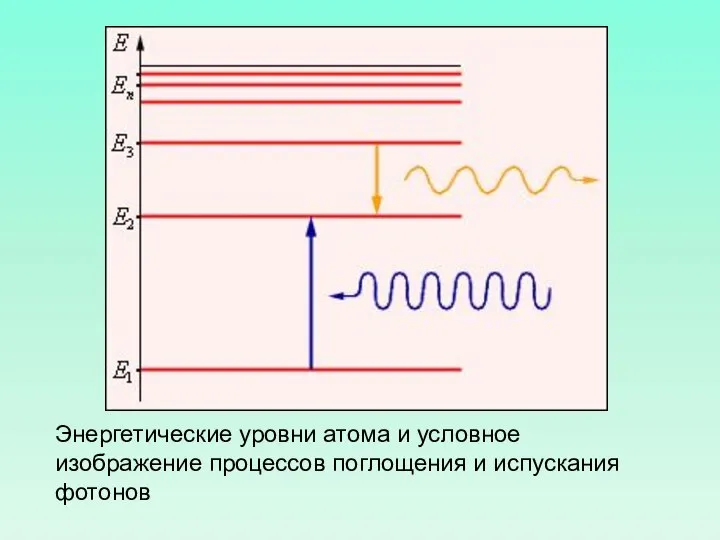
- 13. Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов
- 14. Второй постулат Бора (правило частот) : при переходе атома из одного стационарного состояния с энергией En
- 15. Нобелевская премия по физике, 1929 г. Выдвинул гипотезу об универсальности корпускулярно-волнового дуализма. Он утверждал, что не
- 16. ФОТОН как ЧАСТИЦА ОБЛАДАЕТ ЭНЕРГИЕЙ E = mc2 = hν = hc / λ, Где m
- 17. По аналогии с соотношением между длиной волны света и энергией фотона де Бройль высказал гипотезу о
- 18. ДЛЯ ОПИСАНИЯ СОСТОЯНИЯ ЭЛЕКТРОНА В АТОМЕ ВОДОРОДА В 1926 году ПРЕДЛОЖЕНО УРАВНЕНИЕ ШРЕДИНГЕРА Уравнение Э.Шредингера содержит
- 19. ψ - волновая функция характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z -
- 20. В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа, которые служат для
- 21. Принцип минимума энергии Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Принцип Паули ограничивает число
- 22. КВАНТОВОМЕХАНИЧЕСКАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА Система микрочастиц, не подчиняющаяся законам классической механики Стационарные орбиты электрона – это
- 23. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМОВ И МОЛЕКУЛ
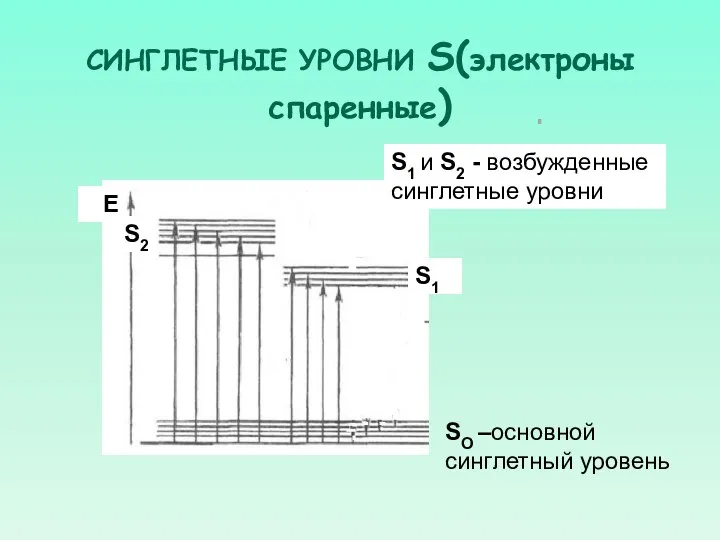
- 24. СИНГЛЕТНЫЕ УРОВНИ S(электроны спаренные) SO –основной синглетный уровень S2 S1 S1 и S2 - возбужденные синглетные
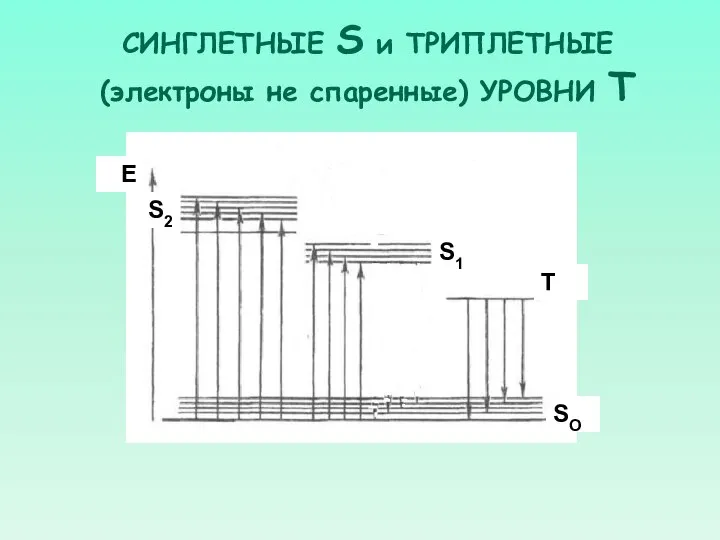
- 25. СИНГЛЕТНЫЕ S и ТРИПЛЕТНЫЕ (электроны не спаренные) УРОВНИ Т S2 S1 SO Т Е
- 26. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ МОЛЕКУЛ
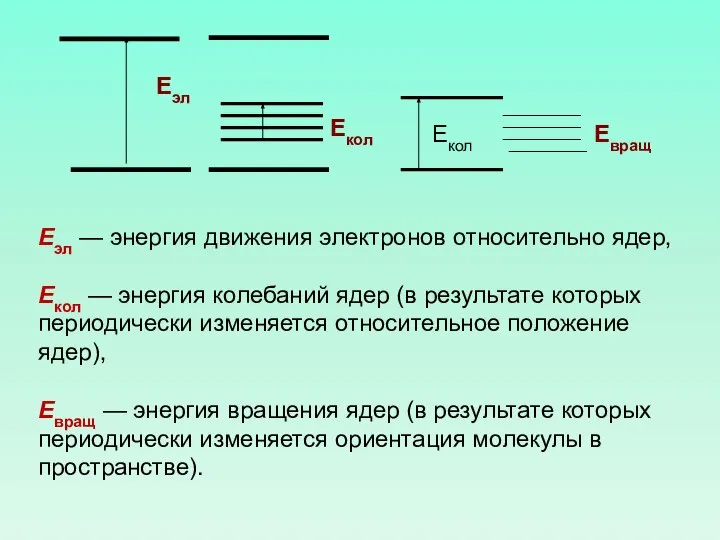
- 27. Еэл — энергия движения электронов относительно ядер, Екол — энергия колебаний ядер (в результате которых периодически
- 28. ЗАКОН БУГЕРА – ЛАМБЕРТА – БЕРА Иоганн Генрих Ламберт 1728-1777 Пьер Бугер (Буге) (1698-1758)
- 29. I0 – ИНТЕНСИВНОСТЬ ПАДАЮЩЕГО СВЕТА I1 – ИНТЕНСИВНОСТЬ ВЫШЕДШЕГО СВЕТА l – ТОЛЩИНА КЮВЕТЫ (ДЛИНА ОПТИЧЕСКОГО
- 30. При начальных условиях l =0 и С=lnI 0
- 31. В экспоненциальной форме Отсюда ЗАКОН БУГЕРА – ЛАМБЕРТА – БЕРА ИНТЕНСИВНОСТЬ СВЕТА, ПРОШЕДШЕГО ЧЕРЕЗ ОБРАЗЕЦ, ЭКСПОНЕНЦИАЛЬНО
- 32. Перепишем уравнение еще раз в логарифмической форме и избавимся от минуса Заменим натуральные логарифмы десятичными и
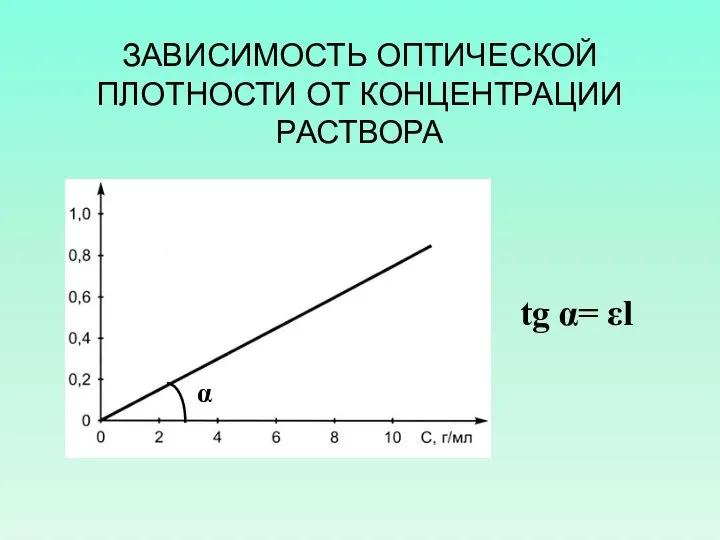
- 33. ЗАВИСИМОСТЬ ОПТИЧЕСКОЙ ПЛОТНОСТИ ОТ КОНЦЕНТРАЦИИ РАСТВОРА tg α= εl
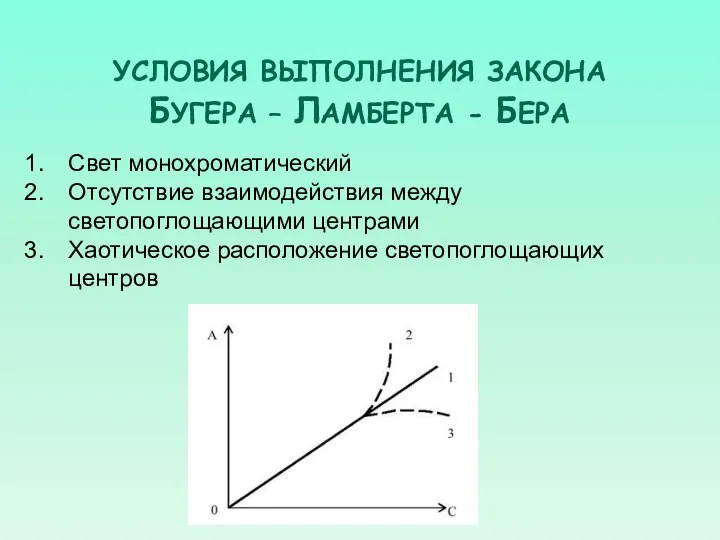
- 34. УСЛОВИЯ ВЫПОЛНЕНИЯ ЗАКОНА БУГЕРА – ЛАМБЕРТА - БЕРА Свет монохроматический Отсутствие взаимодействия между светопоглощающими центрами Хаотическое
- 35. Иногда используют другую характеристику - КОЭФФИЦИЕНТ ПРОПУСКАНИЯ Т ОПТИЧЕСКАЯ ПЛОТНОСТЬ И КОЭФФИЦИЕНТ ПРОПУСКАНИЯ СВЯЗАНЫ ОТНОШЕНИЕМ: ИЛИ
- 36. АБСОРБЦИОННАЯ И ДИФФЕРЕНЦИАЛЬНАЯ СПЕКТРОСКОПИЯ БЕЛКОВ
- 37. ШКАЛА ЭЛЕКТРОМАГНИТНЫХ КОЛЕБАНИЙ
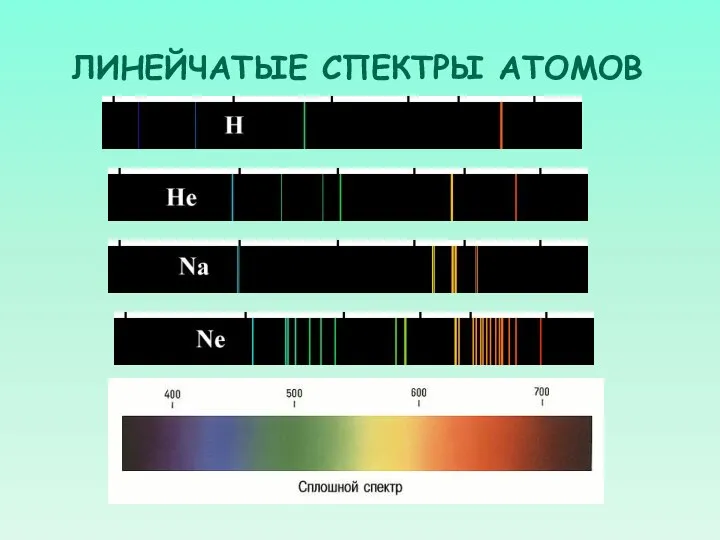
- 38. ЛИНЕЙЧАТЫЕ СПЕКТРЫ АТОМОВ
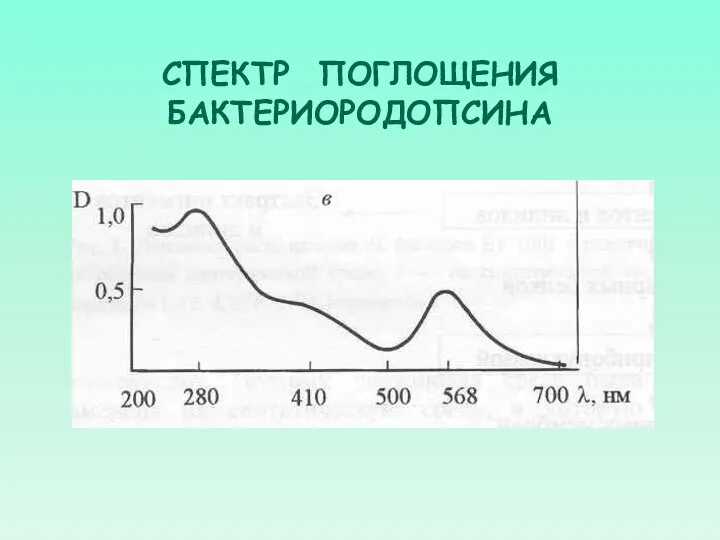
- 39. СПЕКТР ПОГЛОЩЕНИЯ БАКТЕРИОРОДОПСИНА
- 40. СПЕКТРЫ ПОГЛОЩЕНИЯ БЕЛКОВ
- 41. В ОСНОВЕ АБСОРБЦИОННОЙ СПЕКТРОСКОПИИ ЛЕЖИТ ЗАКОН БУГЕРА – ЛАМБЕРТА - БЕРА СПЕКТРОФОТОМЕТР - прибор, который измеряет
- 43. Особенности спектроскопии биополимеров Использование растворов Узость температурного интервала, в котором биополимеры не денатурируют
- 44. ПОГЛОЩЕНИЕ БЕЛКОВ Хромофор - функциональная группа, с которой связано возбуждение молекулы посредством поглощения света в видимой
- 46. Для изучения свойств пептидных хромофоров используют модельные соединения (они аналогичны рассматриваемым соединениям в отношении всей структуры
- 47. ПОГЛОЩЕНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ Для боковых групп многих аминокислот (Asp, Glu, Asn, Gln, Arg и His) зарегистрировать
- 48. Интерес представляют только те хромофоры белковых молекул, которые поглощают при длинах волн больше 230 нм, где
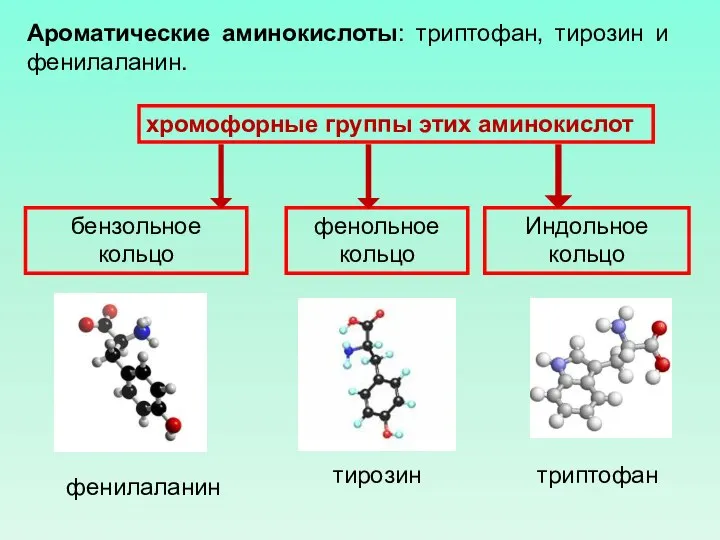
- 49. Ароматические аминокислоты: триптофан, тирозин и фенилаланин. Индольное кольцо бензольное кольцо фенольное кольцо триптофан тирозин фенилаланин хромофорные
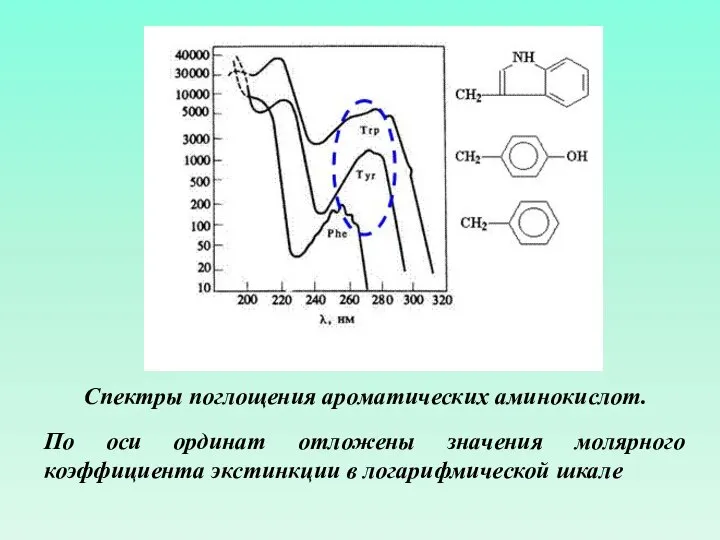
- 50. Спектры поглощения ароматических аминокислот. По оси ординат отложены значения молярного коэффициента экстинкции в логарифмической шкале
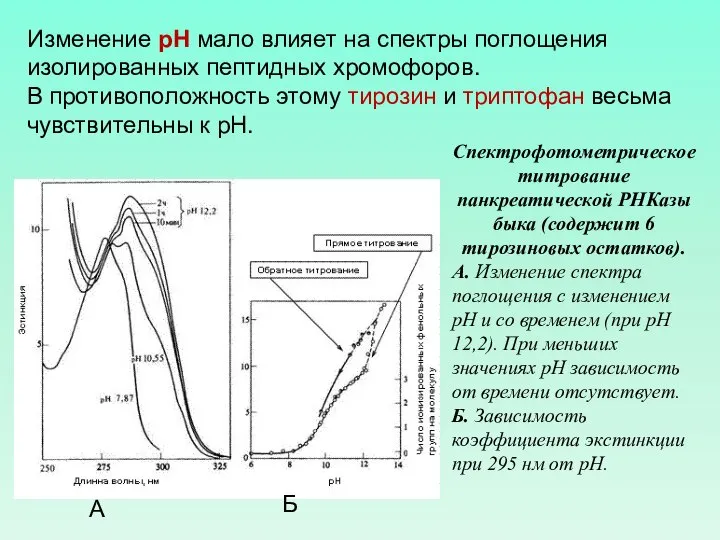
- 51. Изменение рН мало влияет на спектры поглощения изолированных пептидных хромофоров. В противоположность этому тирозин и триптофан
- 52. Многие белки содержат группы, отличающиеся от обычных аминокислот. ПРИМЕРЫ РОДОПСИН ГЕМПРОТЕИНЫ ФЛАВОПРОТЕИНЫ
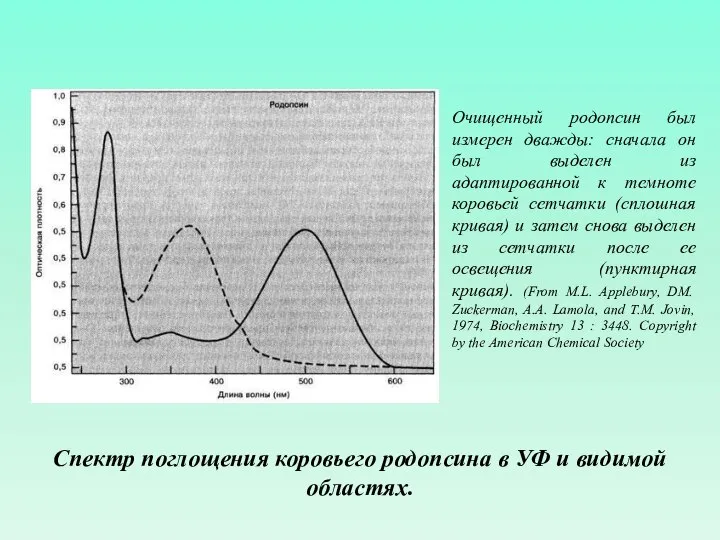
- 53. Спектр поглощения коровьего родопсина в УФ и видимой областях. Очищенный родопсин был измерен дважды: сначала он
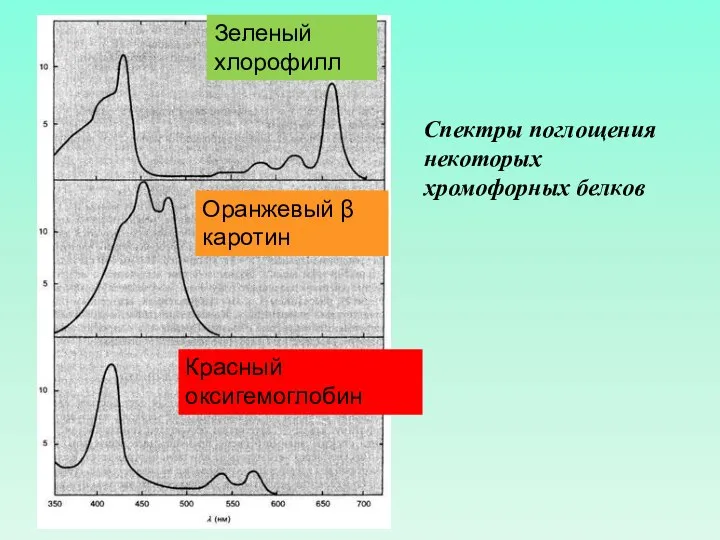
- 54. Спектры поглощения некоторых хромофорных белков Зеленый хлорофилл Оранжевый β каротин Красный оксигемоглобин
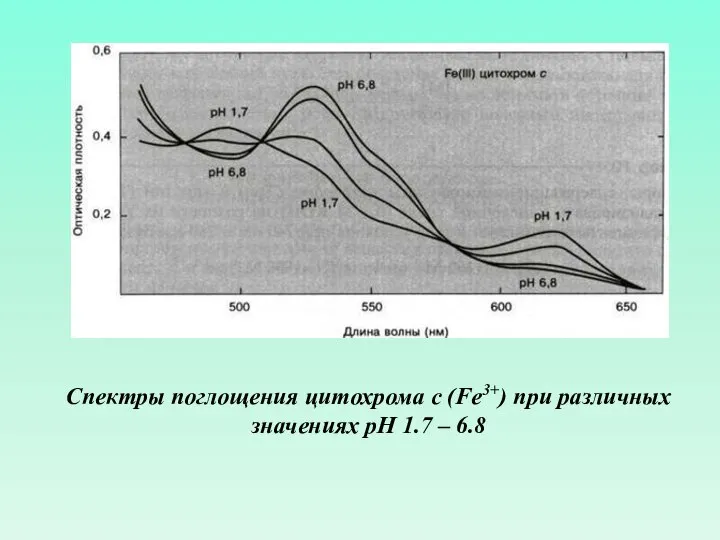
- 55. Спектры поглощения цитохрома с (Fe3+) при различных значениях рН 1.7 – 6.8
- 56. Дифференциальный спектр – разностный спектр, который получается при автоматическом вычитании из спектра поглощения вещества в измеряемой
- 57. Если разложить это в степенной ряд по малому параметру и пренебречь членами второго порядка малости, тогда
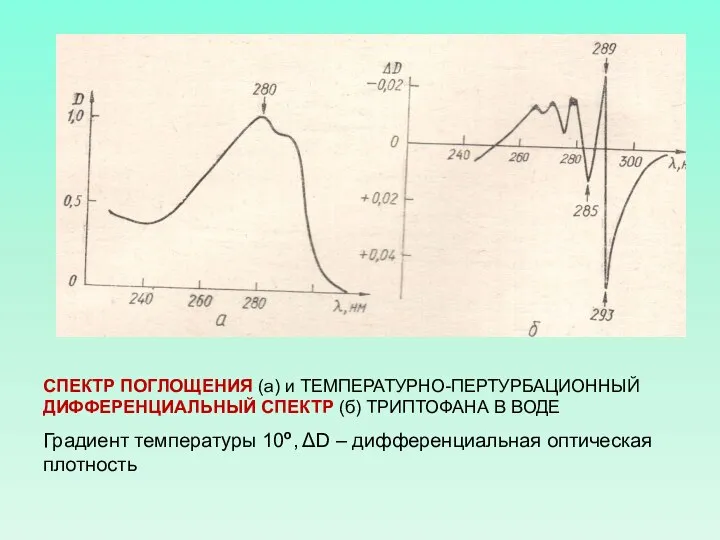
- 58. СПЕКТР ПОГЛОЩЕНИЯ ТРИПТОФАНА В ВОДЕ МАКСИМУМ ПРИ 280 нм И МАЛЕНЬКИЙ ПИК ПРИ 288 нм
- 59. СПЕКТР ПОГЛОЩЕНИЯ (а) и ТЕМПЕРАТУРНО-ПЕРТУРБАЦИОННЫЙ ДИФФЕРЕНЦИАЛЬНЫЙ СПЕКТР (б) ТРИПТОФАНА В ВОДЕ Градиент температуры 10о, ΔD –
- 60. Для получения ТЕМПЕРАТУРНО-ПЕРТУРБАЦИОННЫХ ДИФФЕРЕНЦИАЛЬНЫХ СПЕКТРОВ раствор белка одинаковой концентрации помещают в кюветы, в которых создают разность
- 62. Скачать презентацию








































 Процессуальное право: гражданский и арбитражный процесс
Процессуальное право: гражданский и арбитражный процесс Презентация____
Презентация____ Культура домонгольской Руси
Культура домонгольской Руси Обмен веществ в организме Составила: Иванова А. Е., Учитель начальных классов Школы №22
Обмен веществ в организме Составила: Иванова А. Е., Учитель начальных классов Школы №22 Связи. Реакции связей (практика)
Связи. Реакции связей (практика) Формирование миссионерского кружка на приходе
Формирование миссионерского кружка на приходе Третьяковская галерея в Лаврушинском переулке
Третьяковская галерея в Лаврушинском переулке Внешнеэкономические операции и основные принципы их классификации
Внешнеэкономические операции и основные принципы их классификации Карельская вышивка
Карельская вышивка Источники права в правовых системах англо-американского типа
Источники права в правовых системах англо-американского типа Презентация на тему "Шовные материалы" - скачать презентации по Медицине
Презентация на тему "Шовные материалы" - скачать презентации по Медицине Презентация "А.С.Пушкин на портретах художников О.Кипренского и В.Тропинина" - скачать презентации по МХК
Презентация "А.С.Пушкин на портретах художников О.Кипренского и В.Тропинина" - скачать презентации по МХК Базы данных и СУБД
Базы данных и СУБД Document Object Model Объектная модель документа
Document Object Model Объектная модель документа Беспроводные сети
Беспроводные сети Система здравоохранения ВЕЛИКОБРИТАНИИ Школа качества и управления Занятие 12 Отдел маркетинга и инноваций
Система здравоохранения ВЕЛИКОБРИТАНИИ Школа качества и управления Занятие 12 Отдел маркетинга и инноваций Разработка интеллектуальной системы мониторинга состояния нефтяных и газовых скважин
Разработка интеллектуальной системы мониторинга состояния нефтяных и газовых скважин Патрология. Лекция II. Священномученик Ириней Лионский. Период III века
Патрология. Лекция II. Священномученик Ириней Лионский. Период III века Учет больничных листов и пособий по врем нетрудоспособности за счет федерального бюджета Петрова Маргарита
Учет больничных листов и пособий по врем нетрудоспособности за счет федерального бюджета Петрова Маргарита Мольер Жан Батист Поклен. (1622-1673)
Мольер Жан Батист Поклен. (1622-1673) Правовое регулирование трудоустройства и занятости
Правовое регулирование трудоустройства и занятости Разработка мероприятий, повышающих энерго-эффективность насосной станций ГКП «Астана Су Арнасы»
Разработка мероприятий, повышающих энерго-эффективность насосной станций ГКП «Астана Су Арнасы» Boston Dynamics
Boston Dynamics Законный и договорный режимы имущества супругов
Законный и договорный режимы имущества супругов Умный дом
Умный дом Сколько стоит вода или как убедить маму купить роликовые коньки - презентация для начальной школы_
Сколько стоит вода или как убедить маму купить роликовые коньки - презентация для начальной школы_ ГЕМОТРАНСФУЗИЯ Курамысов Еркин Акбарович
ГЕМОТРАНСФУЗИЯ Курамысов Еркин Акбарович Проектирование свайных фундаментов. (Лекция 22)
Проектирование свайных фундаментов. (Лекция 22)