Содержание
- 2. Факторы формирования химического состава –природная обстановка, которая способствует формированию хим. состава воды. Они поддерживают или угнетают
- 3. Физико-географические факторы Главным элементом физико-географических условий, влияющим на формирование химического состава природных вод, является климат. Солончаки
- 4. Климат Атмосферные осадки, выпадающие на поверхность Земли, регулируют запасы поверхностных и грунтовых вод. При значительном превышении
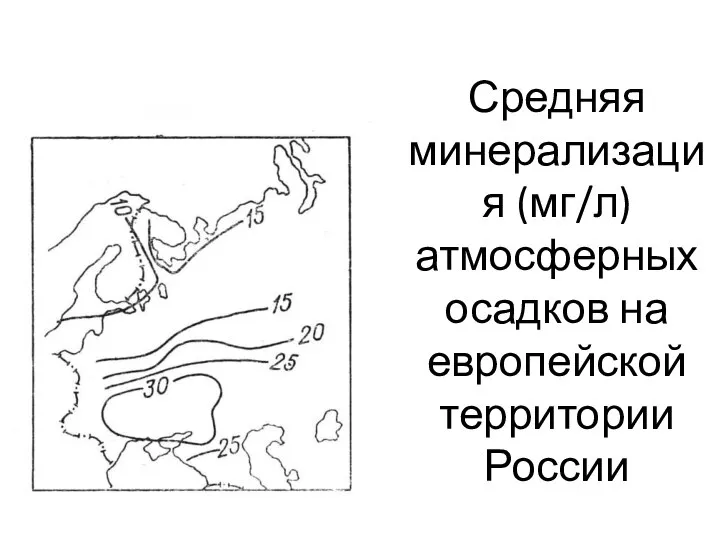
- 5. Средняя минерализация (мг/л) атмосферных осадков на европейской территории России
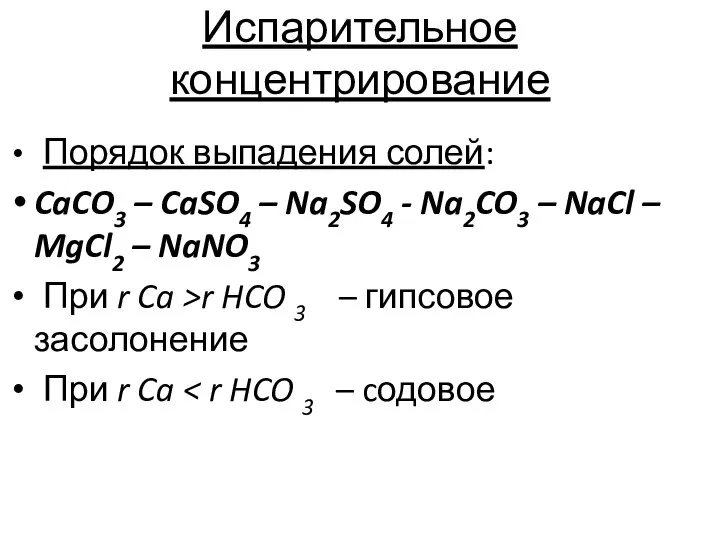
- 6. Испарительное концентрирование Порядок выпадения солей: CaCO3 – CaSO4 – Na2SO4 - Na2CO3 – NaCl – MgCl2
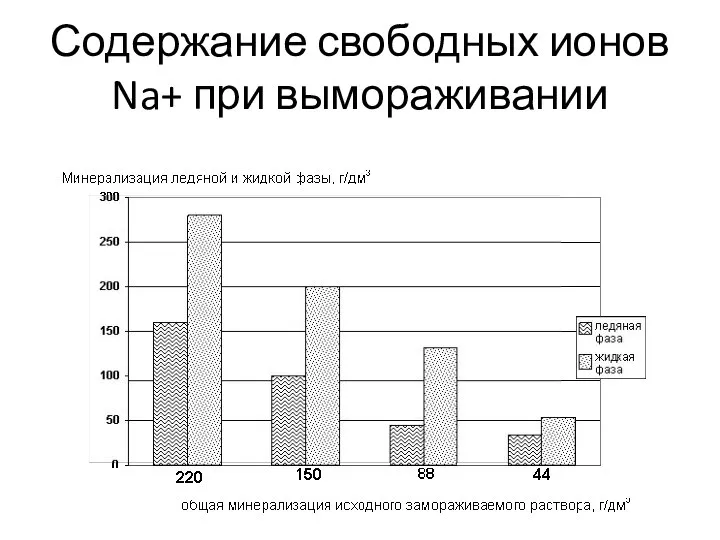
- 7. Вымораживание природных вод Анализ результатов термодинамического моделирования процессов вымораживания До минерализации 100 г/дм3 количество свободных ионов
- 8. Содержание свободных ионов Na+ при вымораживании
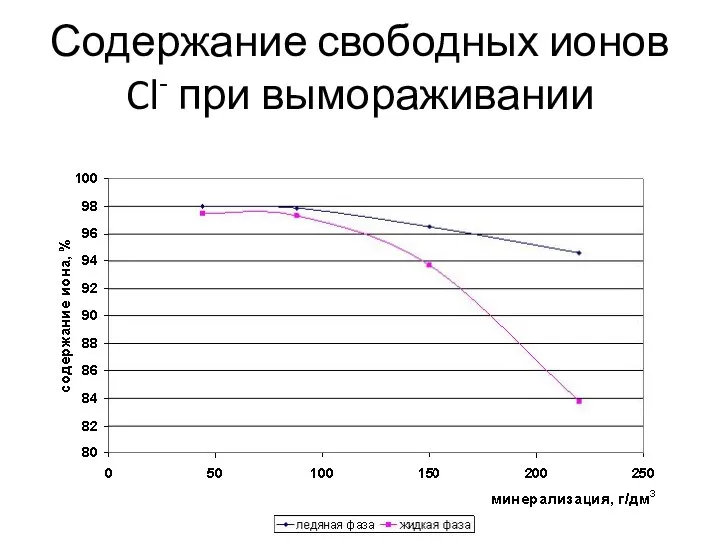
- 9. Количество свободных ионов кальция и хлора до минерализации 100 г/дм3 практически не меняется и равно 97%.
- 10. Содержание свободных ионов Cl- при вымораживании
- 11. ЭВТЕКТИКА (от греч. eutektos - легко плавящийся), жидкая фаза (расплав), находящаяся в равновесии с двумя или
- 12. Эвтектика сульфата магния – минус 4.8оС, эвтектическая концентрация – 230 г/л. Наличие в многолетнемерзлых породах сульфатных
- 13. изменение анионного состава подземных вод при промерзании Последовательность изменения анионного состава подземных вод при промерзании в
- 14. По мере понижения температуры подземных вод, раствор вымораживания обогащается солями с низкими эвтектиками и, в первую
- 15. Важным климатическим параметром являются ветры На морских побережьях в зависимости от направления и интенсивности ветра меняется
- 16. В засушливых областях ветер может изменять соотношение главных ионов в природных водах. При полном усыхании соляных
- 17. Рельеф Связь динамики и минерализации. расчлененность ? интенсивность водообмена; чем рельеф пересеченней, тем интенсивней водообмен и
- 18. поясность и ярусность Так формируется высотная поясность; Пояса на разных высотах в горных районах отличаются по
- 19. роль микрорельефа в аридных областях В областях с аридным климатом на формирование химического состава природных вод
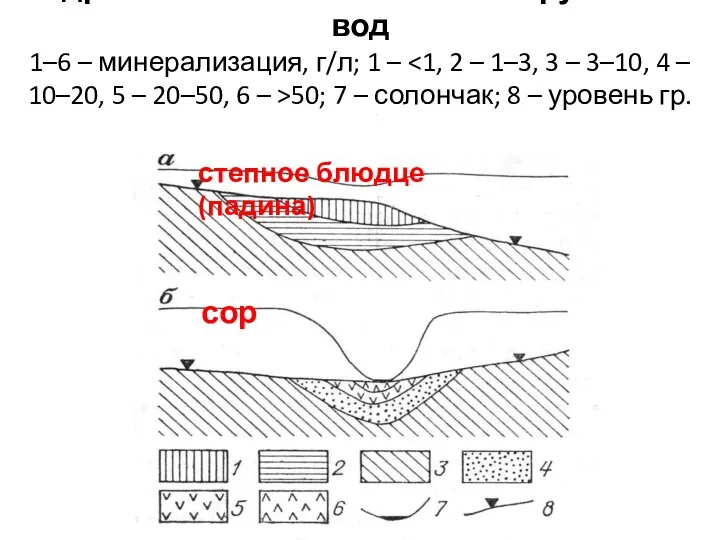
- 20. Падины (степные блюдца) Представляют собой понижения размером до сотен квадратных метров и глубиной вреза до 1
- 21. Гидрохимическая зональность грунтовых вод 1–6 – минерализация, г/л; 1 – 50; 7 – солончак; 8 –
- 22. Гидрография Чем гуще речная сеть, тем интенсивней водообмен в верхних водоносных горизонтах; поэтому солей в грунтовых
- 23. Так, в р. Шелонь, впадающей в оз. Ильмень, в результате разгрузки артезианских вод минерализация воды в
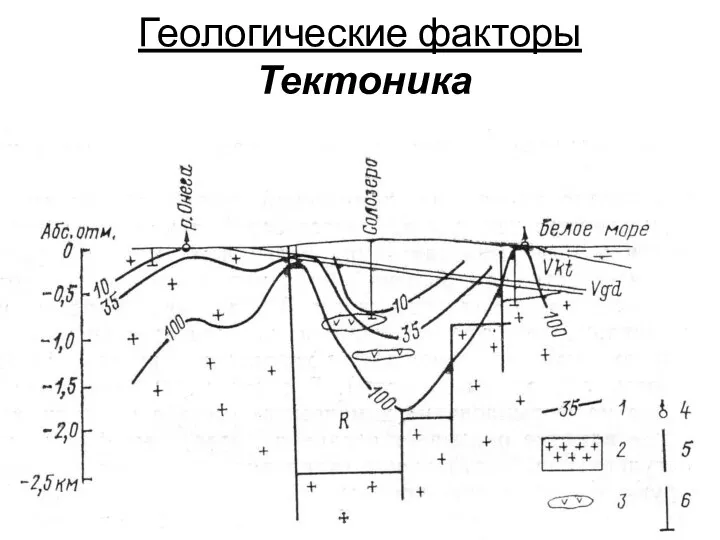
- 24. Геологические факторы Тектоника
- 25. Физико-химические факторы Растворимость Легкорастворимые (>2 г/л)
- 26. Слаборастворимые (2—0,1 г/л)
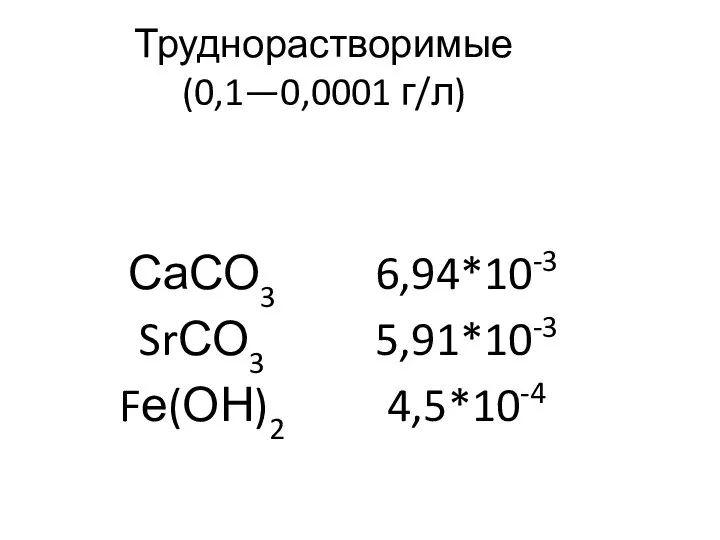
- 27. Труднорастворимые (0,1—0,0001 г/л)
- 28. Практически нерастворимые ( Сульфиды Силикаты Самородные металлы
- 29. Растворимость мирабилита Na2SO4 .10H2O в интервале температур от 0 до 30о возрастает от 45 до 300
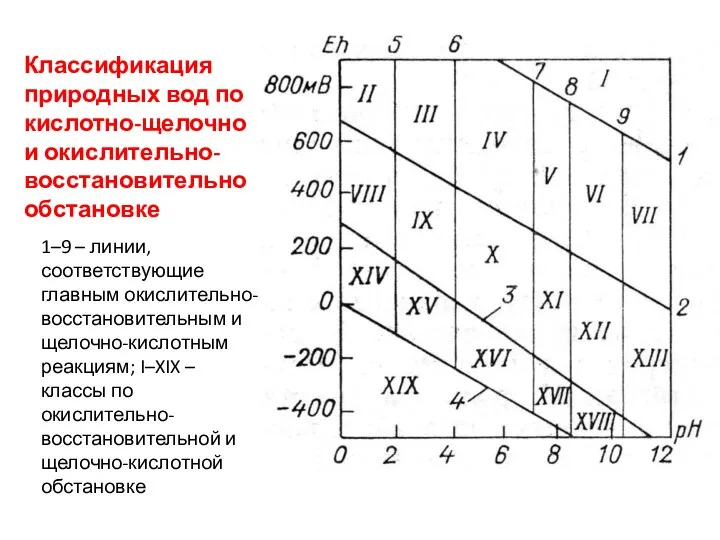
- 30. Классификация природных вод по кислотно-щелочной и окислительно-восстановительной обстановке 1–9 – линии, соответствующие главным окислительно-восстановительным и щелочно-кислотным
- 31. Наклонные линии на этой диаграмме соответствуют следующим окислит.-восстановительным реакциям: 1) граница устойчивости воды, выше и правее
- 32. Вертикальные линии диаграммы определяются константами диссоциации главных природных кислот: 5) равенство концентраций серной кислоты и первой
- 33. В соответствии с этими границами обстановку в полях II–VII можно назвать окислительной; VIII–XIII – нейтральной; XIV–XVIII
- 34. Температура. а) Влияние на растворимость минералов б) Влияние на свойства глинистых водоупоров в) Влияние на процессы
- 35. С повышением температуры изменяется растворяющая способность воды. При этом растворимость одних компонентов может возрастать, других падать.
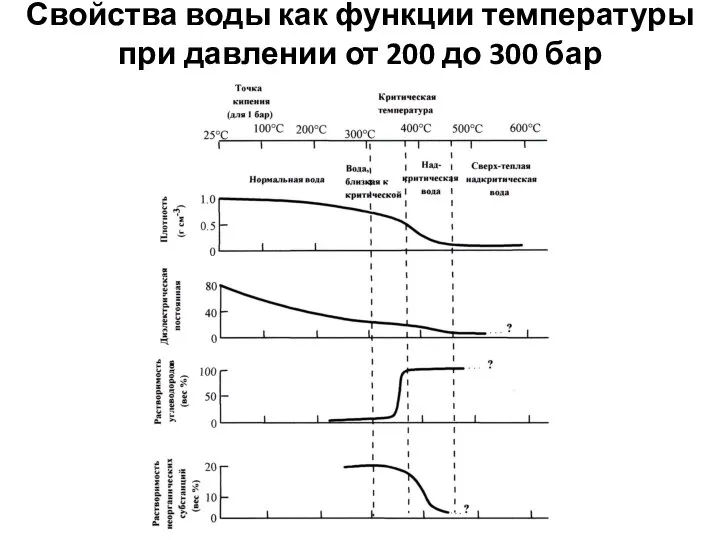
- 36. Свойства воды как функции температуры при давлении от 200 до 300 бар
- 37. С ростом температуры увеличивается диссоциация воды, так как этот процесс эндотермичен. В результате повышения температуры и
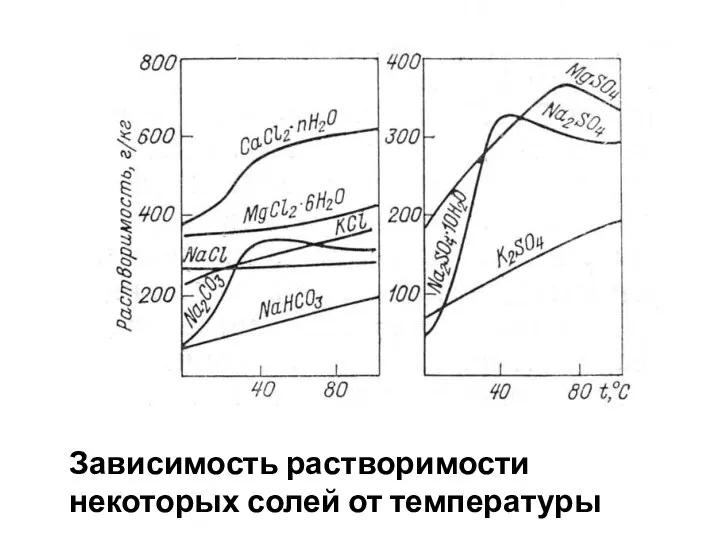
- 38. Зависимость растворимости некоторых солей от температуры
- 39. Растворимость солей Na, в общем, растёт с увеличением температуры, Ca – падает (кроме CaCl2). Растворимость MgCO3
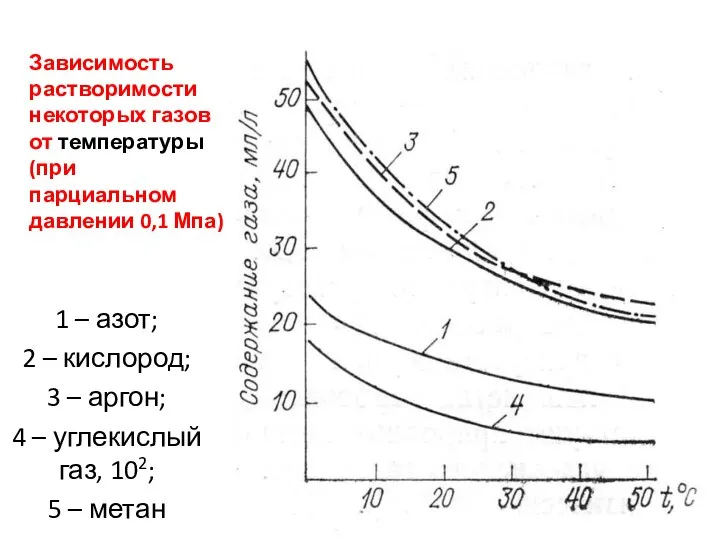
- 40. Зависимость растворимости некоторых газов от температуры (при парциальном давлении 0,1 Мпа) 1 – азот; 2 –
- 41. Температурная зональность Западно-Сибирского артезианского бассейна 1 – водоносные горизонты и комплексы; 2 – региональные водоупоры; 3
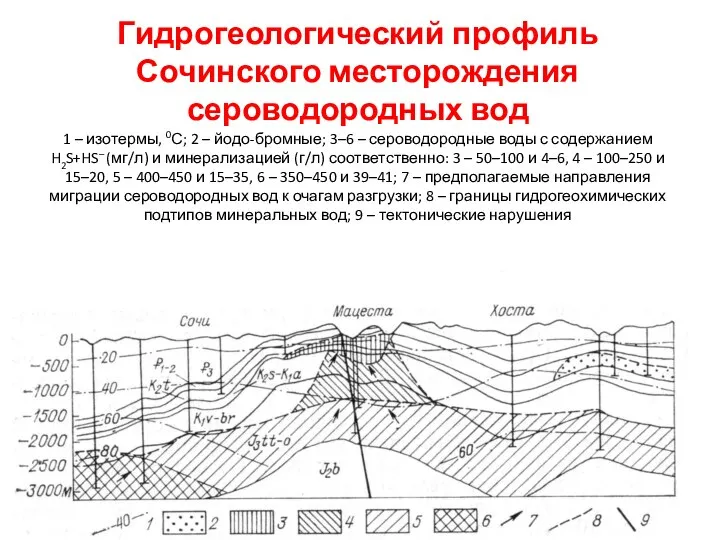
- 42. Гидрогеологический профиль Сочинского месторождения сероводородных вод 1 – изотермы, 0С; 2 – йодо-бромные; 3–6 – сероводородные
- 43. Геотермальные проявления Италии, р-н г. Сиена Образование гейзеритов. SiO2 > 90-95 %
- 44. Термальные источники на о. Сан-Мигель
- 45. Гидротермальный источник
- 46. Карбонатные отложения вулканического происхождения
- 47. Воронка смерти
- 49. Скачать презентацию


































 Музей имени Пушкина
Музей имени Пушкина Автор: Савасичев Константин 10Б Гимназия г.Юрги Научный руководитель: Рот Нина Валентиновна
Автор: Савасичев Константин 10Б Гимназия г.Юрги Научный руководитель: Рот Нина Валентиновна Сказочные птицы. Конспект занятия по рисованию в 7 классе
Сказочные птицы. Конспект занятия по рисованию в 7 классе Концепция и структура комплексного учебного курса «Основы религиозных культур и светской этики» презентацию под
Концепция и структура комплексного учебного курса «Основы религиозных культур и светской этики» презентацию под Национальные особенности и культура испанцев
Национальные особенности и культура испанцев КАК СТАТЬ ЛИДЕРОМ УРОК № 10 8/14/15
КАК СТАТЬ ЛИДЕРОМ УРОК № 10 8/14/15  Архитектура Internet
Архитектура Internet Презентация "Каждый народ изображает, украшает, строит" - скачать презентации по МХК
Презентация "Каждый народ изображает, украшает, строит" - скачать презентации по МХК Оптимизация процесса технико-тактической подготовки высококвалифицированных самбистов перед ответственными соревнованиями
Оптимизация процесса технико-тактической подготовки высококвалифицированных самбистов перед ответственными соревнованиями Презентация преподавателя дополнительного образования Соболевой Екатерины Валерьевны «Рисование» с использованием изолент
Презентация преподавателя дополнительного образования Соболевой Екатерины Валерьевны «Рисование» с использованием изолент Библиотечный этикет
Библиотечный этикет Основные теоретические подходы к понятию одаренности детей Кондрашова Л.В. учитель русского языка и литературы МБОУ СОШ №8 г.Кам
Основные теоретические подходы к понятию одаренности детей Кондрашова Л.В. учитель русского языка и литературы МБОУ СОШ №8 г.Кам Презентация Текстильная промышленность
Презентация Текстильная промышленность  Презентация на тему "ПАВЛОПОЛЬСЬКА ЗОШ" - скачать презентации по Педагогике
Презентация на тему "ПАВЛОПОЛЬСЬКА ЗОШ" - скачать презентации по Педагогике Культура Древней Руси 9-13 вв
Культура Древней Руси 9-13 вв «МНОГОГРАННОЕ ТВОРЧЕСТВО В.М.ВАСНЕЦОВА»
«МНОГОГРАННОЕ ТВОРЧЕСТВО В.М.ВАСНЕЦОВА» Электрические датчики механических величин и релейные элементы
Электрические датчики механических величин и релейные элементы Вклад Диофанта в развитие алгебры
Вклад Диофанта в развитие алгебры Биохимия онкогенеза
Биохимия онкогенеза  Шифрование данных
Шифрование данных Проект по продвижению комплекса ГТО среди сверстников: «ГТО - твой путь к успеху!»
Проект по продвижению комплекса ГТО среди сверстников: «ГТО - твой путь к успеху!» Электронные платежные системы в России
Электронные платежные системы в России  Порядок проверки и замены компрессора Dvm plus III
Порядок проверки и замены компрессора Dvm plus III Практический опыт реализации 187-ФЗ
Практический опыт реализации 187-ФЗ ПОРТФОЛИО Ослоповских Галина Николаевна учителя начальных классов первой квалификационной категории МОУ «Шутихинская средн
ПОРТФОЛИО Ослоповских Галина Николаевна учителя начальных классов первой квалификационной категории МОУ «Шутихинская средн Маркетинг в сфере услуг
Маркетинг в сфере услуг  Представление документов на государственную регистрацию в Росреестр
Представление документов на государственную регистрацию в Росреестр Barranquismo
Barranquismo