Содержание
- 2. Изолированное гетерогенное равновесие … … равновесие, которое устанавливается в насыщенном растворе малорастворимого вещества. Может быть выражено
- 3. Направление гетерогенного равновесия Определяется соотношением констант растворимости и произведениями концентраций ионов (Пс).
- 4. Факторы, влияющие на растворимость и образование осадков Введение одноимённого иона по уравнению приводит к сдвигу равновесия
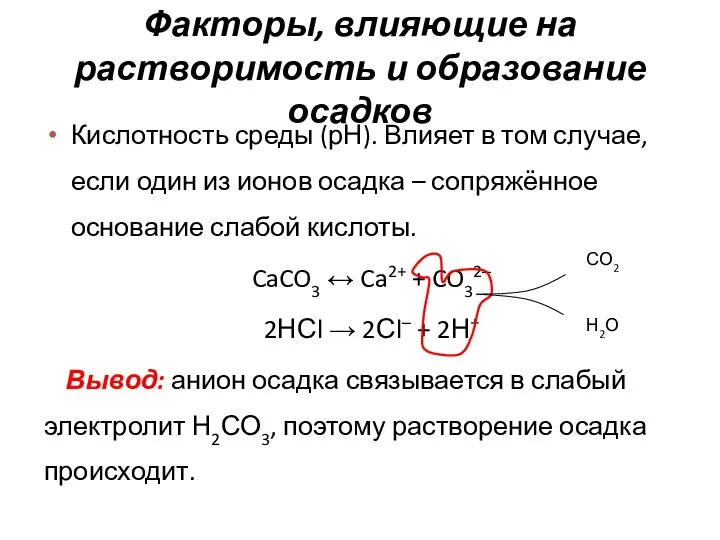
- 5. Факторы, влияющие на растворимость и образование осадков Кислотность среды (рН). Влияет в том случае, если один
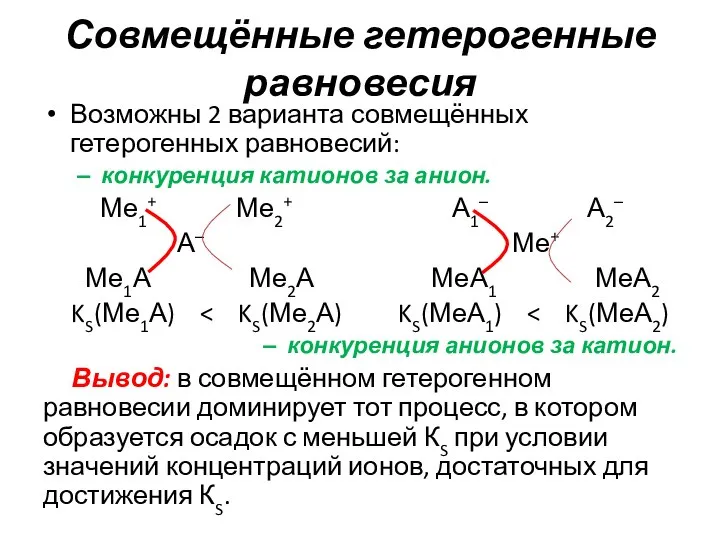
- 6. Совмещённые гетерогенные равновесия Возможны 2 варианта совмещённых гетерогенных равновесий: конкуренция катионов за анион. Ме1+ Ме2+ А1–
- 7. Совмещённые гетерогенные равновесия При невыполнении данного условия выполняется правило: 2 иона будут переходить в осадок одновременно,
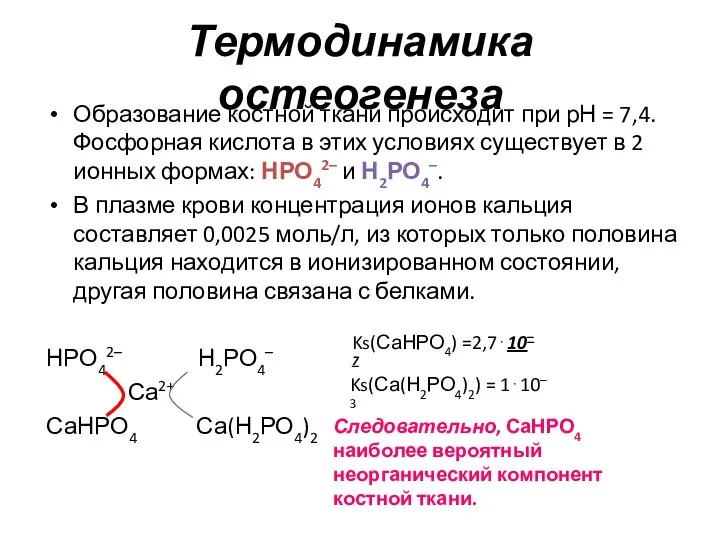
- 8. Термодинамика остеогенеза Образование костной ткани происходит при рН = 7,4. Фосфорная кислота в этих условиях существует
- 9. Термодинамика остеогенеза Далее идёт процесс депротонирования НРО42– иона с образованием основной соли: 3СаНРО4 + 2ОН– +
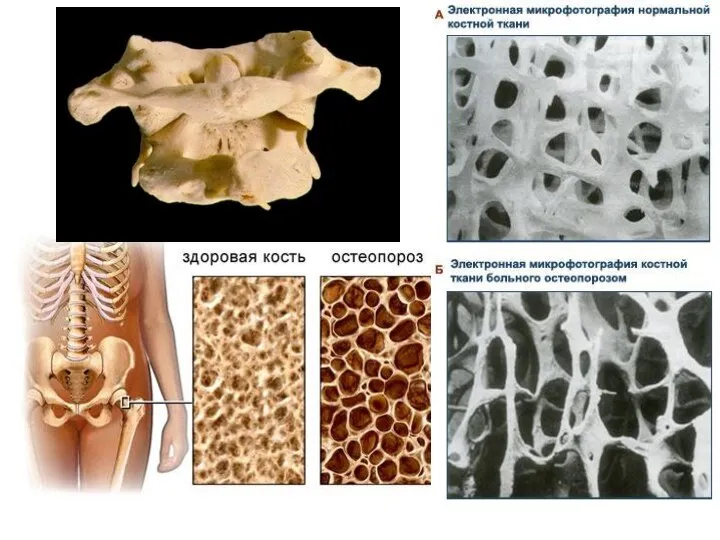
- 10. Термодинамика остеогенеза Увеличение концентрации ионов Са2+ в плазме крови приводит к отложению кальция в костной ткани.
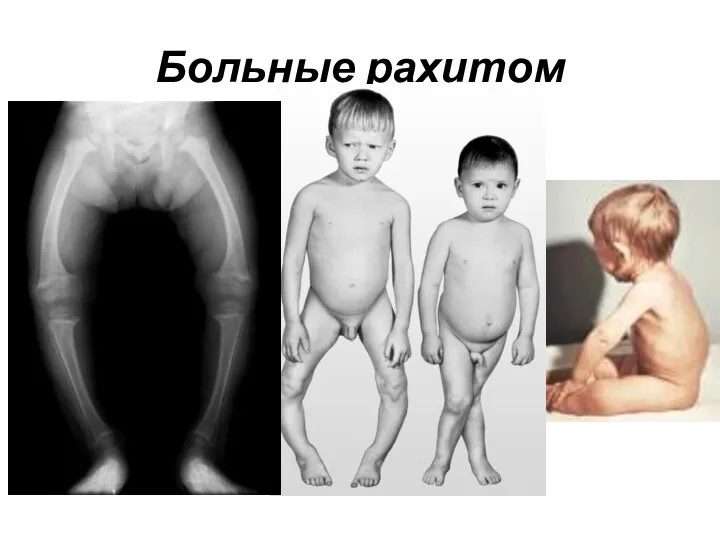
- 11. Больные рахитом
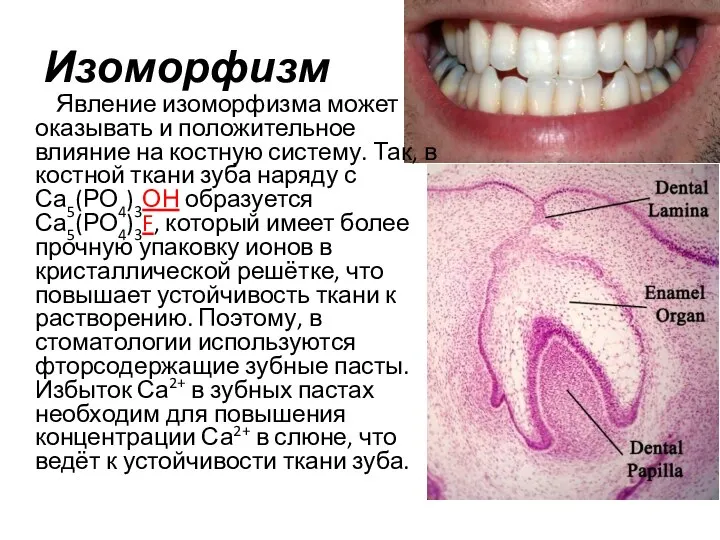
- 13. Изоморфизм – … … явление замещения частиц одного компонента в узлах кристаллической решётки частицами другого компонента.
- 14. Изоморфизм Явление изоморфизма может оказывать и положительное влияние на костную систему. Так, в костной ткани зуба
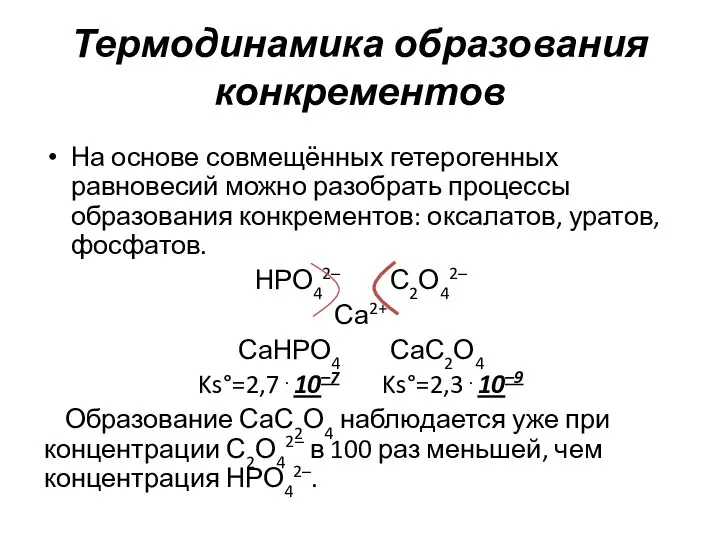
- 15. Термодинамика образования конкрементов На основе совмещённых гетерогенных равновесий можно разобрать процессы образования конкрементов: оксалатов, уратов, фосфатов.
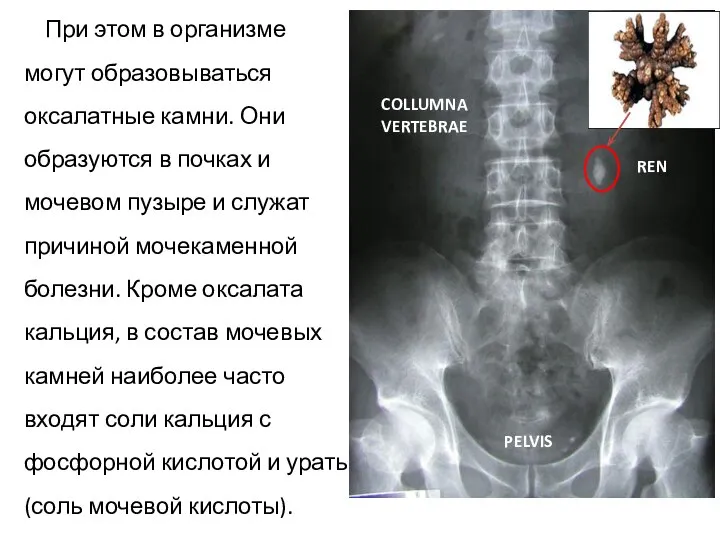
- 16. При этом в организме могут образовываться оксалатные камни. Они образуются в почках и мочевом пузыре и
- 17. Основным принципом лечения мочекаменной болезни является извлечение из конкрементов (камней) кальция с переводом его в растворимые
- 19. Скачать презентацию








 Обморожения и ожоги
Обморожения и ожоги Самоконтроль при занятиях физической культурой и спортом
Самоконтроль при занятиях физической культурой и спортом УТИЛИЗАЦИЯ АВТОПОКРЫШЕК
УТИЛИЗАЦИЯ АВТОПОКРЫШЕК Специализированные Учреждения ООН
Специализированные Учреждения ООН Педагогический_состав
Педагогический_состав Механизм газораспределения
Механизм газораспределения Презентація з теорії твору і тексту на тему “Співідношення поняття “твір” і “текст”
Презентація з теорії твору і тексту на тему “Співідношення поняття “твір” і “текст” Культура России в XVII веке
Культура России в XVII веке Спряжение глаголов в Präsens ( настоящем времени)
Спряжение глаголов в Präsens ( настоящем времени) Сжатые и растянутые железобетонные конструкции
Сжатые и растянутые железобетонные конструкции День банка в Альфа-Банк
День банка в Альфа-Банк Тесты по ОЦК, кровопотеря
Тесты по ОЦК, кровопотеря Модель «сущность-связь». Основные понятия: Сущность, Свойства, Связи.
Модель «сущность-связь». Основные понятия: Сущность, Свойства, Связи. Язык и речь
Язык и речь  Презентация на тему "Правила управления успехом на уроке" - скачать презентации по Педагогике
Презентация на тему "Правила управления успехом на уроке" - скачать презентации по Педагогике Контрольная работа по .NET
Контрольная работа по .NET Мастерская народного творчества "Василиса". Номинация "Прильну ко льну"
Мастерская народного творчества "Василиса". Номинация "Прильну ко льну" Стиль жизни ХХІ века. Tiens Group Corporation
Стиль жизни ХХІ века. Tiens Group Corporation ГОМЕОСТАЗ ЗУБА ПОСЛЕ ПРОРЕЗЫВАНИЯ. РЕЗИСТЕНТНОСТЬ ЭМАЛИ ЗУБА К КАРИОЗНОМУ ПОРАЖЕНИЮ. ВЛИЯНИЕ НА ПРОЦЕССЫ ФОРМИРОВАНИЯ, МИНЕРА
ГОМЕОСТАЗ ЗУБА ПОСЛЕ ПРОРЕЗЫВАНИЯ. РЕЗИСТЕНТНОСТЬ ЭМАЛИ ЗУБА К КАРИОЗНОМУ ПОРАЖЕНИЮ. ВЛИЯНИЕ НА ПРОЦЕССЫ ФОРМИРОВАНИЯ, МИНЕРА Развитие медицины в России в 19 веке
Развитие медицины в России в 19 веке Новая конституция РФ (часть 6)
Новая конституция РФ (часть 6) Презентация по вкусовым товарам. Кофе.
Презентация по вкусовым товарам. Кофе.  Характер
Характер Разработка и принятие Уголовного кодекса 1922 г.
Разработка и принятие Уголовного кодекса 1922 г. Презентация Классификация овощей
Презентация Классификация овощей  Презентация "Строительство из соломы" - скачать презентации по Экономике
Презентация "Строительство из соломы" - скачать презентации по Экономике Презентация по алгебре Типы иррациональных уравнений Примеры решения
Презентация по алгебре Типы иррациональных уравнений Примеры решения  Презентация на тему Формы государства
Презентация на тему Формы государства