Содержание
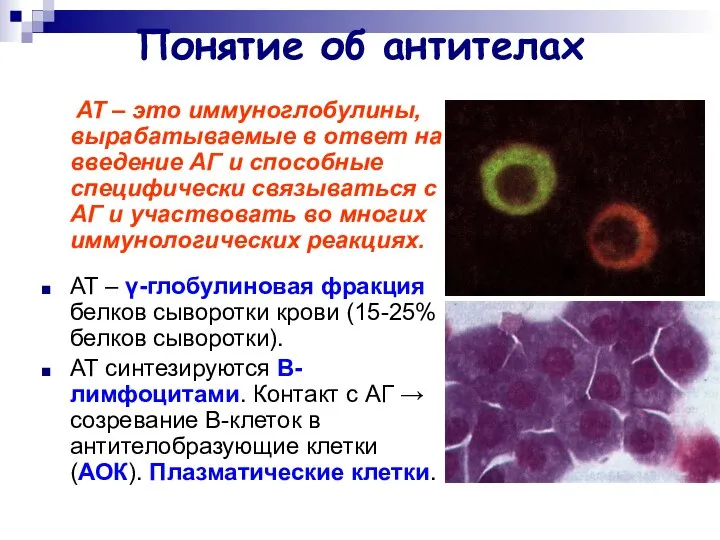
- 2. Понятие об антителах АТ – это иммуноглобулины, вырабатываемые в ответ на введение АГ и способные специфически
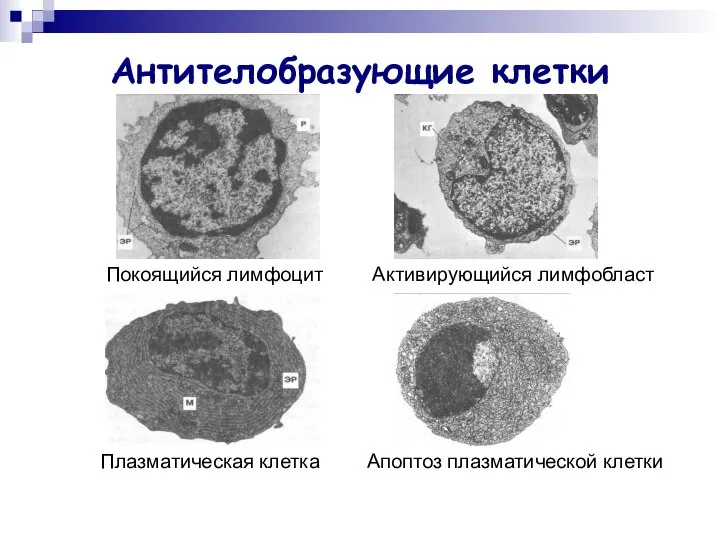
- 3. Антителобразующие клетки Покоящийся лимфоцит Активирующийся лимфобласт Плазматическая клетка Апоптоз плазматической клетки
- 4. Типы иммуноглобулинов Иммуноглобулины: ∙ циркулирующие АТ (сывороточные и секреторные); ∙ рецепторные молекулы на иммунных клетках; ∙
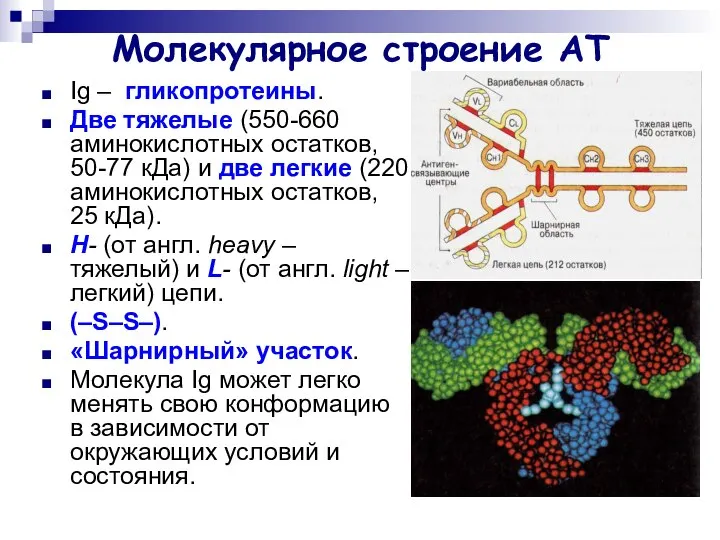
- 5. Молекулярное строение АТ Ig – гликопротеины. Две тяжелые (550-660 аминокислотных остатков, 50-77 кДа) и две легкие
- 6. Молекулярное строение АТ Легкие цепи: κ и λ. Тяжелые цепи: α, γ, μ, ε и δ.
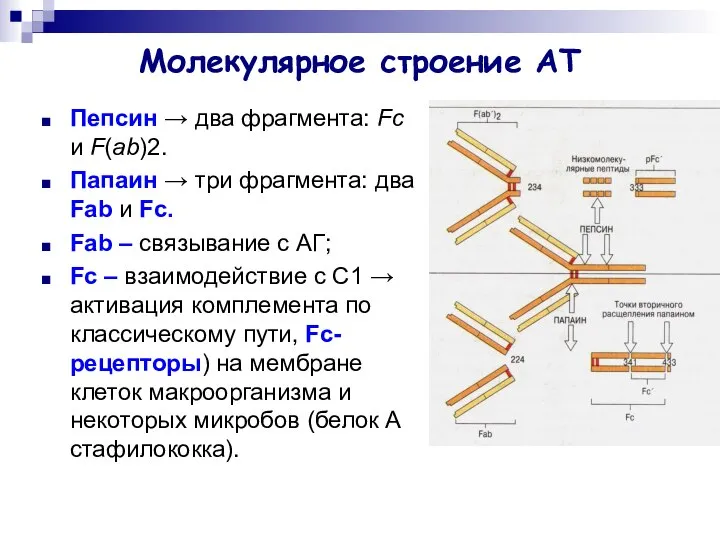
- 7. Молекулярное строение АТ Пепсин → два фрагмента: Fc и F(ab)2. Папаин → три фрагмента: два Fab
- 8. Дополнительные полипептидные цепи Ig IgM, IgA – J-пептид (от англ. join – соединяю). Секреторные IgA –
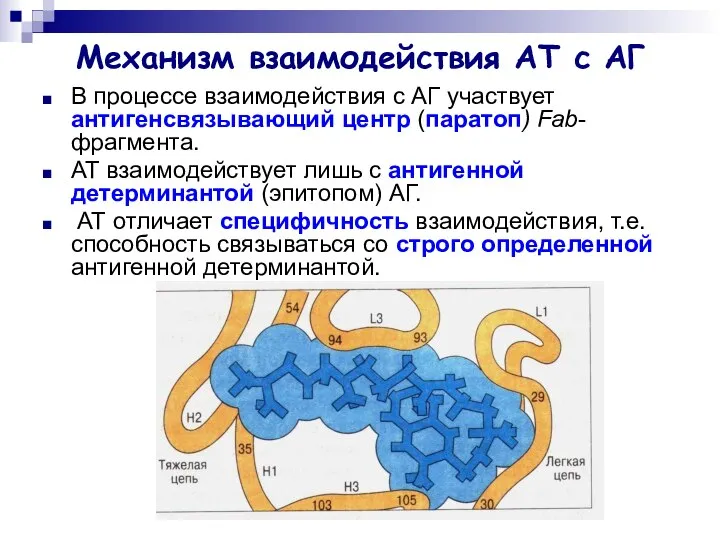
- 9. Механизм взаимодействия АТ с АГ В процессе взаимодействия с АГ участвует антигенсвязывающий центр (паратоп) Fab-фрагмента. АТ
- 10. Механизм взаимодействия АТ с АГ [АГ]+[АТ] ↔ [ИК] Сила нековалентной связи зависит прежде всего от расстояния
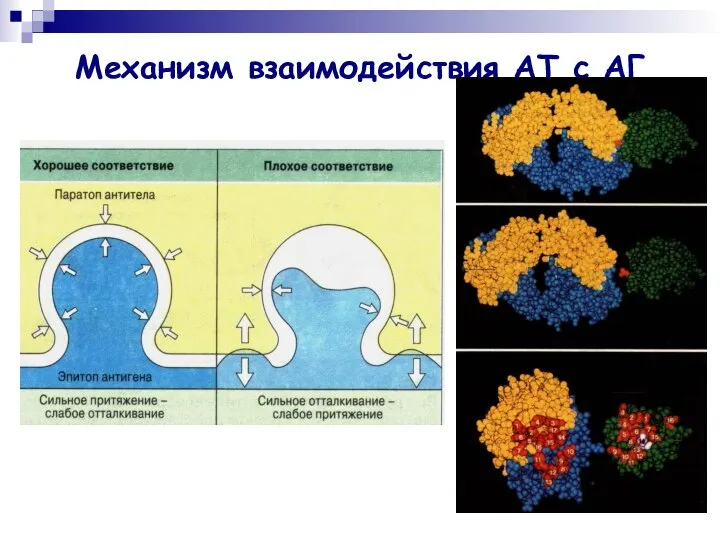
- 11. Механизм взаимодействия АТ с АГ
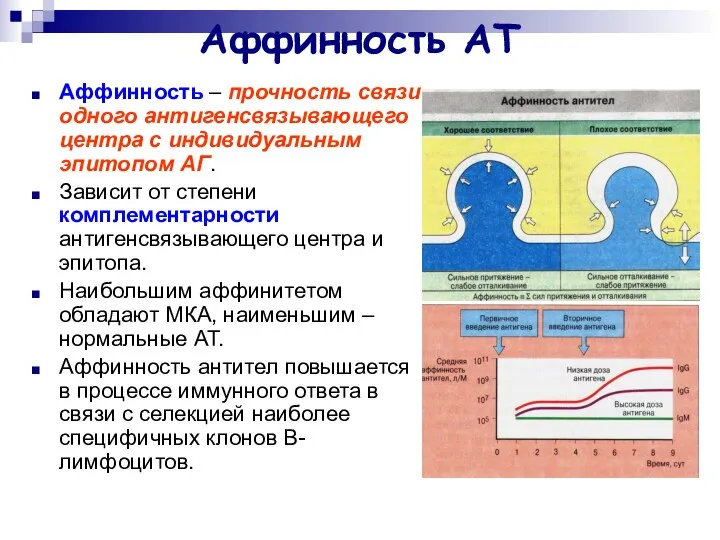
- 12. Аффинность АТ Аффинность – прочность связи одного антигенсвязывающего центра с индивидуальным эпитопом АГ. Зависит от степени
- 13. Авидность АТ Авидность – прочность связывания АТ и АГ (суммарная сила). Определяется аффинностью и числом антигенсвязывающих
- 14. Эффективность взаимодействия АГ и АТ Доступность эпитопа для антигенсвязывающего центра Ig, число эпитопов в составе молекулы
- 15. Защитные механизмы гуморального иммунитета Cвязывание с АГ : ∙ маркирование АГ, инактивация биологически активных молекул (токсинов),
- 16. Структурно-функциональные особенности иммуноглобулинов различных классов Молекулы, содержащие тяжелую цепь α-типа, относят к изотипу А (сокращенно IgА),
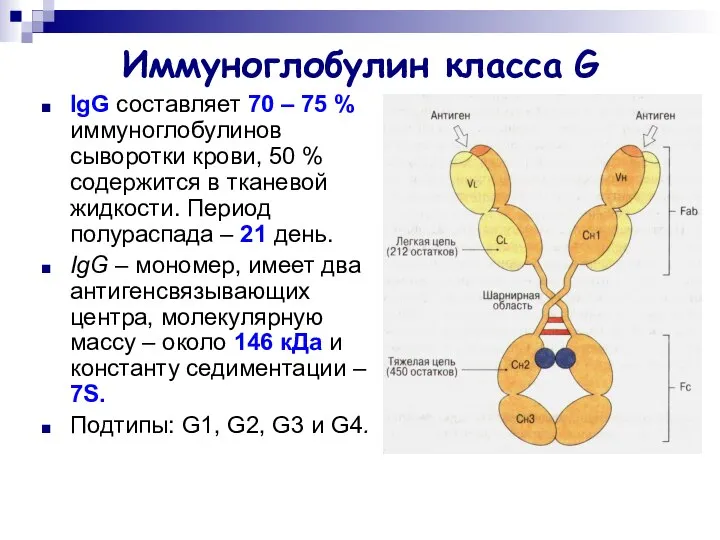
- 17. Иммуноглобулин класса G IgG составляет 70 – 75 % иммуноглобулинов сыворотки крови, 50 % содержится в
- 18. Иммуноглобулин класса G IgG синтезируется зрелыми B-лимфоцитами (Вγ) и плазматическими клетками, хорошо определяется в сыворотке крови
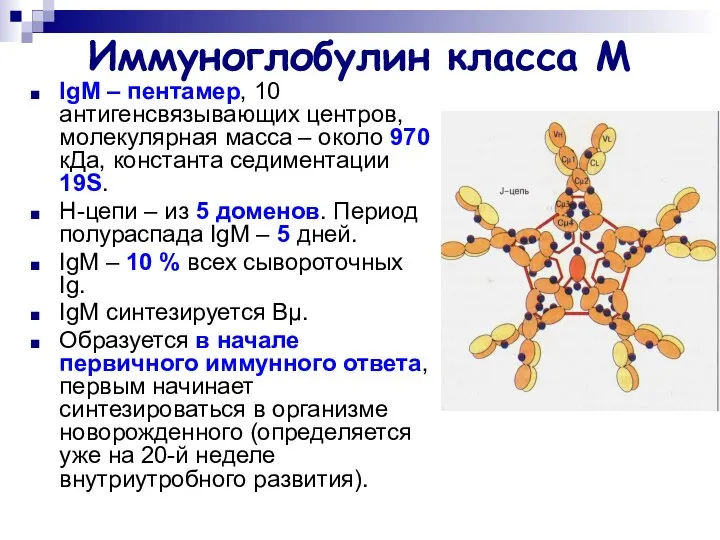
- 19. Иммуноглобулин класса М IgМ – пентамер, 10 антигенсвязывающих центров, молекулярная масса – около 970 кДа, константа
- 20. Иммуноглобулин класса М IgМ – высокая авидность, связывает комплемент, сывороточный и секреторный гуморальный иммунитет. Большая часть
- 21. Иммуноглобулин класса А Сывороточный IgА: около 15 – 20 % всех сывороточных Ig. Период полураспада IgА
- 22. Иммуноглобулин класса А Секреторный (sIgА): ди-, три- или тетрамеры, содержит J- и S-пептиды. Молекулярная масса IgА
- 23. Иммуноглобулин класса Е IgЕ – реагины – около 0,002 % всех циркулирующих Ig, молекулярная масса около
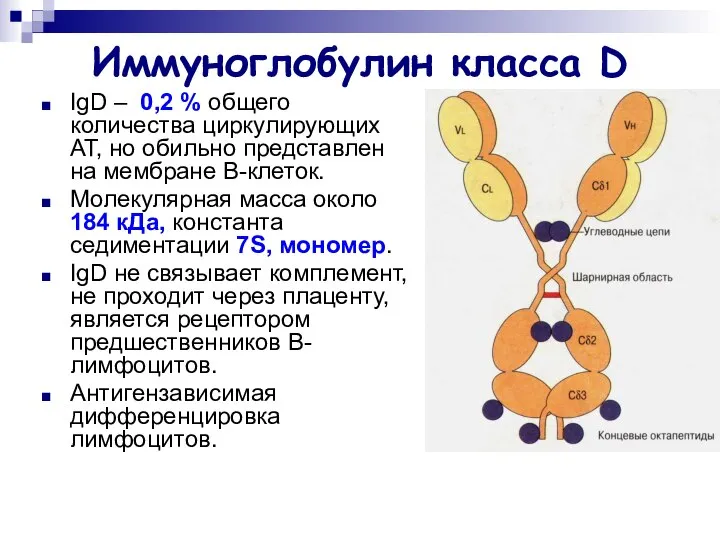
- 24. Иммуноглобулин класса D IgD – 0,2 % общего количества циркулирующих АТ, но обильно представлен на мембране
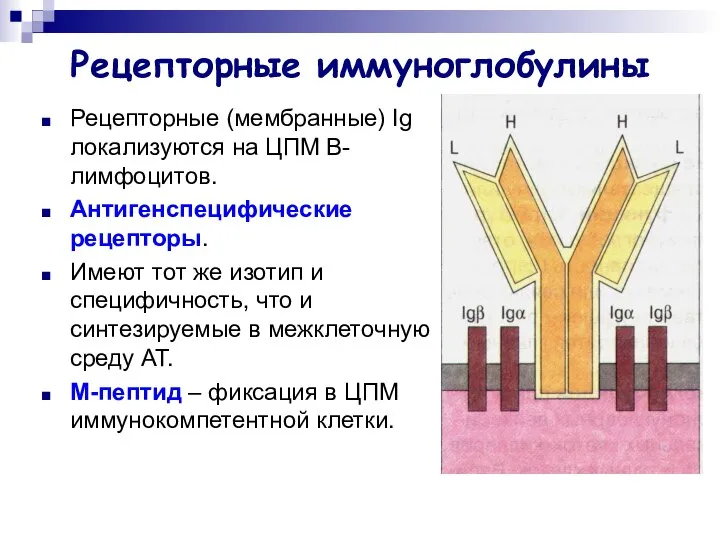
- 25. Рецепторные иммуноглобулины Рецепторные (мембранные) Ig локализуются на ЦПМ B-лимфоцитов. Антигенспецифические рецепторы. Имеют тот же изотип и
- 26. Нормальные антитела Нормальные (естественные) АТ – базальный уровень иммуноглобулинов. Изогемагглютинины – АТ, направленные против эритроцитарных АГ
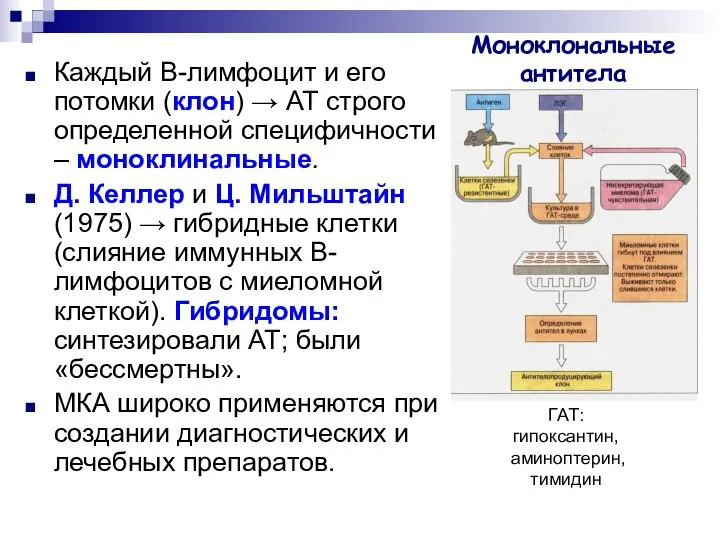
- 27. Моноклональные антитела Каждый B-лимфоцит и его потомки (клон) → АТ строго определенной специфичности – моноклинальные. Д.
- 28. Полные и неполные антитела Полные АТ – способны образовывать в РА или РП хорошо различимую глазом
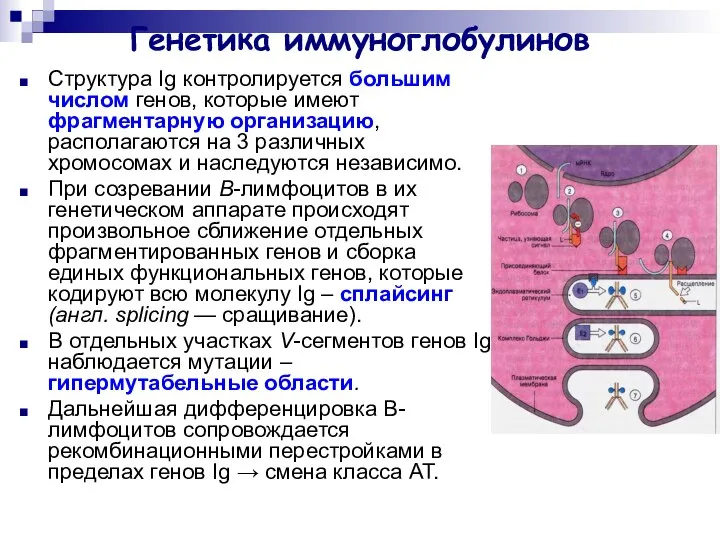
- 29. Генетика иммуноглобулинов Структура Ig контролируется большим числом генов, которые имеют фрагментарную организацию, располагаются на 3 различных
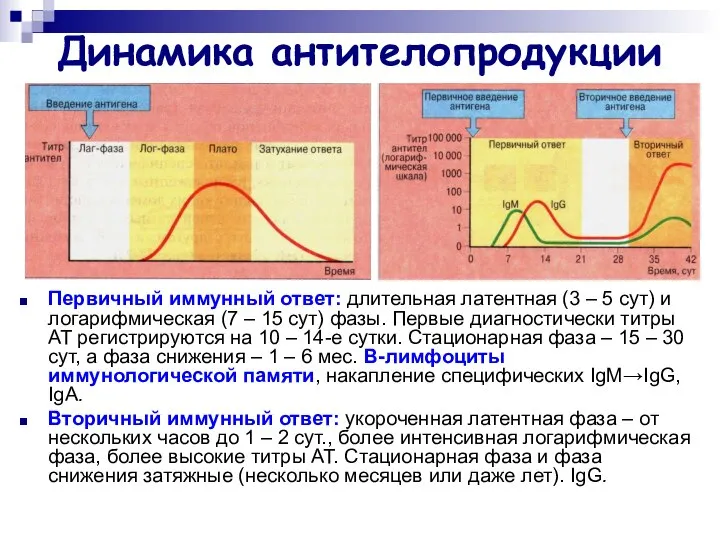
- 30. Динамика антителопродукции Первичный иммунный ответ: длительная латентная (3 – 5 сут) и логарифмическая (7 – 15
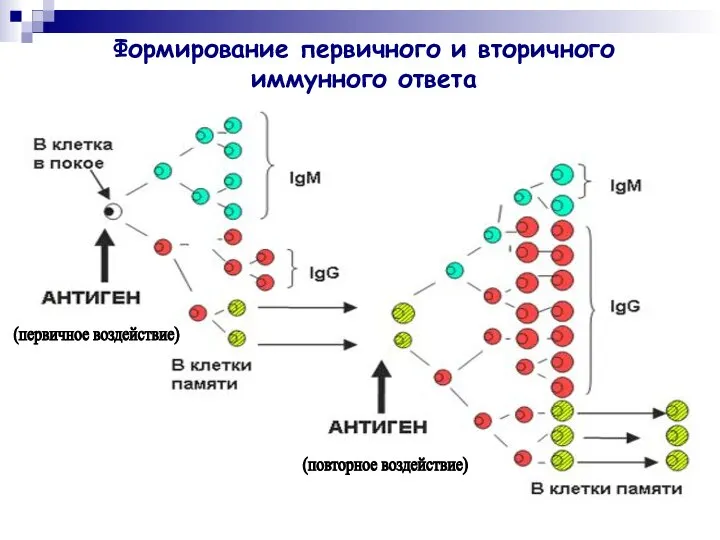
- 31. Формирование первичного и вторичного иммунного ответа (первичное воздействие) (повторное воздействие)
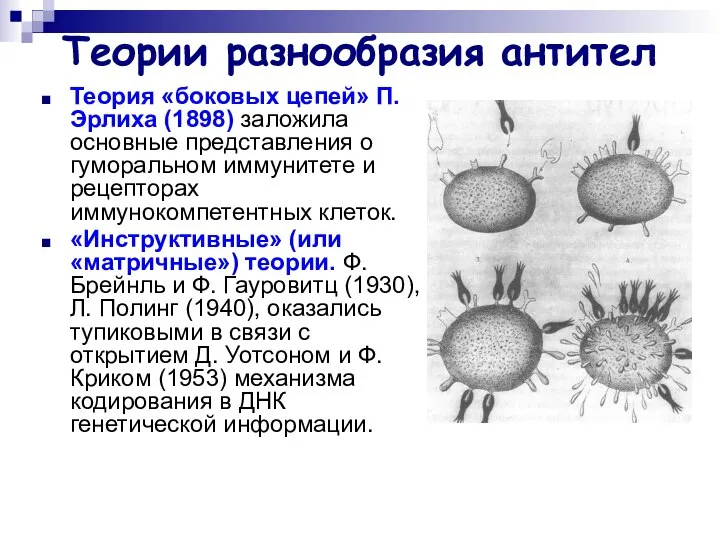
- 32. Теории разнообразия антител Теория «боковых цепей» П. Эрлиха (1898) заложила основные представления о гуморальном иммунитете и
- 33. Теории разнообразия антител «Клонально-селекционная» теория Ф. Бернета. Лимфоидная ткань состоит из огромного числа клонов лимфоцитов, которые
- 34. Теории разнообразия антител Молекулярно-генетическая теория С. Тонегавы. Теория сетевой регуляции иммунной системы. В основе Н. идея
- 35. Теории разнообразия антител В 60-е годы П.Ф. Здродовский → физиологическая концепция иммуногенеза – гипоталамо-адреналовая теория регуляции
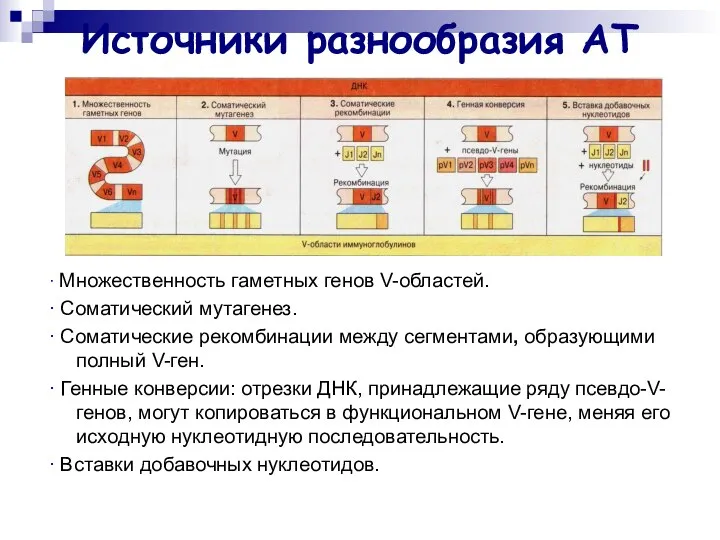
- 36. Источники разнообразия АТ ∙ Множественность гаметных генов V-областей. ∙ Соматический мутагенез. ∙ Соматические рекомбинации между сегментами,
- 38. Скачать презентацию



![Механизм взаимодействия АТ с АГ [АГ]+[АТ] ↔ [ИК] Сила нековалентной связи](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1303076/slide-9.jpg)













 ККО Прокопьевск-ПК-Угольный. Система видеонаблюдения
ККО Прокопьевск-ПК-Угольный. Система видеонаблюдения Как нарисовать рыбку? - презентация для начальной школы_
Как нарисовать рыбку? - презентация для начальной школы_ Государственное регулирование охраны здоровья граждан, здравоохранения и медицинской деятельности
Государственное регулирование охраны здоровья граждан, здравоохранения и медицинской деятельности Геополитические взаимоотношения России и Китая
Геополитические взаимоотношения России и Китая Проект о создание Туризма В Шегарском районе, области, стране, зарубежье
Проект о создание Туризма В Шегарском районе, области, стране, зарубежье Кондиционирование воздуха
Кондиционирование воздуха Социальные сети - современный инструмент для профессионального общения библиотекарей
Социальные сети - современный инструмент для профессионального общения библиотекарей древнерусская литература 1 ур
древнерусская литература 1 ур ТЕЛЕСКОПИ
ТЕЛЕСКОПИ Влияние алкоголя на организм человека Исполнители: Поротников Антон, Паклин Роман ученики 8 «б» класс
Влияние алкоголя на организм человека Исполнители: Поротников Антон, Паклин Роман ученики 8 «б» класс Люсьен Теньер
Люсьен Теньер Альбрехт Дюрер (1471-1528)
Альбрехт Дюрер (1471-1528) Основные способы плавания
Основные способы плавания Организация крупного фармпроизводства в соответствии со стандартом GMP
Организация крупного фармпроизводства в соответствии со стандартом GMP Травматизм. Первичная и вторичная профилактика. Первая помощь при травмах.
Травматизм. Первичная и вторичная профилактика. Первая помощь при травмах.  грибы - презентация для начальной школы
грибы - презентация для начальной школы Презентация Лизинг
Презентация Лизинг Эпиграфы
Эпиграфы Expression language
Expression language Мотивация деятельности в менеджменте
Мотивация деятельности в менеджменте  Практика привлечения к субсидиарной ответственности
Практика привлечения к субсидиарной ответственности Заглавная буква в именах существительных - презентация для начальной школы_
Заглавная буква в именах существительных - презентация для начальной школы_ Asynchronous Transfer Mode Обзор технологии
Asynchronous Transfer Mode Обзор технологии Класс Земноводные
Класс Земноводные «Путешествие по страницам школьной жизни» Составитель: Иванова Марина Васильевна, учитель начальн
«Путешествие по страницам школьной жизни» Составитель: Иванова Марина Васильевна, учитель начальн Відмінювання числівників
Відмінювання числівників Программирование на языке Си
Программирование на языке Си Презентация Исполнительная власть в механизме государственной власти
Презентация Исполнительная власть в механизме государственной власти